上海市莘庄中学2022-2023学年高一下学期化学期末考试试题
试卷更新日期:2023-08-15 类型:期末考试
一、实验题
-
1. 以下是测定中结晶水含量的实验流程:
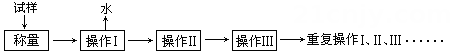 (1)、应放在(填仪器名称)中加热。(2)、重复操作Ⅰ、Ⅱ、Ⅲ这叫操作,目的是。(3)、操作Ⅱ必须要在(填仪器名称)中进行,原因是。(4)、完成下列表格中数据处理:(保留两位有效数字)
(1)、应放在(填仪器名称)中加热。(2)、重复操作Ⅰ、Ⅱ、Ⅲ这叫操作,目的是。(3)、操作Ⅱ必须要在(填仪器名称)中进行,原因是。(4)、完成下列表格中数据处理:(保留两位有效数字)恒重|减小实验误差
第一次实验
第二次实验
坩埚的质量(g)
14.520
14.670
坩埚+试样的质量(g)
17.020
18.350
恒重后,坩埚+硫酸铜的质量(g)
16.070
17.004
第一次实验: , 第二次实验:。两次所测x的平均值为。
2. 微量实验具有用量少,污染小,操作简单,现象明显等特点,硬质玻璃管可用于气体微量实验的场所。如图所示,将浓硫酸滴入培养皿后,会产生一种无色的气体。一段时间后,a、b、c、d四个棉球都褪为白色。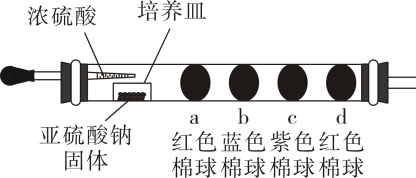 (1)、a棉球变白后,微热该处一段时间,棉球又恢复红色,则a棉球上滴有的溶液为。(2)、b棉球上滴有的溶液为。发生反应的化学方程式为。(3)、c棉球上滴有酸性高锰酸钾溶液,它变为白色原因与(填“a”、或“b”)棉球相同,说明无色气体具有性。(4)、d棉球上滴有NaOH溶液(混有酚酞),棉球变为白色说明无色气体溶于水显性。(5)、装置末端通入充满硫化氢溶液中,现象是 , 反应的化学反应方程式为。说明无色气体具有性。3. 实验甲用如图所示的装置制备白色的
(1)、a棉球变白后,微热该处一段时间,棉球又恢复红色,则a棉球上滴有的溶液为。(2)、b棉球上滴有的溶液为。发生反应的化学方程式为。(3)、c棉球上滴有酸性高锰酸钾溶液,它变为白色原因与(填“a”、或“b”)棉球相同,说明无色气体具有性。(4)、d棉球上滴有NaOH溶液(混有酚酞),棉球变为白色说明无色气体溶于水显性。(5)、装置末端通入充满硫化氢溶液中,现象是 , 反应的化学反应方程式为。说明无色气体具有性。3. 实验甲用如图所示的装置制备白色的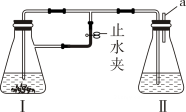
供选择的试剂有:①铁粉②稀硫酸③NaOH
(1)、装置Ⅰ中加入(填写编号)。(2)、本实验成功的关键是____。A、实验过程中隔绝空气(氧气) B、实验过程中空气(氧气)充足(3)、若控制不当,将会生成色的沉淀。反应的化学方程式为。(4)、若装置Ⅱ中a处收集的纯净后,如何操作会得到白色的沉淀?。(5)、实验乙组用如下实验步骤探究和的性质分别取一定量、固体,均配制成0.1mol/L的溶液。为防止溶液被氧化,可向溶液中加入
A.铁片 B.酸性溶液
发生的离子方程式为:。
(6)、取2mL溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。书写溶液与氯水反应的离子方程式:。(7)、将铁粉放入下列物质中,铁粉溶解而溶液质量减少的是____。A、 B、稀硫酸 C、NaOH D、(8)、常温下,将铁片投入浓中,下列说法正确的是____。A、不发生反应 B、铁被钝化 C、产生大量 D、产生大量4. 某兴趣小组同学制定如下三个方案对含有NaCl杂质的碳酸氢钠的含量进行测定:(1)、方案一:用图装置测定样品与足量稀硫酸反应生成的体积。
为了减小实验误差,量气管中液体M的选择原则是。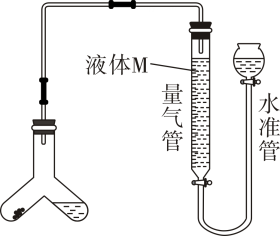 (2)、若实验测得样品中小苏打含量低于样品实际含量,可能的原因是____。A、气体中含有水蒸气 B、测定气体体积时来冷却至室温 C、Y型管中留有反应生成的气体 D、测定气体体积时水准管的液面高于量气管的液面(3)、方案二:测定上述样品中碳酸氢钠的质量分数还可通过图装置进行测定。
(2)、若实验测得样品中小苏打含量低于样品实际含量,可能的原因是____。A、气体中含有水蒸气 B、测定气体体积时来冷却至室温 C、Y型管中留有反应生成的气体 D、测定气体体积时水准管的液面高于量气管的液面(3)、方案二:测定上述样品中碳酸氢钠的质量分数还可通过图装置进行测定。
实验需使用的定量仪器是;写出涉及的化学方程式。
(4)、方案三:通过以下流程测定样品的含量。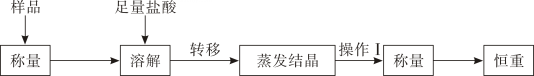
操作Ⅰ的名称为 , 根据以上实验过程,含有氯化钠的碳酸氢钠样品中碳酸氢钠的质量分数可表示为:。(样品为m1g,恒重后固体质量为m2g)
二、填空题
-
5. 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。
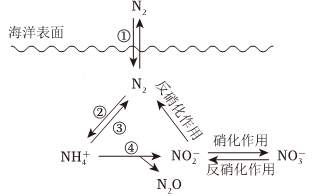 (1)、氮气的电子式:。海洋中的氮循环属于固氮作用的一步是(填图中的数字序号)。(2)、下列关于海洋氮循环的说法不正确的是____。A、海洋中存在游离态的氮 B、海洋中的氮循环起始于氮的还原 C、向海洋排放含的废水会影响海洋中的含量 D、海洋中的反硝化作用一定有氧气的参与(3)、如图所示,将集有氨气的试管倒置于水槽中,观察到的现象是。酚酞变色的原因是(用方程式表示):。
(1)、氮气的电子式:。海洋中的氮循环属于固氮作用的一步是(填图中的数字序号)。(2)、下列关于海洋氮循环的说法不正确的是____。A、海洋中存在游离态的氮 B、海洋中的氮循环起始于氮的还原 C、向海洋排放含的废水会影响海洋中的含量 D、海洋中的反硝化作用一定有氧气的参与(3)、如图所示,将集有氨气的试管倒置于水槽中,观察到的现象是。酚酞变色的原因是(用方程式表示):。 6. 从宏观和微观两个角度认识元素的单质及其化合物是学好中学化学的重要基础。(1)、组成的三种元素,其对应的简单离子半径由小到大的顺序为。(2)、、、、、5种微粒,所属元素的种类有种(3)、下列各组物质中,含有化学键类型都相同的是____。A、HI和NaCl B、NaF和KOH C、CO和HCl D、和NaBr(4)、将HCl和NaCl分别溶于水。下列说法正确的是____。A、HCl的离子键被破坏 B、NaCl的共价键被破坏 C、HCl和NaCl的化学键均遭破坏 D、HCl和NaCl的化学键均未遭破坏(5)、能用于比较Cl与S非金属性强弱的依据是____。A、熔沸点:硫单质>氯单质 B、酸性: C、热稳定性: D、氧化性:7. 为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有颗粒的装置,它的用途是产生氧气。(1)、下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是____。A、Na和 B、NaOH和 C、和NaOH D、和HCl(2)、写出的电子式 , 其晶体中存在的化学键类型是。(3)、下列关于的叙述正确的是____。A、中正、负离子的个数比为1∶1 B、分别与水及反应产生相同量的时,需要水和的质量相等 C、分别与水及反应产生相同量的时,转移电子的物质的量相等 D、的漂白原理与的漂白原理相同(4)、可用氢氧化钠溶液吸收,若将0.01mol的通入0.03mol的氢氧化钠溶液中,充分反应后,溶液中的溶质为(写化学式)(5)、向(4)中反应后的溶液中逐滴加入0.1mol/L的盐酸,并及时振荡,以下哪张图符合产生的气体体积与加入盐酸的体积的关系(其中B、C、D图中分别有、、)____A、
6. 从宏观和微观两个角度认识元素的单质及其化合物是学好中学化学的重要基础。(1)、组成的三种元素,其对应的简单离子半径由小到大的顺序为。(2)、、、、、5种微粒,所属元素的种类有种(3)、下列各组物质中,含有化学键类型都相同的是____。A、HI和NaCl B、NaF和KOH C、CO和HCl D、和NaBr(4)、将HCl和NaCl分别溶于水。下列说法正确的是____。A、HCl的离子键被破坏 B、NaCl的共价键被破坏 C、HCl和NaCl的化学键均遭破坏 D、HCl和NaCl的化学键均未遭破坏(5)、能用于比较Cl与S非金属性强弱的依据是____。A、熔沸点:硫单质>氯单质 B、酸性: C、热稳定性: D、氧化性:7. 为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有颗粒的装置,它的用途是产生氧气。(1)、下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是____。A、Na和 B、NaOH和 C、和NaOH D、和HCl(2)、写出的电子式 , 其晶体中存在的化学键类型是。(3)、下列关于的叙述正确的是____。A、中正、负离子的个数比为1∶1 B、分别与水及反应产生相同量的时,需要水和的质量相等 C、分别与水及反应产生相同量的时,转移电子的物质的量相等 D、的漂白原理与的漂白原理相同(4)、可用氢氧化钠溶液吸收,若将0.01mol的通入0.03mol的氢氧化钠溶液中,充分反应后,溶液中的溶质为(写化学式)(5)、向(4)中反应后的溶液中逐滴加入0.1mol/L的盐酸,并及时振荡,以下哪张图符合产生的气体体积与加入盐酸的体积的关系(其中B、C、D图中分别有、、)____A、 B、
B、 C、
C、 D、
D、
三、元素或物质推断题
-
8. 元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分。
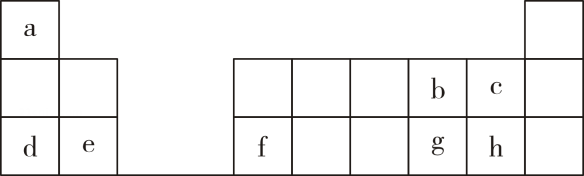 (1)、元素g在周期表中的位置可表示为____。A、第三周期第6族 B、第一周期VI主族 C、第三周期第6A族 D、第三周期VIA族(2)、a-h元素的最高价氧化物X应的水化物中,酸性最强的酸是(填化学式)。(3)、b元素有三种稳定核素,其式量分别为16、17、18,则三种核素的中子数之比为。(4)、c、g、h三种元素形成的气态氢化物中,稳定性最小的物质的结构式是。(5)、d元素的简单离子的结构示意图为。(6)、工业上冶炼f单质的化学方程式为。(7)、若d单质着火,可用于灭火的物质是____。A、自来水 B、 C、干沙子 D、湿抹布(8)、下列关于元素周期表的叙述正确的是____。A、元素周期表中所含元素最多的族是ⅦB族 B、ⅠA族的元素全部是金属元素 C、在元素周期表中金属与非金属的分界处可以找到半导体材料 D、只有ⅡA族元素的原子最外层有2个电子
(1)、元素g在周期表中的位置可表示为____。A、第三周期第6族 B、第一周期VI主族 C、第三周期第6A族 D、第三周期VIA族(2)、a-h元素的最高价氧化物X应的水化物中,酸性最强的酸是(填化学式)。(3)、b元素有三种稳定核素,其式量分别为16、17、18,则三种核素的中子数之比为。(4)、c、g、h三种元素形成的气态氢化物中,稳定性最小的物质的结构式是。(5)、d元素的简单离子的结构示意图为。(6)、工业上冶炼f单质的化学方程式为。(7)、若d单质着火,可用于灭火的物质是____。A、自来水 B、 C、干沙子 D、湿抹布(8)、下列关于元素周期表的叙述正确的是____。A、元素周期表中所含元素最多的族是ⅦB族 B、ⅠA族的元素全部是金属元素 C、在元素周期表中金属与非金属的分界处可以找到半导体材料 D、只有ⅡA族元素的原子最外层有2个电子