上海市重点中学2022-2023学年高一下学期化学期末考试试题
试卷更新日期:2023-08-15 类型:期末考试
一、填空题
-
1. 人类对原子结构的探索为科技发展带来了卓越贡献,门捷列夫发现的元素周期律也为研究物质性质,合成新的物质做出了重要的指导作用。(1)、工业焊接钢管时常用进行“无损探伤”,该原子____A、质子数是82 B、中子数是55 C、与互为同位素 D、摩尔质量是137(2)、下列变化中破坏共价键的是____A、冰融化 B、NaOH融化 C、HCl溶于水 D、干冰升华2. 钠是一种活泼金属,其化合物在生产生活中具有广泛应用。(1)、下列有关钠及其化合物的说法正确的是____。A、少量钠保存在酒精中 B、Na2O2是白色固体,性质不稳定 C、热稳定性: D、常用来治疗胃酸过多(2)、下列试剂可以鉴别NaHCO3溶液和Na2CO3溶液的是____。A、Ba(OH)2 B、NaOH溶液 C、CaCl2溶液 D、稀盐酸(3)、Na2O2因能与CO2反应可作潜水艇的供氧剂,涉及的反应方程式为。(4)、向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液退色,发生如下反应:+Na2O2+=Mn2++Na+++
补全方程式并配平,该反应说明Na2O2粉末具有(填“氧化性”“还原性”或“漂白性”)。
(5)、将过氧化钠粉末投入到氯化亚铁溶液中,有关现象说法正确的是____。A、生成红褐色沉淀 B、没有气体产生 C、生成白色沉淀 D、有无色气体产生(6)、向100mLNaOH溶液中通入一定量CO2 , 充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2mol·L-1的盐酸,所得气体的体积与所加盐酸体积的关系如图所示。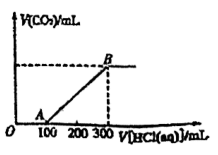
①OA段发生反应的离子方程式为。
②混合溶液中Na2CO3和NaHCO3的物质的量之比为。
③原NaOH溶液的物质的量浓度为mol/L。
3. 铁及其化合物在人类的生活和工业生产中扮演着不可替代的角色。(1)、不锈钢在生活中的应用十分广泛,不锈钢通常是铁和碳、镍等形成的的合金,关于不锈钢和纯铁的比较,描述错误的是____。A、不锈钢的硬度比纯铁高 B、不锈钢比纯铁更耐腐蚀 C、不锈钢是混合物 D、不锈钢中所含的元素都是过渡元素(2)、FeSO4是补血剂的主要成分,若要检验某补血剂是否完全变质,可选择试剂____。A、NaOH B、Fe C、KSCN D、KMnO44. 现代社会的一切活动都离不开能量,化学反应在发生物质变化的同时伴随能量的变化。(1)、一定条件下,白磷转化为红磷的能量关系如图所示。在该条件下,下列说法正确的是____。 A、白磷比红磷稳定 B、等质量的红磷与白磷完全燃烧释放的热量相同 C、红磷与白磷互为同位素 D、红磷转化为白磷是吸热反应(2)、下列说法中,正确的是____。A、发生化学反应时,化学能一定转化为热能 B、化学键的断裂和形成是化学反应中能量变化的主要原因 C、化学反应能量的变化与反应物的物质的量大小无关 D、当生成物总能量高于反应物总能量时,反应放热(3)、某装置如图所示,下列说法正确的是____。
A、白磷比红磷稳定 B、等质量的红磷与白磷完全燃烧释放的热量相同 C、红磷与白磷互为同位素 D、红磷转化为白磷是吸热反应(2)、下列说法中,正确的是____。A、发生化学反应时,化学能一定转化为热能 B、化学键的断裂和形成是化学反应中能量变化的主要原因 C、化学反应能量的变化与反应物的物质的量大小无关 D、当生成物总能量高于反应物总能量时,反应放热(3)、某装置如图所示,下列说法正确的是____。 A、外电路的电流方向为:Y→X B、X极上发生的是还原反应 C、溶液中氢离子向X极移动 D、若两电极都是金属,则活动性顺序:X>Y(4)、NOCl常用于有机合成,合成原理如图所示,反应过程中的能量变化如图所示,写出合成NOCl的热化学方程式。曲线从a变为b改变的条件是。
A、外电路的电流方向为:Y→X B、X极上发生的是还原反应 C、溶液中氢离子向X极移动 D、若两电极都是金属,则活动性顺序:X>Y(4)、NOCl常用于有机合成,合成原理如图所示,反应过程中的能量变化如图所示,写出合成NOCl的热化学方程式。曲线从a变为b改变的条件是。 5. 化学反应可视为旧键断裂和新键形成的过程。已知拆开1molH—H键、1molCl—Cl键、1molH—Cl键分别需要吸收的能量为436.4kJ、242.7kJ、431.8kJ。
5. 化学反应可视为旧键断裂和新键形成的过程。已知拆开1molH—H键、1molCl—Cl键、1molH—Cl键分别需要吸收的能量为436.4kJ、242.7kJ、431.8kJ。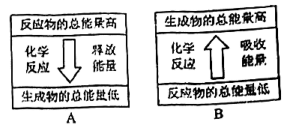
H2可以在Cl2中安静地燃烧。上图能表示该反应能量变化的是图(填“A”或“B”)。由H2和Cl2反应生成1molHCl需要(填“放出”或“吸收”)kJ的热量。
6. 某小组进行了如下实验对化学反应中的能量转化进行探究,已知甲、乙两个烧杯中分别盛有相同物质的量浓度的稀硫酸。(1)、乙装置中铜片作极,极反应式为;总反应的离子方程式为。当装置中有0.5mol电子通过时,溶液质量变化为(填“增加”或“减少”)g。(2)、甲、乙两个装置中,锌片的腐蚀速率较快的是(填“甲”或“乙”) 7. 化学反应速率与化学平衡原理等理论对于工业生产有着重要的指导意义。(1)、实验室在启普发生器中加入锌粒和稀硫酸制取氢气,可加快反应速率的措施是____。A、用浓硫酸代替稀硫酸 B、给装置部分加热 C、滴加少量硫酸铜溶液 D、将锌粒改为锌粉(2)、已达到平衡的可逆反应,增大压强后,反应速率变化如图所示,该反应可能是____。
7. 化学反应速率与化学平衡原理等理论对于工业生产有着重要的指导意义。(1)、实验室在启普发生器中加入锌粒和稀硫酸制取氢气,可加快反应速率的措施是____。A、用浓硫酸代替稀硫酸 B、给装置部分加热 C、滴加少量硫酸铜溶液 D、将锌粒改为锌粉(2)、已达到平衡的可逆反应,增大压强后,反应速率变化如图所示,该反应可能是____。 A、 B、 C、 D、8. 近年来,将氯化氢转化为氟气的技术成为科学研究的热点。工业上用O2将HCl转化为Cl2 , 可减少污染。在传统催化剂并加热条件下可实现该转化(反应混合物均为气态),方程式如下:(1)、某温度下,将一定量的O2和HCl通入4L的密闭容器中,反应过程中氧气的变化量如图所示,则0~20min平均反应速率v(HCI)为。
A、 B、 C、 D、8. 近年来,将氯化氢转化为氟气的技术成为科学研究的热点。工业上用O2将HCl转化为Cl2 , 可减少污染。在传统催化剂并加热条件下可实现该转化(反应混合物均为气态),方程式如下:(1)、某温度下,将一定量的O2和HCl通入4L的密闭容器中,反应过程中氧气的变化量如图所示,则0~20min平均反应速率v(HCI)为。 (2)、下列选项中,能证明上述反应达到达到平衡状态的是____。A、单位时间内生成1molO2的同时生成2molCl2 B、v(H2O)=v(Cl2) C、容器中气体的平均相对分子质量不随时间变化而变化 D、容器中气体密度不随时间变化而变化(3)、对该反应达到平衡后,以下分析正确的是____。A、增加n(HCl),对正反应的反应速率影响更大 B、体积不变加入稀有气体,对正反应的反应速率影响更大 C、压强不变加入稀有气体,对逆反应的反应速率影响更大 D、其他条件不变,使用不同催化剂,Cl2(g)的产率不同9. 近年来,将氯化氢转化为氟气的技术成为科学研究的热点。工业上用O2将HCl转化为Cl2 , 可减少污染。在传统催化剂并加热条件下可实现该转化(反应混合物均为气态),方程式如下:
(2)、下列选项中,能证明上述反应达到达到平衡状态的是____。A、单位时间内生成1molO2的同时生成2molCl2 B、v(H2O)=v(Cl2) C、容器中气体的平均相对分子质量不随时间变化而变化 D、容器中气体密度不随时间变化而变化(3)、对该反应达到平衡后,以下分析正确的是____。A、增加n(HCl),对正反应的反应速率影响更大 B、体积不变加入稀有气体,对正反应的反应速率影响更大 C、压强不变加入稀有气体,对逆反应的反应速率影响更大 D、其他条件不变,使用不同催化剂,Cl2(g)的产率不同9. 近年来,将氯化氢转化为氟气的技术成为科学研究的热点。工业上用O2将HCl转化为Cl2 , 可减少污染。在传统催化剂并加热条件下可实现该转化(反应混合物均为气态),方程式如下:
请回答下列问题:(1)、已知新型RuO2催化剂对上述反应有更好的催化活性。新型RuO2催化剂的使用会氯化氢的转化率(选填“增大”、“减小”或“不影响”)。(2)、一定压强下,该反应的HCl平衡转化率随温度变化的曲线如图,则该反应的0(选填“>”、“<”或“=”),说明理由。 (3)、上述反应达到平衡后,其它条件不变,将容器体积迅速压缩,将(选填“增大”、“减小”或“不变”,下同),v(逆)将。10. T1温度下,在2L容器中,当平衡时测得c(HCl)=amolL,保持其他条件不变,t时刻压缩容器体积至1L(各物质状态不变),重新达到平衡后测得c(HCl)=bmol/L。比较a、b的大小:ab(填“>”“<”或“=”),说明理由:。11. 从平衡移动的角度解释实验室用饱和食盐水收集Cl2的原因。
(3)、上述反应达到平衡后,其它条件不变,将容器体积迅速压缩,将(选填“增大”、“减小”或“不变”,下同),v(逆)将。10. T1温度下,在2L容器中,当平衡时测得c(HCl)=amolL,保持其他条件不变,t时刻压缩容器体积至1L(各物质状态不变),重新达到平衡后测得c(HCl)=bmol/L。比较a、b的大小:ab(填“>”“<”或“=”),说明理由:。11. 从平衡移动的角度解释实验室用饱和食盐水收集Cl2的原因。二、元素或物质推断题
-
12. 五种短周期主族元素X、Y、Z、M和N,原子序数依次增大,相关信息如下表:
元素
相关信息
X
失去一个电子后成为质子
Y
气态氢化物的水溶液呈碱性,常做制冷剂
Z
原子核外最外层电子数是次外层的3倍
M
海水中含量最高的金属元素
N
单质为淡黄色固体,常存在于火山口附近
(1)、Z元素在周期表中的位置是 , M离子的结构示意图。(2)、写出元素Y的氢化物的电子式。(3)、5种元素原子半径由大到小的顺序为。(用对应的元素符号表示)(4)、下列选项中能证明Y和Z元素非金属性强弱的有____。A、最高价氧化物对应水化物的酸性:Z>Y B、与氢气化合物放出的热量:Z>Y C、气态氢化物的沸点:Z>Y D、单质的氧化性:Z>Y(5)、用一个化学方程式表示Z和N元素的非金属性强弱。(6)、X元素有3种核素,分别是:氕,丰度为99.98%;氘,丰度为0.016%;氚,丰度为0.004%,则X元素的相对原子质量计算表达式为:。(氕、氘、氚原子的质量用m1、m2、m3表示,12C原子质量用m0表示)三、实验题
-
13. 为探究铁及其化合物的性质,某班几个兴趣小组做了以下实验。(1)、甲组同学利用下列试剂:铜粉、0.1mol/LFeCl3溶液、0.1mol/LFeCl2溶液、KSCN溶液、新制氯水等,探究Fe2+、Fe3+的性质,设计实验方案进行实验,完成下列表格。
探究内容
实验方案
实验现象
写出离子方程式
探究Fe2+具有还原性
取少量FeCl2溶液,加入少量KSCN溶液后,再往溶液中加入少量。
溶液先不变红,后变为血红色。
Fe2+发生的反应:
探究Fe3+具有氧化性
①取少量FeCl3溶液,加入足量后,振荡、静置,再往溶液中加入少量KSCN
溶液不变为血红色。
Fe3+发生的反应:
②取少量FeCl3溶液,通入足量SO2 , 振荡、静置后滴入BaCl2溶液
溶液逐渐由黄色变为浅绿色,滴入BaCl2溶液,有白色沉淀生成
Fe3+与SO2发生的反应:
上述反应①可用于刻蚀印刷电路板,若将反应设计为原电池(如图),可加快刻蚀的速率,请在图中补充相关信息。
 (2)、乙组同学为了制备Fe(OH)2沉淀且保持一段时间不变色,尝试用如图所示的装置进行实验。
(2)、乙组同学为了制备Fe(OH)2沉淀且保持一段时间不变色,尝试用如图所示的装置进行实验。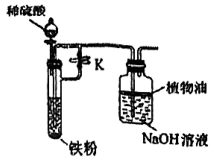
①Fe(OH)2暴露在空气中的颜色变化为 , 原因是(用化学方程式表示)。
②实验时,先(填“打开”或“关闭”)止水夹K,然后打开分液漏斗的活塞,一段时间后,(填“打开”或“关闭”)K。
(3)、向300mL0.2mol/L的FeSO4溶液中加入足量的NaOH溶液,沉淀经过滤、加热灼烧至质量不再变化后,得到的固体质量为g。
-