(人教版)2023-2024学年高中化学必修第一册 1.3氧化还原反应 同步分层训练培优版
试卷更新日期:2023-08-12 类型:同步测试
一、选择题
-
1. 工业上常用NaClO碱性溶液吸收工业废气中的SO2 , 为了提高吸收效率,常用Ni2O3 , 作为催化剂,在反应过程中产生的四价镍和氧原子都具有极强的氧化能力,可加快对SO2的吸收,其中的催化过程如图所示:

下列说法不正确的是( )
A、NaClO碱性溶液吸收SO2的离子方程式是:ClO-+SO2+2OH-=Cl-+SO42-+H2O B、过程1的离子方程式是:ClO-+Ni2O3=2NiO2+Cl- C、过程2中,氧化剂是ClO- , 还原剂是NiO2 D、此催化过程的离子反应为:ClO-Cl-+O2. 有Fe2+、NO3-、Fe3+、NH4+、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是 ( )
A、氧化剂与还原剂的物质的量之比为1:8 B、还原产物为NH4+ C、若有1mol NO3-参加还原反应,转移8mole- D、该反应中H2O是反应物之一3. 已知微粒还原性强弱顺序:I->Fe2+>Cl- , 则下列离子方程式不符合事实的是( )A、2Fe3++2I-→2Fe2++I2 B、Cl2+2I-→2Cl-+I2 C、2Fe2++I2→2Fe3++2I- D、Fe2++Cl2→2Fe3++2Cl-4. 下列属于非氧化还原反应的是A、2Mg+CO22MgO+C B、 C、 D、5. 铁在浓度极稀的硝酸中发生的反应为(未配平),下列说法正确的是A、该反应出现的物质中,属于氧化物的有4种 B、溶液可以导电,故溶液属于电解质 C、该反应中,参与反应的氧化剂与还原剂的总物质的量之比为15∶4 D、该反应中,每消耗 , 同时转移电子6. 已知反应: , 。下列关于该反应的说法错误的是A、可以对水体进行杀菌消毒、净化 B、在该反应中既是氧化剂又是还原剂 C、 D、每生成 , 转移4mol电子7. 通常利用反应:Mn2++PbO2+H+→+Pb2++H2O(未配平),定性检验Mn2+ , 关于该反应的下列说法中不正确的是A、PbO2是氧化剂 B、每消耗1 mol PbO2 , 转移2 mol e− C、Mn2+和PbO2的物质的量之比为5∶2 D、在该反应的条件下,氧化性:PbO2>8. 下列有关主要应用不涉及氧化还原反应的是A、和混合液可用于除铁锈 B、溶液可用于制作铜印刷电路板 C、可用于天然水的杀菌消毒和净化 D、可用于呼吸面具和潜水艇中的氧气的供给9. 汽车都安装有安全气囊,发生剧烈的碰撞时,安全气囊中会发生反应: , 有关该反应说法正确的是A、是还原剂 B、发生还原反应 C、既是氧化反应的产物也是还原反应的产物 D、氧化剂与还原剂的物质的量之比为5∶110. 纯碱在生产、生活中有广泛应用。例如可用足量的纯碱溶液吸收含氯气的尾气,生成三种盐(反应1);工业上也可用纯碱溶液从海水中提取溴,其主要原理如下:反应2:;
反应3:。
下列说法正确的是( )
A、反应2中氧化剂与还原剂的质量之比为1∶5 B、标准状况下,22.4L溴单质中含有2mol溴原子 C、反应1中生成的三种盐是NaClO,和 D、反应2中的与反应1中的表现出了相似的化学性质二、非选择题
-
11. 某溶液Q中含有如表所示离子中的5种离子,且离子浓度均为0.5mol/L(不考虑水的电离与离子水解)。现向溶液Q中加入足量稀氢溴酸,有单一气体R产生,经分析,反应前后阴离子种类不变。
阳离子
阴离子
、、、、、、、
、、、、、、、
已知在酸性溶液中会发生歧化反应。请回答下列问题:
(1)、由“加入足量稀氢溴酸,……”“反应前后阴离子种类不变”推知:溶液Q中一定不含的阴离子有(填数字)种。(2)、综合推断,溶液Q中一定含有的阳离子有(填离子符号,下同)。产生气体R的反应中,原溶液中过量的离子是 , 反应后溶液中物质的量一定发生变化的阳离子有。(3)、一定量溶液Q与氯气缓慢反应,反应后的溶液分为3份,分别进行以下操作,实验现象如图:
①铜粉参与的反应中,氧化产物是(填离子符号)。
②当V=448时,向溶液Q中通入氯气时发生反应的离子方程式为;假设不考虑与的反应,则根据实验现象可推算出V的范围为<V<。
12. 回答下列问题(1)、已知 , 在上述过程中被(填“氧化”或“还原”),中M的化合价是价。(2)、已知常温下在溶液中可发生如下两个反应:由此可以确定、、三种离子的氧化性由强到弱的顺序是。
(3)、由、、、、、组成的一个氧化还原反应体系中,发生的反应过程。①该反应中,氧化剂是 , 氧化产物是。
②将以上物质分别填入下面对应的横线上,组成一个配平的离子方程式并配平:。
_+_+_→_+_
(4)、实验室用和浓盐酸制氯气的反应为①用双线桥在方程式中标出电子转移的情况;
②反应中,如果有17.4g纯被还原,那么被氧化的氯化氢的质量为。
13. 铁是人类较早使用的金属之一。化学研究中涉及到铁及其化合物的相关文献种类很多。请回答下列问题:(1)、I.现有下列八种物质:①绿矾、②铁、③铁红、④Fe(OH)3胶体、⑤FeCl3溶液、⑥FeCl2、⑦K2FeO4、⑧FeO。下列说法正确的有____(填字母)。
A、不属于电解质的有①②④ B、④与⑤可用丁达尔效应区分 C、③⑧都属于碱性氧化物 D、①⑥⑧中均含有二价铁元素(2)、写出利用上述物质发生化合反应制备⑥的化学方程式:。(3)、部分含铁物质的分类与相应化合价的关系如图所示: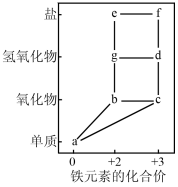
①写出g→d的化学方程式:。
②根据上述“价一类”二维图信息,下列说法正确的是(填字母)。
A.d胶体可用于饮用水消毒和净化
B.a转化为c只需控制纯氧的量即可实现
C.a→b→c→d之间的转化均可以通过一步反应实现
D.将a加入f的溶液中,溶液质量增加
(4)、II.高铁酸钾(K2FeO4)是一种暗紫色固体,易与水反应得到氧气和Fe(OH)3沉淀,是一种环保、高效、多功能饮用水处理剂,制备流程如图所示: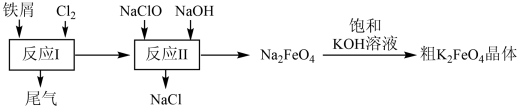
写出反应II的离子方程式:。
(5)、该条件下,物质的溶解性:Na2FeO4K2FeO4(填“>”或“<”)。(6)、现有两份失去标签的紫色K2FeO4固体和KMnO4固体,请设计相关实验方案加以鉴别:。14. 氧化还原是一类重要的反应。(1)、某同学写出以下三个化学方程式(未配平)①N2O4+H2O→HNO3+HNO2 ②NO+HNO3→N2O3+H2O ③NH3+NO→HNO2+H2O
其中你认为一定不可能实现的是(填代号);
(2)、以下反应中H2O2仅体现还原性的是(填代号) , H2O2既体现氧化性又体现还原性的是(填代号) , 从反应中判断H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是;A.H2O2+2Fe2++2H+=2Fe3++2H2O
B.2H2O2=2H2O+O2↑
C.Ag2O+H2O2=2Ag+O2↑+H2O
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
E.H2O2+MnSO4=MnO2+H2SO4
(3)、用“双线桥法”标明以下反应中电子转移的方向和数目 , 若反应中有3.01×1023个电子转移,则被氧化的还原剂的物质的量为。2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
15. 氧化还原是一类重要的反应。(1)、已知反应2I-+2Fe3+=I2+2Fe2+ , 反应中还原剂是 , 氧化性Fe3+I2 (填“ < ”或“ > ”) 。(2)、在2Na2O2+2CO2=2Na2CO3+O2反应中,若转移3mol电子,则所产生的氧气在标准状况下的体积为L。(3)、在xR2++yH++O2=mR3++nH2O的离子方程式中,对系数m和R2+、R3+判断正确的是__。A、m=y,R3+是还原剂 B、m=2y,R2+被氧化 C、m=2,R3+是氧化剂 D、m=4,R2+是还原剂(4)、用双线桥标出反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中电子转移的方向和数目。(5)、氯气和石英砂、碳粉共热可发生反应:SiO2+2C+2Cl2 SiCl4+2CO 当反应消耗6 g 碳时,生成还原产物mol。