(人教版)2023-2024学年高中化学必修第一册 1.3氧化还原反应 同步分层训练提升版
试卷更新日期:2023-08-12 类型:同步测试
一、选择题
-
1. 某学生以铁丝和为原料进行下列三个实验。下列选项正确的是( )
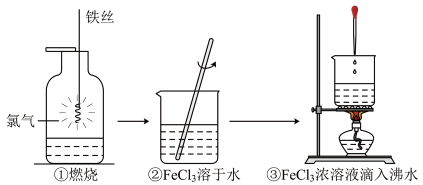 A、实验②中玻璃棒的作用是引流 B、实验①、③反应制得的物质均为纯净物 C、实验③化学方程式为: D、实验①中的反应既是氧化还原反应,又是四种基本反应类型中的化合反应2. 反应8NH3+3Cl2=N2+6NH4Cl,被氧化的NH3与被还原的Cl2的物质的量之比为( )A、2∶3 B、8∶3 C、6∶3 D、3∶23. PbO2、KMnO4、Cl2、FeCl3、CuCl2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )A、Cu+2Fe3+=Cu2++2Fe2+ B、10Cl-+2MnO4-+16H+=2Mn2++5Cl2↑+8H2O C、2Fe2++Cl2=2Fe3++2Cl- D、5Pb2++2MnO4-+2H2O=5PbO2+2Mn2++4H+4. 下列变化,需要加入适当的氧化剂才能完成的是( )A、PCl3→PCl5 B、MnO →Mn2+ C、SO2→SO D、Cl2→HClO5. 下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是( )A、2Na + 2H2O=2NaOH + H2↑ B、CH4+ 2O2 CO2+ 2H2O C、2KClO3 2KCl + 3O2↑ D、CaCO3+ 2HCl=CaCl2+ H2O + CO2↑6. 下列各组离子因发生氧化还原反应而不能大量共存的是( )A、Fe3+、OH-、SO42-、CO32- B、Cu2+、Fe3+、H+、I- C、Ag+、Na+、SO42-、Cl- D、K+、H+、CO32-、MnO4-7. 根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是( )
A、实验②中玻璃棒的作用是引流 B、实验①、③反应制得的物质均为纯净物 C、实验③化学方程式为: D、实验①中的反应既是氧化还原反应,又是四种基本反应类型中的化合反应2. 反应8NH3+3Cl2=N2+6NH4Cl,被氧化的NH3与被还原的Cl2的物质的量之比为( )A、2∶3 B、8∶3 C、6∶3 D、3∶23. PbO2、KMnO4、Cl2、FeCl3、CuCl2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )A、Cu+2Fe3+=Cu2++2Fe2+ B、10Cl-+2MnO4-+16H+=2Mn2++5Cl2↑+8H2O C、2Fe2++Cl2=2Fe3++2Cl- D、5Pb2++2MnO4-+2H2O=5PbO2+2Mn2++4H+4. 下列变化,需要加入适当的氧化剂才能完成的是( )A、PCl3→PCl5 B、MnO →Mn2+ C、SO2→SO D、Cl2→HClO5. 下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是( )A、2Na + 2H2O=2NaOH + H2↑ B、CH4+ 2O2 CO2+ 2H2O C、2KClO3 2KCl + 3O2↑ D、CaCO3+ 2HCl=CaCl2+ H2O + CO2↑6. 下列各组离子因发生氧化还原反应而不能大量共存的是( )A、Fe3+、OH-、SO42-、CO32- B、Cu2+、Fe3+、H+、I- C、Ag+、Na+、SO42-、Cl- D、K+、H+、CO32-、MnO4-7. 根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是( )① I2 + SO2 + 2H2O = H2SO4 + 2HI;
② 2FeCl2 + Cl2 = 2FeCl3;
③ 2FeCl3 + 2HI = 2FeCl2 + 2HCl +I2
A、SO2>I->Fe2+>Cl- B、Cl->Fe2+>SO2>I- C、Fe2+>I->Cl->SO2 D、I->Fe2+>Cl->SO28. 下列反应中,不是氧化还原反应的是( )①H2+Cl2 2HCl
②Na2CO3+2HCl=2NaCl+H2O+CO2↑
③2H2O 2H2↑+O2↑
④CuO+2HNO3=Cu(NO3)2+H2O
⑤2HgO 2Hg+O2↑
A、②④ B、①③ C、①②③ D、④⑤9. 下列变化过程属于还原反应的是( )A、H+→H2O B、Na→Na+ C、CO→CO2 D、Fe3+→Fe2+10. 一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )A、7.5 L B、12.3 L C、15.7 L D、16.8 L二、非选择题
-
11. 氧化还原反应是一类重要的化学反应,在工农业生产、日常生活中都有广泛的用途。
请回答下列问题。
(1)、Ⅰ.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:。、、、四种物质中的一种物质(甲)能使上述还原过程发生。物质(甲)为(填化学式)。
(2)、反应中若产生5molNO分子,则转移电子的数目是。(3)、Ⅱ.亚硝酸钠()像食盐一样有咸味但有很强的毒性,误食会使人中毒。已知亚硝酸钠能发生如下反应:。用双线桥法标出该反应中电子转移的方向及数目: , 被氧化的原子与被还原的原子数目之比为。
(4)、自来水中的对人类健康会产生危害碱性条件下Al粉还原 , 产物是 , 发生的反应可表示如下,完成方程式并配平。_Al+_+____
12. 根据表格信息,解答有关问题。氯气(Cl2)
KMnO4
PbO2
有刺激性气味,呈黄绿色,有毒气体
易溶于水,溶液呈紫红色,可用于杀菌消毒
Pb的最高化合价为+4,其稳定化合价为+2,难溶于水,灰色固体
(1)、在浓盐酸中加入少量KMnO4剧烈反应,产生黄绿色有刺激性气味的气体,溶液紫红色褪去,已知该反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑。其中氧化剂是 , 氧化产物是。每生成71g氯气,则被氧化的还原剂的质量为g。(2)、取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:滴加适量H2O2 , 紫红色褪去,并有无色气泡产生;再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
①在配制酸性KMnO4溶液时,能否用盐酸? , 原因是。
②KMnO4、H2O2、PbO2的氧化性由强到弱的顺序为。
(3)、根据上述反应能否比较Cl2与H2O2的氧化性强弱?(填“能”或“不能”)。13. 以黄铜矿[主要成分是二硫化亚铁铜()]为主要原料的炼铜方法有火法炼铜、氧化浸出等。(1)、Ⅰ.火法炼铜:反应中被还原的元素是(填元素符号),氧化产物有(填化学式)。
(2)、用此法炼铜,每制得32t铜会产生污染气体二氧化硫的质量为 , 冶炼过程中产生大量 , 下列处理方案中合理的是(填字母)。A.高空排放 B.制备硫酸 C.用氨水吸收
(3)、Ⅱ.氧化浸出:在硫酸介质中用双氧水将黄铜矿氧化,测得有生成。配平该反应方程式:。
_______
(4)、该反应在25~50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,除温度较高双氧水分解之外,还可能的原因是。14. 已知反应:①
②
③
④
⑤
(1)、上述反应中,属于置换反应的是(填序号,下同);同一元素之间发生氧化还原的是。(2)、反应②中氧化剂是(填化学式,下同);反应③中氧化产物是。(3)、在反应④中,每生成1个分子时,转移的电子数为。(4)、配平反应⑤并用双线桥法标出反应⑤中电子转移的方向和数目。(5)、反应⑤中氧化剂与还原剂的质量之比为(填最简整数比)。(6)、已知有下列两个反应:①;② , 、、的氧化性由强到弱的顺序为。(7)、下列物质中能使酸性溶液褪色(转化为而褪色)的是(填字母)。a.臭碱(Na2S) b.小苏打(NaHCO3) c.水玻璃(溶液)
15. 表中是生活生产中常见的物质,表中列出了它们的(主要)成分。编号
①
②
③
④
⑤
⑥
⑦
名称
酒精
醋酸溶液
火碱
食盐
铜导线
亚硫酸酐
苏打
主要成分
CH3CH2OH
CH3COOH
NaOH
NaCl
Cu
SO2
Na2CO3
(1)、上述物质中属于盐的是(填编号,下同),属于氧化物的是 , 属于有机物的是。(2)、请你对表中①~⑦的主要成分进行分类(填编号):属于电解质的是 , 属于非电解质的是。(3)、过量②的水溶液与⑦反应的离子方程式是。(4)、某同学用⑤和浓硫酸共热来制备⑥,化学方程式为:Cu+2H2SO4(浓)CuSO4+SO2↑+ 2H2O①请用单线桥标出电子转移的情况;
②上述反应的还原产物是。