(人教版)2023-2024学年高中化学必修第一册 1.3氧化还原反应 同步分层训练基础版
试卷更新日期:2023-08-12 类型:同步测试
一、选择题
-
1. 已知微粒还原性强弱顺序:I->Fe2+>Cl- , 则下列离子方程式不符合事实的是( )A、2Fe3++2I-→2Fe2++I2 B、Cl2+2I-→2Cl-+I2 C、2Fe2++I2→2Fe3++2I- D、Fe2++Cl2→2Fe3++2Cl-2. 下列我国古代的几种技术应用,不涉及氧化还原反应的是( )A、卤水煮盐 B、铁矿石炼铁 C、化丹(Pb3O4)为铅 D、火药爆炸3. 下列属于非氧化还原反应的是A、2Mg+CO22MgO+C B、 C、 D、4. 下列变化过程需要加入还原剂才能实现的是( )A、MnO→Mn2+ B、HSO→SO2 C、Fe→Fe2O3 D、Na→NaOH5. 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )
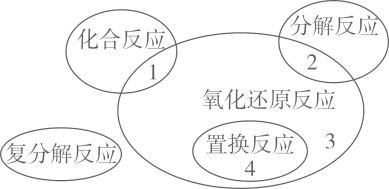 A、4Na+O2=2Na2O B、Na2CO3+2HCl=2NaCl+CO2↑+H2O C、4HNO32H2O+4NO2↑+O2↑ D、3CO+Fe2O32Fe+3CO26. 物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:
A、4Na+O2=2Na2O B、Na2CO3+2HCl=2NaCl+CO2↑+H2O C、4HNO32H2O+4NO2↑+O2↑ D、3CO+Fe2O32Fe+3CO26. 物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与HNO3溶液;②Cu与FeCl3溶液;③Zn与H2SO4溶液;④Fe与HCl溶液其中由于浓度不同而能发生不同氧化还原反应的是( )
A、①② B、③④ C、②③ D、①③7. 在下列反应中氧化剂和还原剂为同一物质的是( )
A、Cl2+H2=2HCl B、CuO +CO Cu +CO2 C、3S +6NaOH 2Na2S + Na2SO3 + 3H2O D、2Na+2H2O=2NaOH+H2↑8. 已知可用Co2O3代替MnO2制备Cl2 , 反应后Co元素以 Co2+的形式存在。下列叙述不正确的是( )A、该反应中氧化性:Co2O3>Cl2 B、参加反应的HCl全部被Co2O3氧化 C、每生成1摩尔氯气,消耗1摩尔Co2O3 D、制备相同量的氯气,所需Co2O3质量比MnO2多9. 一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )A、7.5 L B、12.3 L C、15.7 L D、16.8 L10. 关于氧化还原反应,下列说法不正确的是( )A、氧化反应和还原反应同时发生 B、一定存在着电子转移 C、一定存在着元素化合价变化 D、一定有单质参加反应二、非选择题
-
11. 铁是人类较早使用的金属之一。化学研究中涉及到铁及其化合物的相关文献种类很多。请回答下列问题:(1)、I.现有下列八种物质:①绿矾、②铁、③铁红、④Fe(OH)3胶体、⑤FeCl3溶液、⑥FeCl2、⑦K2FeO4、⑧FeO。
下列说法正确的有____(填字母)。
A、不属于电解质的有①②④ B、④与⑤可用丁达尔效应区分 C、③⑧都属于碱性氧化物 D、①⑥⑧中均含有二价铁元素(2)、写出利用上述物质发生化合反应制备⑥的化学方程式:。(3)、部分含铁物质的分类与相应化合价的关系如图所示: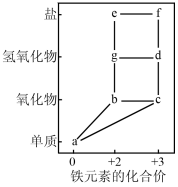
①写出g→d的化学方程式:。
②根据上述“价一类”二维图信息,下列说法正确的是(填字母)。
A.d胶体可用于饮用水消毒和净化
B.a转化为c只需控制纯氧的量即可实现
C.a→b→c→d之间的转化均可以通过一步反应实现
D.将a加入f的溶液中,溶液质量增加
(4)、II.高铁酸钾(K2FeO4)是一种暗紫色固体,易与水反应得到氧气和Fe(OH)3沉淀,是一种环保、高效、多功能饮用水处理剂,制备流程如图所示: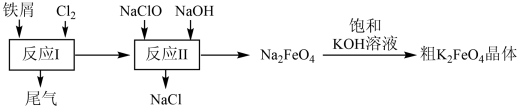
写出反应II的离子方程式:。
(5)、该条件下,物质的溶解性:Na2FeO4K2FeO4(填“>”或“<”)。(6)、现有两份失去标签的紫色K2FeO4固体和KMnO4固体,请设计相关实验方案加以鉴别:。12. 回答下列问题:(1)、某化学反应的反应物和产物如下:。①该反应的氧化剂是。
②如果该反应方程式中和的化学计量数都是5,则的化学计量数是。
(2)、某一反应体系有反应物和生成物共五种物质:、(Cr元素的化合价力)、(Cr元素的化合价为)、、 , 已知该反应中只发生如下过程:。①该反应中的还原剂是。
②该反应中,发生还原反应的过程是→。
③写出该反应的化学方程式:。
(3)、在硫酸溶液中,和能按粒子个数比1∶2完全反应,生成一种棕黄色气体X,同时被氧化为 , 则X为____。A、 B、 C、 D、13. 化学实验中,如果使某步反应中的有害产物作为另一步的反应物,形成一个循环,就能实现不再向环境排放该有害物质。例如: (1)、配平步骤①的反应方程式,并用单线桥标出电子转移的方向和数目。
(1)、配平步骤①的反应方程式,并用单线桥标出电子转移的方向和数目。__HCl=_NaCl+___
该反应中被还原的原子与被氧化的原子个数之比为;每生成1mol的氧化产物,被氧化的还原剂的质量为g。
(2)、为实现步骤⑥的转化,可在碱性条件下加入 , 被还原为 , 其离子方程式为;还原性:(填“>”、“<”或“=”)。(3)、在上述有编号的步骤中,除了⑥外,还需用氧化剂的步骤是(填序号)。14. 氧化还原反应是中学阶段非常重要的知识,对它的认知和理解是分析问题的关键。(1)、某反应体系中有反应物和生成物共5种物质:、NO、、Cu、 , 已知还原性:Cu>NO。回答下列问题:①在上述反应中,表现出氧化性的物质是(填化学式,下同),是还原产物。
②写出该反应的化学方程式:。
(2)、根据反应 , 回答下列问题。①X的化学式为;该反应的还原剂是。
②当生成28g时,被氧化的物质的质量为g。
15. 用分类思想研究一类物质的通性和特殊性是学习化学的一种重要方法。以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。已知:Cl2+H2O=HCl+HClO;2Na+2H2O=2NaOH+H2↑;3NO2+H2O=2HNO3+NO。请根据你所学的知识,按要求填空: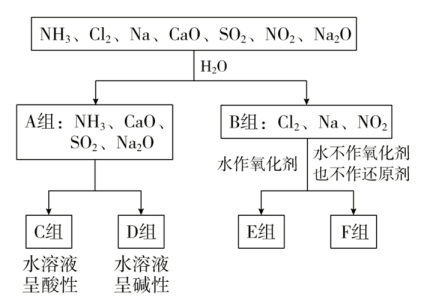 (1)、该种分类方法是分类法,上述第一级分类标准(分成A、B组的依据)是。(2)、F组物质中除了Cl2外还有(填化学式,下同)。(3)、已知制备Cl2可发生如下反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
(1)、该种分类方法是分类法,上述第一级分类标准(分成A、B组的依据)是。(2)、F组物质中除了Cl2外还有(填化学式,下同)。(3)、已知制备Cl2可发生如下反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。①该反应中氧化剂是 , 还原剂是。
②用双线桥法标出电子转移的数目和方向。