(人教版)2023-2024学年高中化学必修第一册 1.2离子反应 同步分层训练培优版
试卷更新日期:2023-08-11 类型:单元试卷
一、选择题
-
1. 类推思维是化学解题中常用的一种思维方法,下列有关类推正确的是( )A、已知:将Fe加入CuSO4溶液中;类推:将Na加入CuSO4溶液中 B、已知:Fe2O3与硝酸溶液;类推:Fe(OH)3与硝酸溶液 C、已知:与CO2反应;类推:与SO2反应 D、已知:工业制Mg:;类推:工业制Al:2. 某溶液中可能含有NH4+、K+、Ba2+、Fe3+、I-、SO32-、SO42-中的几种,现取100mL溶液先加入少量氯水,溶液呈无色。然后滴加足量BaCl2溶液,得到沉淀4.66g,在滤液中加足量NaOH溶液并加热,生成的气体在标准状况下体积为1.12L。已知:SO32-+Cl2+H2O=SO42-+2Cl-+2H+;2Fe3++2I-=2Fe2++I2 , 根据上述实验,以下推测正确的是( )A、原溶液一定存在NH4+、I- B、原溶液一定不含Ba2+、Fe3+、I- C、原溶液可能存在K+、Fe3+、SO42- D、另取试液滴加足量盐酸酸化的BaCl2溶液,即可确定溶液所有的离子组成3. 下列解释事实的离子方程式书写正确的是A、用含铝粉和氢氧化钠的疏通剂疏通管道: B、用氯化铁溶液蚀刻覆铜板: C、用淀粉碘化钾试纸和醋酸证明食盐中存在: D、暖贴(主要成分:Fe粉、活性炭、水、食盐等)发热时,空气中氧气参与的反应为:4. 能正确表示下列反应的离子方程式为A、将等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液等体积混合: +Ba2++OH-=BaCO3↓ +H2O B、氯气溶于水:Cl2+H2O=2H+ + Cl-+ClO- C、向氢氧化亚铁中加入足量的稀硝酸: Fe(OH)2 +2H+=Fe2+ +2H2O D、用铝粉和NaOH溶液反应制取少量H2:Al+2OH-=+H2↑5. 某溶液含Na+、NH、SO、Cl-、Fe2+、Fe3+中的几种,且各离子浓度相同。为确定其组成,进行实验:①取少量溶液,加入足量HNO3酸化的Ba(NO3)2(aq),产生白色沉淀,过滤;②向滤液中加入足量的NaOH(aq),产生红褐色沉淀,微热,产生气体。
关于原溶液的说法正确的是( )
A、不能确定是否有Fe3+ B、需通过焰色反应确定Na+是否存在 C、Fe2+、Fe3+都存在 D、存在NH、SO、Cl-、Fe2+6. 现有下列实验探究摩尔盐的化学性质。装置
实验
试剂a
现象

①
紫色石蕊溶液
溶液变红色
②
溶液
产生白色沉淀
③
稀硝酸溶液
溶液变黄色
④
浓溶液
产生具有刺激性气味的气体
下列离子方程式不能准确解释相应实验现象的是
A、①中溶液变红:、 B、②中产生白色沉淀: C、③中溶液变黄: D、④中产生有刺激性气体:7. 常温下,下列指定溶液中,各组离子一定能大量共存的是( )A、的溶液:、、、 B、溶液:、、、 C、甲基橙为黄色的溶液:、、、 D、的溶液:、、、8. 某化学实验室产生的废液中的阳离子只可能含有Na+、NH4+、Ba2+、Cu2+、Al3+、Fe2+、Fe3+中的某几种,实验室设计了下述方案对废液进行处理,以回收金属,保护环境。
已知:步骤①中,滴加NaOH溶液过程中产生的沉淀会部分溶解。下列说法中正确的是( )
A、根据步骤①的现象,说明废液中一定含有Al3+ B、由步骤②中红棕色固体可知,废液中一定存在Fe3+ C、沉淀甲中可能含有Al(OH)3 D、该废液中一定含有NH4+、Ba2+、Cu2+、Fe2+和Fe3+至少存在一种9. 某澄清透明溶液中,可能大量存在下列离子中的若干种:H+、NH4+、K+、Mg2+、Cu2+、Br-、AlO2-、Cl-、SO42-、CO32- , 现进行如下实验:① 用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先浑浊后又变澄清,有无色气体放出。将溶液分为3份。
② 在第1份溶液中逐滴加入NaOH溶液至过量,溶液先浑浊后又变澄清。加热,将湿润的红色石蕊试纸置于试管口,未见明显现象。
③ 在第2份溶液中加入新制的氯水和CCl4 , 振荡后静置,下层溶液显橙红色。
则下列推断正确的是:( )
A、溶液中一定有K+、Br-、AlO2-、CO32- B、溶液中一定没有NH4+、Mg2+、Cu2+、Cl- C、不能确定溶液中是否有K+、Cl-、SO42- D、往第3份溶液中滴加硝酸酸化的硝酸银溶液可确认是否有Cl-10. 下列离子方程式表达正确的是( )A、向FeCl3溶液中滴加HI溶液:2Fe3++ 2HI = 2Fe2++ 2H++ I2 B、向(NH4)2SO4溶液中滴加Ba(OH)2溶液:NH4++SO42-+Ba2++OH-=NH3·H2O+BaSO4↓ C、Ca(OH)2溶液与少量NaHCO3溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- D、3 mol·L-1 Na2CO3溶液和1 mol·L-1 Al2(SO4)3溶液等体积混合: 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑二、非选择题
-
11. 某透明溶液中含有以下离子中的几种H+、Na+、Fe3+、Cu2+、NH4+、Mg2+、Cl-、NO3-、SO42-、CH3COO-、I-、OH- , 且只含有四种阳离子,为确定离子种类设计实验如下(已知氧化性:HNO3>Fe3+>I2) :
①取溶液少许滴加1~2滴紫色石蕊试液后溶液呈红色;
②取100 mL溶液,滴加1.0 mol/L的NaOH溶液至520 mL时恰好完全反应,加热后共收集到0.448 L(标准状况下)气体(假设气体全部逸出),同时产生沉淀。将沉淀过滤,洗涤,灼烧后得到一种黑色和白色的固体混合物,称得质量为14.0g。下图为滴加NaOH溶液过程图像(纵坐标为生成沉淀的质量,横坐标为滴加NaOH溶液体积)。继续向滤液中滴加足量的BaCl2溶液,又产生白色沉淀46.6 g;

③另取100mL原溶液通入标准状况下1.12LCl2 , 恰好完全反应,加入四氯化碳后,振荡静置后分层,下层呈现紫色(已知:Cl2+2I-=2Cl-+I2);
④在③中滴加硝酸酸化的硝酸银溶液后生成不溶于稀硝酸的白色沉淀。
结合以上实验现象和数据可知:
(1)、溶液中一定不能大量存在。(2)、填写表中空格(可以不填满):离子种类
离子浓度(mol/L)
12. 某钾盐X由四种元素组成,某小组按如下流程进行实验。请回答: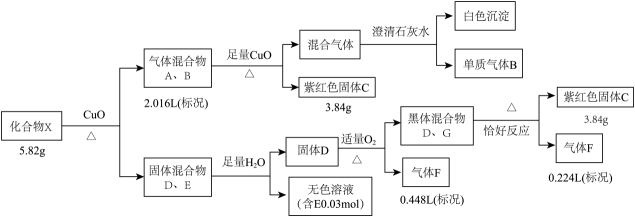
已知:相同条件下,A、B为中学常见气体且密度相同。D、E均为二元化合物,气体F能使品红溶液褪色且通入无色溶液E中,有淡黄色沉淀生成。
(1)、气体B的电子式是 , C的化学式是。(2)、写出固体混合物D、G共热所发生的化学反应方程式。(3)、无色溶液E中滴加盐酸观察到气泡。收集少量气体通入溶液,观察到黑色沉淀生成。写出生成沉淀的离子反应方程式(发生非氧化还原反应)。(4)、将G溶于氨水得到一无色溶液,设计实验检验无色溶液中主要离子。13. 下图是氮的化合物的“价类二维图”。 (1)、写出实验室制取氨气的化学方程式:。(2)、图中方框中的化学式为 , 一水合氨电离可使溶液显碱性,写出一水合氨的电离方程式:。(3)、写出和在加热催化剂条件下生成的化学方程式:。(4)、向盛有少量溶液的试管中加入溶液并加热,在试管口放一片湿润的红色石蕊试纸,实验现象是。(5)、将和稀硝酸充分反应,生成的气体体积为L(在标准状况下),用排水法收集该气体,将收集到的气体的试管倒立于水槽中缓缓通入(标准状况)使恰好完全反应,写出观察到的现象:。
(1)、写出实验室制取氨气的化学方程式:。(2)、图中方框中的化学式为 , 一水合氨电离可使溶液显碱性,写出一水合氨的电离方程式:。(3)、写出和在加热催化剂条件下生成的化学方程式:。(4)、向盛有少量溶液的试管中加入溶液并加热,在试管口放一片湿润的红色石蕊试纸,实验现象是。(5)、将和稀硝酸充分反应,生成的气体体积为L(在标准状况下),用排水法收集该气体,将收集到的气体的试管倒立于水槽中缓缓通入(标准状况)使恰好完全反应,写出观察到的现象:。 14. 某学习小组在实验室中利用如图装置(夹持装置略去)测定某铁硫化物()的组成,并探究反应后D装置所得溶液中含硫化合物的组成。
14. 某学习小组在实验室中利用如图装置(夹持装置略去)测定某铁硫化物()的组成,并探究反应后D装置所得溶液中含硫化合物的组成。
实验步骤:
步骤I
如图连接装置,检查装置气密性,装入试剂;
步骤II
旋开分液漏斗活塞与旋塞,并点燃酒精喷灯;
步骤III
足够长时间后,D中产生气泡速率变快时,停止加热,继续向烧瓶中滴水一段时间;
步骤IV
实验结束后,将D中所得溶液加水配制成250mL溶液;
请回答:
(1)、写出A中发生反应的离子方程式。(2)、有同学认为D中应设置防倒吸装置,你认为是否有必要?(填“是”或“否”),说明理由。(3)、在步骤IV所得溶液的主要溶质为 , 检验溶液中存在的方法是。(4)、取25.00mL步骤IV中所配溶液,加入足量的双氧水,再加入足量盐酸酸化的溶液,将所得沉淀过滤、洗涤、干燥,称其质量为4.66g。写出的与反应的化学方程式。(5)、若步骤D配制溶液时俯视容量瓶的刻度线,则测得铁硫化物的x:y的值(填“偏大”、“不影响”或“偏小”)15. 硫酸亚铁是一种补铁剂,某兴趣小组利用经过初步处理的含有Fe2+的废液制备硫酸亚铁晶体的流程如下: (1)、加入饱和NaHCO3溶液后,得到白色沉淀,则操作1为 , 若NaHCO3溶液浓度偏低可能会形成胶体,验证的方法为效应。(2)、加入铁粉的作用是。(3)、测定废液中Fe2+的浓度可使用已知浓度的酸性高锰酸钾溶液:
(1)、加入饱和NaHCO3溶液后,得到白色沉淀,则操作1为 , 若NaHCO3溶液浓度偏低可能会形成胶体,验证的方法为效应。(2)、加入铁粉的作用是。(3)、测定废液中Fe2+的浓度可使用已知浓度的酸性高锰酸钾溶液:①用单线桥法表示电子转移过程:2KMnO4+10FeSO4+8H2SO4=2MnSO4+K2SO4+5Fe2(SO4)3+8H2O
②已知Fe2+与NaHCO3按物质的量1:2的比例恰好完全反应,该反应的离子方程式为。
(4)、该兴趣小组在研究硫酸亚铁(FeSO4)热稳定性时,作出了两种假设:①假设它按CaCO3受热分解的方式分解,反应的化学方程式为
②假设它按KClO3受热分解的方式分解,已知产物中有两种酸性氧化物生成,则分解反应的化学方程式为。