四川省绵阳市涪城区2023年中考模拟化学试题
试卷更新日期:2023-08-10 类型:中考模拟
一、单选题
-
1. 下列关于化学与日常生活关系的归纳中,存在错误的是( )A、化学与环境:①使用天然气代替煤——减少空气污染;②合理使用农药、化肥——减少水污染 B、化学与生活:①使用含氟牙膏可预防龋齿;②防止食品受潮——用氧化钙做干燥剂 C、化学与安全:①重金属盐中毒——喝鲜牛奶解毒;②山洞探险——灯火实验 D、化学与健康:①人体缺铁——易患贫血病;②食用鲜黄瓜——可大量补钙2. 尿素[CO(NH2)2]是一种常用的化肥,如图是工业上生产尿素反应的微观示意图,下列说法正确的是( )
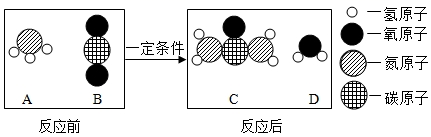 A、D的化学式是CO2 B、该图没有反映出质量守恒定律 C、B和D所含的原子种类相同 D、A物质中氮、氢元素的质量比是1:33. 用如图装置进行实验,不能达到实验目的是( )A、
A、D的化学式是CO2 B、该图没有反映出质量守恒定律 C、B和D所含的原子种类相同 D、A物质中氮、氢元素的质量比是1:33. 用如图装置进行实验,不能达到实验目的是( )A、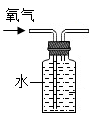 收集一瓶氧气
B、
收集一瓶氧气
B、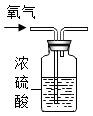 干燥氧气
C、
干燥氧气
C、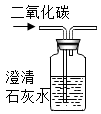 检验二氧化碳
D、
检验二氧化碳
D、 验满二氧化碳
4. 四个实验小组同学分别取不同质量的NaCl,t℃时逐渐加入到各盛有80g水的烧杯中,不断搅拌直到不再溶解为止《温度不变),然后分别称量剩余NaCl的质量,记录数据如表所示,则下列说法不正确的是( )
验满二氧化碳
4. 四个实验小组同学分别取不同质量的NaCl,t℃时逐渐加入到各盛有80g水的烧杯中,不断搅拌直到不再溶解为止《温度不变),然后分别称量剩余NaCl的质量,记录数据如表所示,则下列说法不正确的是( )实验小组
第一组
第二组
第三组
第四组
水的质量(g)
80
80
80
80
所取NaCl的质量(g)
25
30
35
40
剩余NaCl的质量(g)
0
2
7
12
A、第一组为不饱和溶液,用蒸发的方法可以使之变饱和 B、第二组所得溶液的溶质与溶剂的质量比为7:20 C、第二、三、四组均为NaCl的饱和溶液且溶液质量相等 D、t℃时,80g NaCl饱和溶液中含有28gNaCl5. 过碳酸钠是一种常见的漂白杀菌剂,其水溶液显碱性,能和盐酸发生下列反应:2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O。工业用的过碳酸钠往往含有少量的碳酸钠及氯化钠。根据以上信息下列说法正确的是( )A、过碳酸钠的水溶液能使无色酚酞变红,所以过碳酸钠是一种碱 B、过碳酸钠漂白杀菌时,发生了化学变化 C、过碳酸钠与盐酸反应属于复分解反应 D、取2.8g样品与足量稀盐酸反应,只要测定反应中产生的CO2体积,就可推算出过碳酸钠的纯度6. 下面四个图像,能正确反映对应变化关系的是( )A、向二氧化锰中加入过氧化氢溶液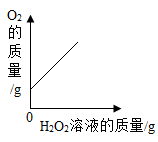 B、镁在氧气中燃烧
B、镁在氧气中燃烧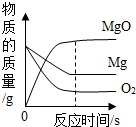 C、等质量的锌、铁分别与质量分数相等且足量的稀硫酸反应
C、等质量的锌、铁分别与质量分数相等且足量的稀硫酸反应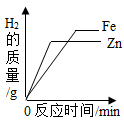 D、向一定量铁粉和铜粉的混合物中加入硫酸铜溶液
D、向一定量铁粉和铜粉的混合物中加入硫酸铜溶液 7. 如图是a、b、c三种物质的溶解度曲线。下列说法正确的是( )
7. 如图是a、b、c三种物质的溶解度曲线。下列说法正确的是( )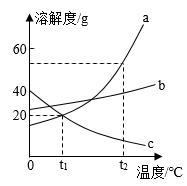 A、随温度升高,a、b、c三种物质的饱和溶液均可变为不饱和溶液 B、将t2℃时三种物质的饱和溶液降温到t1℃时,溶质质量分数b>a=c C、a物质中混有少量的c物质,可用降温结晶的方法提纯a物质 D、t1℃时,将b物质的饱和溶液恒温蒸发溶剂,溶质的质量分数会减小8. 据报道,中科院大连化学物理研究所的研究团队利用多功能催化剂首次实现了 CO2直接加氢制汽油的过程。其转化过程如图所示。下列说法正确的是( )
A、随温度升高,a、b、c三种物质的饱和溶液均可变为不饱和溶液 B、将t2℃时三种物质的饱和溶液降温到t1℃时,溶质质量分数b>a=c C、a物质中混有少量的c物质,可用降温结晶的方法提纯a物质 D、t1℃时,将b物质的饱和溶液恒温蒸发溶剂,溶质的质量分数会减小8. 据报道,中科院大连化学物理研究所的研究团队利用多功能催化剂首次实现了 CO2直接加氢制汽油的过程。其转化过程如图所示。下列说法正确的是( ) A、反应①的产物中含有水 B、反应②为化合反应 C、反应②的产物(CH2)n属于高分子化合物,属于纯净物 D、此技术既可以减少人类对化石燃料的依赖,又减少了温室气体的排放9. 工业上用硫铁矿制硫酸涉及反应。为了测定硫铁矿的含硫量,取1.5g硫铁矿样品在足量氧气中灼烧,测得生成SO2的质量为1.2g,则该硫铁矿中硫的质量分数为( )A、40% B、53% C、80% D、29%
A、反应①的产物中含有水 B、反应②为化合反应 C、反应②的产物(CH2)n属于高分子化合物,属于纯净物 D、此技术既可以减少人类对化石燃料的依赖,又减少了温室气体的排放9. 工业上用硫铁矿制硫酸涉及反应。为了测定硫铁矿的含硫量,取1.5g硫铁矿样品在足量氧气中灼烧,测得生成SO2的质量为1.2g,则该硫铁矿中硫的质量分数为( )A、40% B、53% C、80% D、29%二、实验题
-
10. 实验室有氯酸钾、稀盐酸、二氧化锰、大理石等药品及相关仪器和用品,请结合下列装置回答问题:
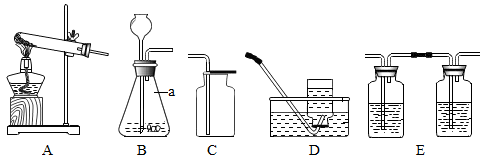
若用上述药品制取氧气:
(1)、发生反应的化学方程式为;(2)、将带火星的木条伸入集气瓶中,观察到的现象,证明该气体是氧气。(3)、用 D 收集氧气,是因为氧气具有的物理性质。要完成铁丝在氧气中燃烧的实验,用此方法收集氧气时合理的操作是(填“I”或“II”)时,在水面盖好玻璃片,取出集气瓶。I.集气瓶中还有少量水 II.集气瓶口有大气泡冒出
若用上述药品制取二氧化碳
(4)、仪器 a 的名称是;实验室通常选择的发生装置是(填字母); 反应时,此装置内 , 压强增大,大于外界气压,将气体排出。(5)、盐酸有挥发性,为除去制得的二氧化碳中的氯化氢和水蒸气,将气体通过装置 E。E中的液体药品由左至右依次是足量的和。三、流程题
-
11. 碲(Te)广泛用于彩色玻璃和陶瓷工艺。用某工业废渣(主要含有TeO2、少量Ag、Au)为原料制备碲的一种工艺流程如图。
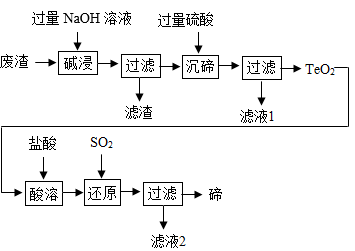
已知:TeO2微溶于水,易溶于较浓的强酸和强碱。
(1)、类比CO2与NaOH的反应,写出“碱浸”时发生反应的化学方程式:。(2)、“碱浸”后,过滤所得滤渣成分为。(3)、“沉碲”时,缓慢加入硫酸,并不断搅拌。此时发生两个化学反应方程式分别是:、 , 为生成TeO2沉淀需控制溶液的pH在4.5~5.0之间,其原因是。(4)、滤液1中的溶质是(填化学式)。(5)、“还原”时,在TeCl4溶液中通入SO2 , 反应生成碲和两种常见的酸,则该反应的化学方程式是 , 该反应中作还原剂的物质是(填化学式)。四、综合应用题
-
12. 化学兴趣小组对CO2与NaOH溶液反应的发生进行了探究。(1)、从压强变化的角度探究。
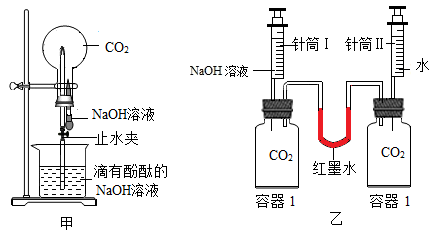
①利用图甲装置进行实验,先挤压胶头滴管,再打开止水夹,观察到烧瓶内形成红色“喷泉”,原因是烧瓶内压强(填“大于”或“小于”)外界大气压;
②利用图乙装置进行实验,分别将等体积的NaOH溶液和水同时注入盛有等体积CO2的玻璃容器中。证明CO2与NaOH溶液发生反应的实验现象是;
③写出CO2与NaOH溶液反应的化学方程式:。
(2)、利用“数字化实验”探究。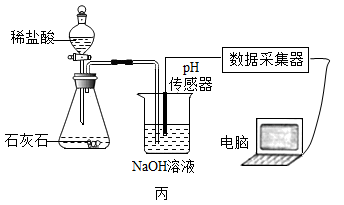
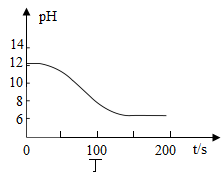
①写出图丙中制取CO2的化学方程式: , 检验CO2的方法是;
②实验测得烧杯中溶液的pH随时间的变化关系如图丁所示,可推知反应过程中浓度不断减小的离子是(填离子符号)。
(3)、氯碱工业生产的烧碱样品中常含有Na2CO3和NaCl等杂质。为测定烧碱样品中Na2CO3的质量分数,称取20g烧碱样品,加足量水溶解,再加入足量的BaCl2溶液,充分反应后,过滤,将滤渣洗涤、干燥、称量,得到0.197g碳酸钡(BaCO3)固体。①检验烧碱样品中是否含有Na2CO3 , 可选择的试剂是(填字母);
a.稀盐酸b.澄清石灰水c.酚酞
②计算烧碱样品中Na2CO3的质量分数(写出计算过程)。
五、科学探究题
-
13. 某同学在帮助实验员整理化学试剂时发现了一瓶标签残缺的无色溶液(如图甲所示),经实验员分析可知原瓶溶液中的溶质可能是NaCl、NaOH、Na2CO3、NaHCO3中的一种,为确认溶液中的溶质,他设计并进行了如下探究活动。
【资料查阅】上述四种物质的相关信息如表:
物质
NaCl
NaOH
Na2CO3
NaHCO3
常温下的溶解度/g
36
109
21.5
9.6
常温下稀溶液的pH
7
13
11
9
请回答下列问题:
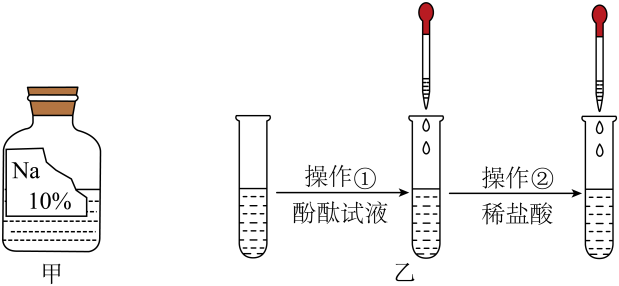 (1)、【实验探究1】
(1)、【实验探究1】如图乙所示,在进行操作①时,酚酞试液变红色,由此可确定溶质不是(填化学式)。在操作②时,观察到的实验现象是 , 可确定溶质也不是NaOH。
(2)、【探究结论】分析四种物质的相关信息,你认为该溶液中的溶质可能是上述四种物质中的 , 你的判断依据是。若上述探究结论是正确的,操作②发生反应的化学方程式为。(3)、【讨论质疑】有同学认为以上分析不严密,需要进一步实验确定,于是又进行了如下探究。【实验探究2】向操作①后试管中的溶液滴加过量CaCl2溶液(中性),充分反应后,试管中溶液颜色不变,但有白色沉淀产生。
【得出结论】通过实验探究2可确定原瓶溶液中的溶质应该是。
(4)、【反思拓展】造成该溶液出现上述实验现象的原因是(用化学方程式表示)。六、计算题
-
14. 有一包不纯的碳酸钠白色粉末,可能含有硫酸钠、氢氧化钠的一种或几种,某科学兴趣小组为探究其成分做了如下实验:
Ⅰ、现取样品16g于烧杯中并加84g水搅拌,全部溶解。再向烧杯中逐渐滴加26.1%硝酸钡溶液并不断搅拌,烧杯内固体的质量随加入硝酸钡溶液的质量的变化如图甲所示;
Ⅱ、在B点开始,向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图乙所示。
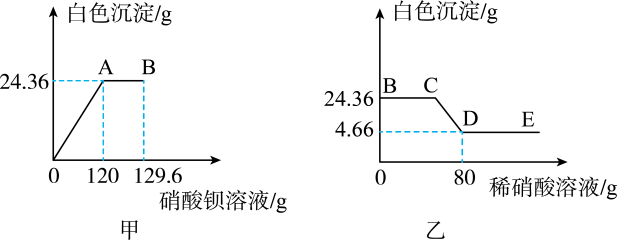
请回答下列问题:
(1)、原白色固体中,除了Na2CO3外,一定还含有(填化学式)。(2)、E点时,溶液中一定含有的溶质是。(3)、求D点时,溶液中硝酸钠的溶质质量分数为多少?(计算精确到0.1%)
-
-
-
-