上海市虹口区2023年中考二模化学试题
试卷更新日期:2023-08-10 类型:中考模拟
一、单选题
-
1. 空气中含量最多的气体是( )A、氮气 B、氧气 C、二氧化碳 D、水蒸气2. 物质在氧气中燃烧发出蓝紫色火焰的是( )A、氢气 B、木炭 C、硫 D、磷3. 与金刚石互为同素异形体的物质是( )A、活性炭 B、碳﹣60 C、一氧化碳 D、碳酸钙4. 放入水中能形成溶液的是( )A、氧化铜 B、大理石 C、氢氧化铁 D、硝酸银5. 属于纯净物的是( )A、奶茶 B、蒸馏水 C、米醋 D、汽水6. 属于有机物的是( )A、木炭 B、二氧化碳 C、碳酸 D、葡萄糖7. 能引起酸雨的物质是( )A、二氧化硫 B、氮气 C、二氧化碳 D、氢气8. 氯化铵(NH4Cl)中氮元素的化合价是( )A、+3 B、﹣3 C、﹣5 D、+59. 属于钾肥的是( )A、K2CO3 B、Ca(H2PO4)2 C、NaNO3 D、CO(NH2)210. 属于复分解反应的是( )A、4P+5O22P2O5 B、CO2+4H2CH4+2H2O C、Ca(OH)2+2HCl═CaCl2+2H2O D、H2+CuOCu+H2O11. 自来水生产过程中,属于化学变化的是( )A、沉降 B、过滤 C、吸附 D、杀菌消毒12. 关于H2O和H2O2的比较,正确的是( )A、一定条件下都可以反应生成O2 B、两种物质中氢元素的质量分数相等 C、构成两种物质的微粒中都含有氢分子 D、等质量的两种物质含有的分子数相同13. 用如图所示的装置制取二氧化碳,相关分析正确的是( )
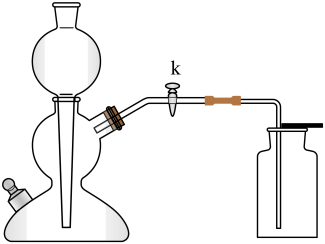 A、以碳酸钙粉末和稀盐酸为原料 B、用该方法收集二氧化碳是因为其能溶于水 C、用燃着的木条放入瓶内以检验气体是否收集满 D、关闭k,若固液不分离,可能是某种反应物已消耗完14. 能够达成实验目的的是( )A、用生石灰干燥二氧化碳 B、用灼热的氧化铜除去氢气中的水蒸气 C、用氯化钡溶液鉴别稀盐酸和稀硫酸 D、用二氧化碳鉴别氯化钠溶液和氯化钾溶液15. 氯化钾的溶解度曲线如图所示,将点表示的某氯化钾溶液转变为饱和溶液,可行的是( )
A、以碳酸钙粉末和稀盐酸为原料 B、用该方法收集二氧化碳是因为其能溶于水 C、用燃着的木条放入瓶内以检验气体是否收集满 D、关闭k,若固液不分离,可能是某种反应物已消耗完14. 能够达成实验目的的是( )A、用生石灰干燥二氧化碳 B、用灼热的氧化铜除去氢气中的水蒸气 C、用氯化钡溶液鉴别稀盐酸和稀硫酸 D、用二氧化碳鉴别氯化钠溶液和氯化钾溶液15. 氯化钾的溶解度曲线如图所示,将点表示的某氯化钾溶液转变为饱和溶液,可行的是( )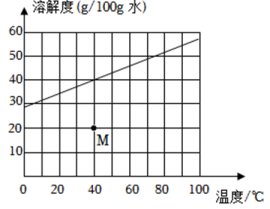 A、升高温度 B、降低温度 C、加入足量氯化钾 D、加入足量氯化钾饱和溶液
A、升高温度 B、降低温度 C、加入足量氯化钾 D、加入足量氯化钾饱和溶液二、多选题
-
16. 一氧化碳、碳分别与足量氧化铜反应,相关分析正确的是( )A、实验时都必须使用酒精喷灯 B、生成的气体都能使石灰水变浑浊 C、固体减少的质量都等于参加反应的氧化铜中氧元素的质量 D、生成等量铜时参加反应的一氧化碳和碳的物质的量之比为2:117. 氯酸钾受热分解的实验中,反应物、生成物的质量与时间的变化关系如图所示,相关分析正确的是( )
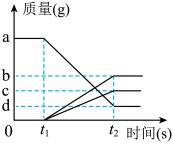 A、t1时反应开始,t2时反应停止 B、最终生成氧气的质量为(a﹣d)g C、反应后,剩余固体的质量是(b+d)g D、反应前后固体中只有钾元素的质量不变
A、t1时反应开始,t2时反应停止 B、最终生成氧气的质量为(a﹣d)g C、反应后,剩余固体的质量是(b+d)g D、反应前后固体中只有钾元素的质量不变三、填空题
-
18. 化学可以帮助我们分析并解决生活中的一些问题。(1)、75%的酒精溶液可用于杀菌消毒。
I.酒精的化学式是C2H6O,由种元素组成,1molC2H6O中约含有个碳原子;
II.将少量酒精溶液样品,滴入盛有白色硫酸铜粉末的试管中,证明溶液中含有水的现象是。
(2)、早在2006年国家已发布相关规定,要求用稀有气体代替氢气作为气球的填充物。氦气的化学式是;氢气在空气中燃烧的化学方程式是;氦气可以替代氢气的原因是。
(3)、食盐、蔗糖是厨房中常见的物质。I.取少量食盐,进行焰色反应,火焰呈色;
II.室温时,将等质量的食盐和蔗糖分别加入10mL水中,充分混合,蔗糖全部溶解、部分食盐固体未溶解,则室温时两种物质中溶解度较大的是。
四、实验题
-
19. 为研究稀硫酸的化学性质,某小组如图所示进行实验,充分反应后,只有试管甲中无固体剩余。
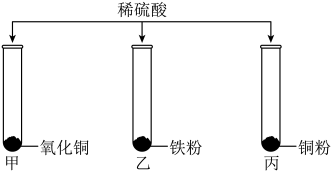 (1)、实验涉及的三种固体中,属于氧化物的是;(2)、可证明铁的金属活动性比铜强的实验是(选填试管编号)。(3)、甲中发生反应的化学方程式是。(4)、实验结束后,将三支试管中的剩余物倒入废液缸中,充分混合后过滤,取少量滤渣,向其中滴加稀硫酸,有气泡产生。则过滤后得到的滤渣的成分是 , 滤液中的溶质是。
(1)、实验涉及的三种固体中,属于氧化物的是;(2)、可证明铁的金属活动性比铜强的实验是(选填试管编号)。(3)、甲中发生反应的化学方程式是。(4)、实验结束后,将三支试管中的剩余物倒入废液缸中,充分混合后过滤,取少量滤渣,向其中滴加稀硫酸,有气泡产生。则过滤后得到的滤渣的成分是 , 滤液中的溶质是。五、流程题
-
20. 某氯化钠样品中混有少量氯化钙(溶液呈中性),为得到纯净的氯化钠,某小组取10g样品,放入水中全部溶解形成溶液,进行如下实验。
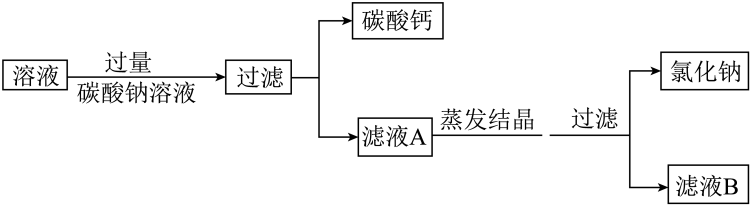 (1)、向碳酸钠溶液中滴加酚酞,溶液呈色。(2)、上述过程中,加入过量碳酸钠溶液的目的是。(3)、甲同学认为,上述过程中得到的氯化钠的质量等于10g样品中氯化钠的质量,请分析说明该说法的正误。(4)、为得到尽可能多的氯化钠,对滤液B继续实验,后续操作是。
(1)、向碳酸钠溶液中滴加酚酞,溶液呈色。(2)、上述过程中,加入过量碳酸钠溶液的目的是。(3)、甲同学认为,上述过程中得到的氯化钠的质量等于10g样品中氯化钠的质量,请分析说明该说法的正误。(4)、为得到尽可能多的氯化钠,对滤液B继续实验,后续操作是。六、实验题
-
21. 为探究氢氧化钠与盐酸反应的热量变化及溶液酸碱性的变化,某小组同学进行如下实验。(1)、【实验一】配制氢氧化钠溶液
氢氧化钠的部分溶解度如表所示。
温度(℃)
10
20
30
40
60
溶解度(g/100g水)
98
109
119
129
174
10℃时,氢氧化钠的溶解度是g/100g水。
(2)、20℃时,40g氢氧化钠与60g水混合,所得溶液是氢氧化钠的(选填“饱和”或“不饱和”)溶液;配制100g、4%的氢氧化钠溶液,需要水g。(3)、【实验二】探究氢氧化钠与盐酸的反应中,溶液酸碱性的变化。向盛有20g、4%的氢氧化钠溶液中逐滴滴加稀盐酸,用pH传感器测定溶液pH随滴入稀盐酸体积的变化,如图1所示。
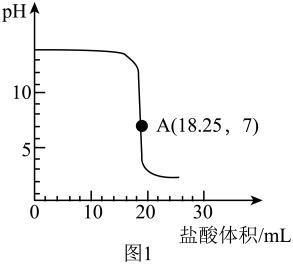
Ⅰ.氢氧化钠与盐酸反应的化学方程式是。
Ⅱ.结合数据说明,实验过程中A(18.25,7)点的含义。
(4)、含4g溶质的氢氧化钠溶液,与一定量稀盐酸恰好完全反应,参加反应的稀盐酸中溶质的物质的量是mol。(5)、【实验三】探究氢氧化钠与盐酸反应的热量变化。分别取等体积的氢氧化钠溶液、稀盐酸、水,按如表进行实验,测定溶液温度随时间变化的曲线如图2所示。证明中和反应有热量放出的证据是。
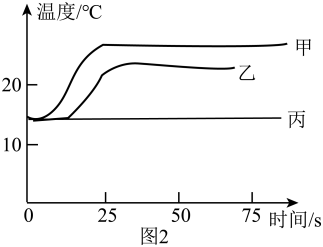
烧杯
烧杯中原有的物质
逐滴滴入的物质
甲
40%氢氧化钠溶液
4%稀盐酸
乙
40%氢氧化钠溶液
水
丙
4%稀盐酸
水
-
-
-