(人教版)2023-2024学年高中化学必修第一册 1.2离子反应 同步分层训练基础版
试卷更新日期:2023-08-09 类型:同步测试
一、选择题
-
1. 流感来袭,保持环境消杀很重要,下列消毒的试剂中属于电解质的是( )A、 B、84消毒液 C、乙醇 D、2. 常温下,下列离子在稀硝酸中不能大量存在的是( )A、 B、 C、 D、3. 能正确表示下列反应的离子方程式是( )A、向饱和Na2CO3溶液中通入足量CO2: B、铜丝插入浓硫酸中: 2H+ +Cu=Cu2++H2↑ C、Cl2通入水中: Cl2+H2O 2H+ +Cl- +ClO- D、向AlCl3溶液中滴加过量NaOH溶液: Al3++3OH-=Al(OH)3↓4. 下列离子方程式书写正确的是A、硫酸铜溶液中滴入过量的氨水: B、金属镁与浓硫酸共热: C、磁性氧化铁粉末中滴入过量稀硝酸: D、氢化钠与水剧烈反应:5. 下列物质中不能导电的是A、盐酸 B、干燥的固体 C、熔融的 D、溶液6. 室温下,下列各组离子在指定溶液中能大量共存的是A、使石蕊试液显蓝色的溶液中:、、、 B、0.1mol/LNaOH溶液:、、、 C、使酚酞变红色的溶液中:、、、 D、0.1mol/LHCl溶液:、、、7. 下表中对于相关物质的分类全部正确的是( )
选项
纯净物
混合物
非电解质
弱电解质
碱性氧化物
A.
液氨
氢氧化铁胶体
CO
氢硫酸
Al2O3
B.
明矾
漂白粉
乙醇
硫酸钡
Na2O
C.
碱石灰
碘酒
Cl2
HClO
K2O
D.
磁性氧化铁
水玻璃
SO2
冰醋酸
CaO
A、A B、B C、C D、D8. 下列关于化学反应及相关概念的叙述正确的是( )A、碱性氧化物一定是金属氧化物 B、溶于水能导电的化合物一定是电解质 C、酸性氧化物都是非金属氧化物 D、有单质生成的反应一定是氧化还原反应9. 莫尔盐[(NH4)2Fe(SO4)2•6H2O]溶液经常用于定量滴定实验,下列说法正确的是( )A、配制0.1mol·L-1莫尔盐溶液500mL,需莫尔盐19.6克 B、可与含Fe2+、HClO、H+、Cl﹣微粒的溶液大量共存 C、加入过量Ba(OH)2溶液发生反应:2Ba2++2SO42-+Fe2++2OH-=2BaSO4↓+Fe(OH)3↓ D、取样,加入铁氰化钾,若出现黄色沉淀,证明含Fe2+10. 化学物质丰富多彩,下列有关物质的说法正确的是( )A、漂白粉、盐酸、碘酒和液氯都属于混合物 B、向煮沸的1 mol/L NaOH溶液中滴加FeCl3饱和溶液,可制备Fe(OH)3胶体 C、熔融氯化钠,盐酸和铜都能导电,所以都属于电解质 D、一束平行光线照射蛋白质溶液时,从侧面可以看到一束光亮的通路二、非选择题
-
11. 写出下列物质的电离方程式(1)、HCl。(2)、NaOH。(3)、CaCO3。(4)、Na2SO4。12. 在以下五种物质中①石墨;②天然气;③熔融Na2CO3;④酒精;⑤二氧化碳,存在12C、13C、14C物质是(填编号),其中能导电的是(填编号),属于电解质的是(填编号),属于非电解质的是(填编号)。13. 在两份相同的溶液中,分别滴入物质的量浓度相等的、溶液,其导电能力随滴入溶液体积变化的曲线如图所示。回答下列问题:
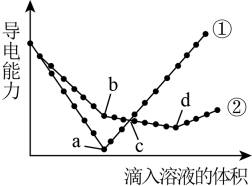 (1)、在水溶液中的电离方程式是;属于“酸”、“碱”、“盐”中的;图中代表滴加溶液的变化曲线是(填“①”或“②”)。(2)、曲线①中a点导电能力最弱的原因是(用化学方程式表示);b点溶液中大量存在的离子是。(3)、c点两溶液中浓度:①②(填“>”、“<”或“=”,下同);d点对应的溶液显(填“酸性”、“中性”、“碱性”)。(4)、曲线②中的b、d两点对应所加溶液的体积比为。14. 实验室中盛有三种物质的试剂瓶上的标签已损坏,某同学想了解这三种物质(甲为液态,乙、丙为固态,且乙、丙均为盐)的成分,他将三种物质一起溶于水得到一种无色透明溶液且无气泡产生,该溶液中可能含有下列离子:、、、、、和 , 取该溶液进行如下实验:
(1)、在水溶液中的电离方程式是;属于“酸”、“碱”、“盐”中的;图中代表滴加溶液的变化曲线是(填“①”或“②”)。(2)、曲线①中a点导电能力最弱的原因是(用化学方程式表示);b点溶液中大量存在的离子是。(3)、c点两溶液中浓度:①②(填“>”、“<”或“=”,下同);d点对应的溶液显(填“酸性”、“中性”、“碱性”)。(4)、曲线②中的b、d两点对应所加溶液的体积比为。14. 实验室中盛有三种物质的试剂瓶上的标签已损坏,某同学想了解这三种物质(甲为液态,乙、丙为固态,且乙、丙均为盐)的成分,他将三种物质一起溶于水得到一种无色透明溶液且无气泡产生,该溶液中可能含有下列离子:、、、、、和 , 取该溶液进行如下实验:Ⅰ.用玻璃棒蘸取少量溶液于pH试纸上,与标准比色卡对比,pH约为3。
Ⅱ.取少许原溶液滴入硫酸溶液,产生白色沉淀。
Ⅲ.另取少许原溶液,滴加少量溶液,产生白色沉淀。
Ⅳ.取Ⅲ中过滤后的滤液少许,滴加过量NaOH溶液,未产生白色沉淀。
(1)、①由题意和Ⅰ中操作判断,原溶液中肯定不存在的离子是(填离子符号,下同),肯定存在的离子是。②根据Ⅱ、Ⅲ中实验现象判断,原溶液中还存在的离子是。
(2)、依次写出实验Ⅲ、Ⅳ中发生反应的离子方程式:、。(3)、取7.45g的固体乙溶于水,向其中加入过量硝酸银溶液,产生14.35g沉淀。写出乙与硝酸银反应的化学方程式:。(4)、由分析可知甲、丙的标签依次为、。15. 某化学兴趣小组对含某些离子(如表)的工业废水进行研究,废水中各离子的物质的量浓度相等,均为。阳离子
、、、
阴离子
、、、、
(1)、该溶液为无色溶液,则一定不存在的离子是。(2)、向废水中加入过量KOH溶液微热,有白色沉淀和无色气体产生,则沉淀是(填化学式,下同),气体是。(3)、若向废水中加入过量盐酸,会生成遇空气变为红棕色的无色气体和 , 写出生成该无色气体和的离子方程式:。一定条件下红棕色气体与(2)中产生的气体能反应生成无污染的气体,该反应的化学方程式为。(4)、向(3)中最后所得的溶液中加入过量的溶液,充分反应后观察到有白色沉淀产生。①白色沉淀是。
②(填“能”或“不能”)仅依据该现象判断废水中存在白色沉淀中的阴离子,理由是。
(5)、结合(1)(2)(3),该废水中一定存在的离子是。