初中科学八年级上册 第一章 第5节 物质的溶解 第二课时
试卷更新日期:2023-08-08 类型:同步测试
一、单选题
-
1. 20℃时,氯化钠的溶解度为36克。则下图中能正确表示该温度下,饱和氯化钠溶液中的溶质和溶剂比例的是( )A、
 B、
B、 C、
C、 D、
D、 2. 许多科学概念在逻辑上存在并列、交叉和包含关系,如图所示。下列说法正确的是( )
2. 许多科学概念在逻辑上存在并列、交叉和包含关系,如图所示。下列说法正确的是( ) A、纯净物和混合物属于交叉关系 B、混合物和溶液属于包含关系 C、饱和溶液和不饱和溶液属于交叉关系 D、饱和溶液和浓溶液属于并列关系3. 固体甲、乙、丙在不同温度下的溶解度如表所示,甲、乙、丙从溶液中析出的晶体不含结晶水。下列说法正确的是( )
A、纯净物和混合物属于交叉关系 B、混合物和溶液属于包含关系 C、饱和溶液和不饱和溶液属于交叉关系 D、饱和溶液和浓溶液属于并列关系3. 固体甲、乙、丙在不同温度下的溶解度如表所示,甲、乙、丙从溶液中析出的晶体不含结晶水。下列说法正确的是( )温度/℃
0
20
40
60
80
溶解度/g
甲
0.18
0.16
0.14
0.12
0.09
乙
35.7
36.0
36.6
37.3
38.4
丙
13.3
31.6
63.9
110
169
A、固体甲的溶解度随温度的升高而增大 B、20℃时,丙溶液中溶质和溶剂质量比为31.6: 100 C、分别将等质量的乙、丙饱和溶液由60℃降温到20℃,溶液中溶质质量大小:丙>乙. D、分别将等质量的甲、丙饱和溶液由60℃降温到20℃,溶液中溶剂质量大小:甲>丙4. 向盛有等质量水的甲、乙、丙三个烧杯中分别加入18g、40g、40g某种固体,充分搅拌后静置,现象如图所示。下列说法正确的是( ) A、该固体的溶解度随温度的升高而减小 B、甲、丙烧杯中的溶液一定属于不饱和溶液 C、乙烧杯中溶液的溶质质量分数一定大于甲 D、乙烧杯中溶液的溶质质量分数一定小于丙5. 小金网购了一个“气象瓶”,如图所示,密闭瓶内装有硝酸钾、蒸馏水。当外界温度降低时,瓶中固体逐渐增多,此过程中( )
A、该固体的溶解度随温度的升高而减小 B、甲、丙烧杯中的溶液一定属于不饱和溶液 C、乙烧杯中溶液的溶质质量分数一定大于甲 D、乙烧杯中溶液的溶质质量分数一定小于丙5. 小金网购了一个“气象瓶”,如图所示,密闭瓶内装有硝酸钾、蒸馏水。当外界温度降低时,瓶中固体逐渐增多,此过程中( ) A、溶剂质量不变 B、溶液是不饱和溶液 C、溶液质量不变 D、溶解度不变6. 氢氧化钙的溶解度随温度升高而减小。要想把一瓶接近饱和的氢氧化钙溶液变成饱和,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水。其中措施正确的是( )A、①②④ B、①③④ C、①③⑤ D、①②⑤7. 在一定温度下,小明用硝酸钾晶体(KNO3)和溶质质量分数为20%的硝酸钾溶液配制一定质量分数的硝酸钾溶液。如图所示,则如图溶液中,一定是饱和溶液的是( )
A、溶剂质量不变 B、溶液是不饱和溶液 C、溶液质量不变 D、溶解度不变6. 氢氧化钙的溶解度随温度升高而减小。要想把一瓶接近饱和的氢氧化钙溶液变成饱和,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水。其中措施正确的是( )A、①②④ B、①③④ C、①③⑤ D、①②⑤7. 在一定温度下,小明用硝酸钾晶体(KNO3)和溶质质量分数为20%的硝酸钾溶液配制一定质量分数的硝酸钾溶液。如图所示,则如图溶液中,一定是饱和溶液的是( ) A、①② B、②③ C、①②③ D、②③④8. 生活中的下列现象不能说明气体溶解能力随温度升高而减弱的是( )A、烧开水时,沸腾前有气泡溢出 B、开启啤酒瓶盖, 有大量气泡溢出 C、夏季黄昏时, 池塘里的鱼浮出水面 D、阳光充足时,盛满水的鱼缸壁上有小气泡9. 小柯同学用25℃的水溶解一定量的硝酸钾,充分搅拌后发现杯底还有部分硝酸钾固体没有溶解,然后该同学又用酒精灯加热至50℃(不考虑水的蒸发),固体全部溶解。那么在加热前后,下列各量没有发生变化的是( )A、硝酸钾的溶解度 B、溶质的质量 C、溶剂的质量 D、溶质的质量分数10. 已知硫酸溶液密度大于1,且浓度越大、密度越大。某硫酸的质量分数为W,取等量的两份硫酸溶液分别进行下列操作:
A、①② B、②③ C、①②③ D、②③④8. 生活中的下列现象不能说明气体溶解能力随温度升高而减弱的是( )A、烧开水时,沸腾前有气泡溢出 B、开启啤酒瓶盖, 有大量气泡溢出 C、夏季黄昏时, 池塘里的鱼浮出水面 D、阳光充足时,盛满水的鱼缸壁上有小气泡9. 小柯同学用25℃的水溶解一定量的硝酸钾,充分搅拌后发现杯底还有部分硝酸钾固体没有溶解,然后该同学又用酒精灯加热至50℃(不考虑水的蒸发),固体全部溶解。那么在加热前后,下列各量没有发生变化的是( )A、硝酸钾的溶解度 B、溶质的质量 C、溶剂的质量 D、溶质的质量分数10. 已知硫酸溶液密度大于1,且浓度越大、密度越大。某硫酸的质量分数为W,取等量的两份硫酸溶液分别进行下列操作:⑴蒸发溶液后恢复至室温,溶液质量减为原来一半,此时溶液的质量分数为W1
⑵蒸发溶液后恢复至室温,溶液体积减为原来一半,此时溶液的质量分数为W2
则下列关系正确的是( )
A、W1﹥W2 B、W1﹤W2 C、W1=W2 D、W2﹥2W11. 现对某物质A的不饱和溶液进行恒温蒸发,若蒸发10克水析出a克固体,若蒸发20克水析出b克固体,若蒸发30克水析出c克固体,则下列关系正确的是( )A、c=a+b B、c=2b-a C、c=2b+a D、2a+b12. 小明要配制50g质量分数为14%的氯化钠溶液制,下列关于配制该溶液的说法不正确的是( )①若用氯化钠固体配制,需称取氯化钠固体7.0g
②用托盘天平称氯化钠固体时,在两盘各放一张质量相等的纸
③选用200mL量筒量取所需水的体积
④实验中用到的玻璃仪器有烧杯、量筒、玻璃棒、滴管和试剂瓶
⑤用量筒量取水时,俯视读数,配得溶液的溶质质量分数偏小
A、①③ B、②③⑤ C、③⑤ D、②④⑤13. 下列有关溶液知识的解释不正确的是( )A、饱和溶液析出晶体后,溶质的质量分数可能不变 B、“冬天捞碱,夏天晒盐”的主要原理是不同物质的溶解度随温度变化不同 C、不饱和溶液转化为饱和溶液,其溶质质量分数一定变大 D、使一杯接近饱和的硝酸钾溶液达到饱和可采用降温的方式14. 如图,海水淡化可采用膜分离技术,对淡化膜右侧的海水加压,水分子可以透过淡化膜进人左侧淡水池,而海水中的其他物质都不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化进行分析,正确的是( ) A、溶质质量增加 B、溶剂质量不变 C、溶液质量不变 D、溶质质量分数增大15. 小柯在做制取硫酸铜晶体实验时,将硫酸铜粉末缓缓加入装有沸水的烧杯中,并不断搅拌 直至形成饱和溶液,冷却至室温,可以看到大量蓝色晶体析出。在此过程中,下列分析正确的是 ( )
A、溶质质量增加 B、溶剂质量不变 C、溶液质量不变 D、溶质质量分数增大15. 小柯在做制取硫酸铜晶体实验时,将硫酸铜粉末缓缓加入装有沸水的烧杯中,并不断搅拌 直至形成饱和溶液,冷却至室温,可以看到大量蓝色晶体析出。在此过程中,下列分析正确的是 ( ) A、溶解度不变 B、溶液质量减小 C、溶质质量不变 D、溶质质量分数增大16. 溶解度为Sg的某物质饱和溶液,跟水以1:4质量比混合后,溶液的质量分数为为( )A、 B、 C、 D、17. 食盐在20℃时溶解度为36克,下列操作可以实现目的是( )A、将100克15%的食盐溶液蒸发掉50克水,使溶液中食盐的质量分数达到30% B、向50克5%的食盐溶液中加入5克食盐,使溶液中食盐的质量分数达到10% C、向100克15%的食盐溶液中加入10克食盐,使溶液中食盐的质量分数达到25% D、将50克5%的食盐溶液蒸发掉25克水,使溶液中食盐的质量分数达到10%18. 室温下,向一杯不饱和的食盐溶液中逐渐加入食盐,下列图像中符合变化规律的是( )A、
A、溶解度不变 B、溶液质量减小 C、溶质质量不变 D、溶质质量分数增大16. 溶解度为Sg的某物质饱和溶液,跟水以1:4质量比混合后,溶液的质量分数为为( )A、 B、 C、 D、17. 食盐在20℃时溶解度为36克,下列操作可以实现目的是( )A、将100克15%的食盐溶液蒸发掉50克水,使溶液中食盐的质量分数达到30% B、向50克5%的食盐溶液中加入5克食盐,使溶液中食盐的质量分数达到10% C、向100克15%的食盐溶液中加入10克食盐,使溶液中食盐的质量分数达到25% D、将50克5%的食盐溶液蒸发掉25克水,使溶液中食盐的质量分数达到10%18. 室温下,向一杯不饱和的食盐溶液中逐渐加入食盐,下列图像中符合变化规律的是( )A、 B、
B、 C、
C、 D、
D、
二、填空题
-
19. 20℃时,将等质量的甲、乙两种固体物质(不含结晶水),分别加入到盛有100g 水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度如图3。
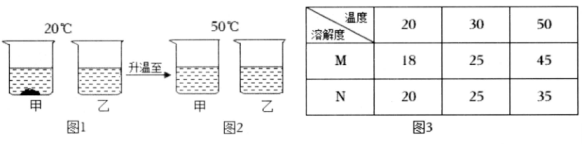 (1)、图1中甲是溶液(选填“饱和”或“不饱和”)。(2)、图2中两溶液溶质质量分数一定 (选填 “相等”或“不相等”);(3)、图3中M表示的是物质(选填“甲”或“乙”)20. 小科同学在实验室“配制100克质量分数为15%的氯化钠溶液”。请回答:
(1)、图1中甲是溶液(选填“饱和”或“不饱和”)。(2)、图2中两溶液溶质质量分数一定 (选填 “相等”或“不相等”);(3)、图3中M表示的是物质(选填“甲”或“乙”)20. 小科同学在实验室“配制100克质量分数为15%的氯化钠溶液”。请回答: (1)、如图甲所示,小科用调节平衡的天平称量氯化钠,右盘放了15克砝码,左盘加氯化钠,分度盘指针如图乙所示,他接下来应。(2)、经检测,所配制溶液的溶质质量分数偏大,其原因可能是(填字母编号)。
(1)、如图甲所示,小科用调节平衡的天平称量氯化钠,右盘放了15克砝码,左盘加氯化钠,分度盘指针如图乙所示,他接下来应。(2)、经检测,所配制溶液的溶质质量分数偏大,其原因可能是(填字母编号)。A.量取水时,俯视读数B.用于配制的烧杯在使用前未干燥
C.称量时,所使用的砝码生锈D.转移称量好的氯化钠固体时,有少量洒落
21. 硝酸钾的溶解度随温度升高而增大。如图所示是对硝酸钾溶液的实验操作及变化情况,以及同一小球在三种溶液中的浮沉情况。请回答下列问题: (1)、操作I可能是 (选填字母)。A、降低温度 B、加入硝酸钾 C、蒸发水分(2)、小球所受的浮力F①、F②、F③的大小关系正确的是 。A、F①<F②=F③ B、F①<F②<F③ C、F①>F②=F③ D、F①=F②=F③(3)、从②到③,烧杯底析出硝酸钾晶体5克,整个装置总质量减少了20克,可知②中的溶质质量分数是。22. “天气瓶”和“彩球温度计”是两款不同的现代居家饰品,都可以获知气温变化。
(1)、操作I可能是 (选填字母)。A、降低温度 B、加入硝酸钾 C、蒸发水分(2)、小球所受的浮力F①、F②、F③的大小关系正确的是 。A、F①<F②=F③ B、F①<F②<F③ C、F①>F②=F③ D、F①=F②=F③(3)、从②到③,烧杯底析出硝酸钾晶体5克,整个装置总质量减少了20克,可知②中的溶质质量分数是。22. “天气瓶”和“彩球温度计”是两款不同的现代居家饰品,都可以获知气温变化。 (1)、图甲为“天气瓶”,当外界温度降低时,瓶中晶体增多。由此推测瓶中晶体的溶解度随温度降低而。(2)、图乙为“彩球温度计”,当温度降低到小球所标注的温度值时,该小球会浮起。某时,彩球的沉浮情况如乙图所示(“20℃”、“18℃”的小球沉底),则此时的气温范围为。(3)、图乙中漂浮的“24℃”小球重5克,则其所受浮力为牛。23. A、B、C三种固体物质在水中的溶解度曲线如图所示,请回答:
(1)、图甲为“天气瓶”,当外界温度降低时,瓶中晶体增多。由此推测瓶中晶体的溶解度随温度降低而。(2)、图乙为“彩球温度计”,当温度降低到小球所标注的温度值时,该小球会浮起。某时,彩球的沉浮情况如乙图所示(“20℃”、“18℃”的小球沉底),则此时的气温范围为。(3)、图乙中漂浮的“24℃”小球重5克,则其所受浮力为牛。23. A、B、C三种固体物质在水中的溶解度曲线如图所示,请回答: (1)、℃时,A,B两种物质在100g水中达到饱和状态时溶解的质量相等。(2)、若B中混有少量的A,最好采用的方法提纯B。(3)、现有接近饱和的C物质溶液,使其变成饱和溶液的方法有:①加入C物质;②恒温蒸发溶剂;③。(4)、t3℃时将20g A物质放入50g水中,充分搅拌,所得溶液中溶质的质量分数是。(5)、将t3℃时等质量的A、B、C三种物质的饱和溶液中所含溶剂的质量由大到小的顺序是。24. 分析处理图表中的信息是学习化学的一种重要方法。
(1)、℃时,A,B两种物质在100g水中达到饱和状态时溶解的质量相等。(2)、若B中混有少量的A,最好采用的方法提纯B。(3)、现有接近饱和的C物质溶液,使其变成饱和溶液的方法有:①加入C物质;②恒温蒸发溶剂;③。(4)、t3℃时将20g A物质放入50g水中,充分搅拌,所得溶液中溶质的质量分数是。(5)、将t3℃时等质量的A、B、C三种物质的饱和溶液中所含溶剂的质量由大到小的顺序是。24. 分析处理图表中的信息是学习化学的一种重要方法。如表是氯化钠,碳酸钠和硝酸钠在不同温度时的溶解度,根据此表回答:
温度/℃
10
20
30
40
50
60
70
溶解度/g
氯化钠
35.8
36.0
36.3
36.6
37
37.3
37.8
碳酸钠
12.2
21.8
39.7
53.2
硝酸钾
20.9
31.6
45.8
63.9
85.5
110
138
(1)、20℃时,氯化钠的溶解度为g,此时若将20克的氯化钠倒入50克水中,充分溶解,配得的 溶液溶质质量分数为 。 (计算结果精确到0.1%,下同)(2)、碳酸钠的溶解度在10-40℃随温度的升高而 (填“增大”或“减小”),在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是 (填“饱和溶液”或“不饱和溶 液”) ,将上述溶液升温到30℃,该溶液的溶质质量分数为。(3)、硝酸钾溶液中含有少量氯化钠时,可通过 的方法提纯,对上述提纯后析出的晶体和剩 余溶液描述正确的是 (填序号) 。A.剩余溶液一定是硝酸钾饱和溶液
B.剩余溶液中溶质只有氯化钠
C.上述方法可以将两者完全分离
D.析出的晶体硝酸钾没有一定的熔点
三、实验探究题
-
25. 小明在学习了硝酸钾溶解度随温度变化的规律后,开展了硫酸钠溶解度随温度变化规律的探究。
【实验过程】
步骤一:准确称量干燥的蒸发皿质量;
步骤二:在T℃下保持恒温,配制该温度下的硫酸钠饱和溶液;
步骤三:取一定量的硫酸钠饱和溶液倒入蒸发皿中;
步骤四:加热蒸发皿中溶液至干,放入干燥器内冷却后称量;
步骤五:计算出溶解度并记录在表格中。
改变温度重复实验,获得数据如下表
温度/℃
0
10
20
30
40
50
60
硫酸钠/g
4.9
9.1
19.5
40.8
48.8
46.2
45.3
【数据处理】
(1)、在步骤二中你判断该硫酸钠溶液达到饱和的证据是。(2)、根据表中数据画出硫酸钠的溶解度随温度变化的曲线。【得出结论】硫酸钠的溶解度随温度的变化规律:。
26. 某兴趣小组的三位同学为了探究物质的溶解能力与哪些因素有关,设计了如下实验并记录了相关的实验数据,记录如表。甲同学
乙同学
丙同学
实验序号
1
2
3
4
5
6
7
温度/℃
25
25
25
50
60
70
25
溶剂种类
水
水
水
水
水
水
酒精
溶剂质量/g
10
20
30
20
20
20
10
溶质M质量/g
7
7
7
5
5
5
7
溶解物质质量/g
2.1
4.2
6.3
5
5
5
0
(1)、分析实验数据后,甲同学认为物质溶解性大小与溶剂的多少有关,而老师认为该结论是错误的,你认为老师的理由是什么?。(2)、乙同学实验后得出结论:物质的溶解能力与温度无关。但这一结论与事实不符,你认为与事实不符的原因是 。(3)、丙同学的实验可以和实验1形成对照,所探究的问题是 。27. 小科欲配制80克5%的氯化钠溶液,该实验的部分操作如图所示。 (1)、需要称取氯化钠的质量 克。称量时出现了右盘略低的现象,如图甲,接下来的具体操作是 。(2)、量取水时,选用规格为 (选填“100”或“200”)毫升的量筒更加合理。(3)、丙中玻璃棒的作用是 。(4)、下列操作会导致配制的氯化钠溶液质量分数偏小的有 ____。A、砝码磨损 B、氯化钠固体不纯 C、按照图乙的方法读数 D、将量筒中的水倒入烧杯时,有水洒出28. 某同学配制 50g 6%氯化钠溶液, 整个操作过程如图所示, 回答下列问题:
(1)、需要称取氯化钠的质量 克。称量时出现了右盘略低的现象,如图甲,接下来的具体操作是 。(2)、量取水时,选用规格为 (选填“100”或“200”)毫升的量筒更加合理。(3)、丙中玻璃棒的作用是 。(4)、下列操作会导致配制的氯化钠溶液质量分数偏小的有 ____。A、砝码磨损 B、氯化钠固体不纯 C、按照图乙的方法读数 D、将量筒中的水倒入烧杯时,有水洒出28. 某同学配制 50g 6%氯化钠溶液, 整个操作过程如图所示, 回答下列问题:
 (1)、配制溶液的正确操作顺序为②①(填序号,下同),其中操作错误的是。(2)、纠正错误操作后,用托盘天平称量所需的氯化钠,若发现托盘天平的指针偏向左盘, 则 接下来应该进行的操作是 (填字母) 。A、适量增加砝码 B、适量减少适量氯化钠固体 C、 向右调节平衡螺母(3)、在配制溶液的过程中,若该同学量取水时俯视读数,则配制的溶液溶质质量分数将偏。(4)、将配制好的溶液装入 中 (选填“广口瓶”或“细口瓶”) ,盖好瓶塞并贴标签。
(1)、配制溶液的正确操作顺序为②①(填序号,下同),其中操作错误的是。(2)、纠正错误操作后,用托盘天平称量所需的氯化钠,若发现托盘天平的指针偏向左盘, 则 接下来应该进行的操作是 (填字母) 。A、适量增加砝码 B、适量减少适量氯化钠固体 C、 向右调节平衡螺母(3)、在配制溶液的过程中,若该同学量取水时俯视读数,则配制的溶液溶质质量分数将偏。(4)、将配制好的溶液装入 中 (选填“广口瓶”或“细口瓶”) ,盖好瓶塞并贴标签。四、解答题
-
29. “过氧乙酸”消毒液广泛用于教室、食堂、寝室等场所的卫生消毒。某品牌“过氧乙酸”消毒液标签如下表所示。
过氧乙酸(1L)
溶质质量分数
20%
密度
1.2 g/cm3
强腐蚀性、阴冷处存放
(1)、取该消毒液1L,其中含过氧乙酸克。(2)、取12g该溶液配制成溶质质量分数为0.5%的过氧乙酸溶液用来消毒,请计算需要加入水的质量?30. 不同温度下饱和硝酸钾溶液的溶质质量分数和密度如表。温度(℃)
0
20
40
60
80
质量分数
11.7%
24%
39.0%
52.4%
62.8%
密度(g/cm3)
1.03
1.06
1.10
1.12
1.20
 (1)、现将100毫升40℃的硝酸钾溶液稀释成30%,需加水多少克?(2)、如图甲所示,有一重2.2牛的木块漂浮于40℃的硝酸钾饱和溶液中,请计算40℃时,木块受到的浮力大小和木块排开液体的体积。(3)、当温度改变时,图甲中木块排开液体的体积V排随时间变化情况如图乙所示。由此推断温度在 (选填“升高”、“降低”或“不变”)。31. 氢氧化钠是生产和生活中的一种重要原料,也是实验室里常见的一种化学药品。如表是某同学在室温时(20℃时 )将氢氧化钠固体溶解于水的实验数据,请回答下列问题:
(1)、现将100毫升40℃的硝酸钾溶液稀释成30%,需加水多少克?(2)、如图甲所示,有一重2.2牛的木块漂浮于40℃的硝酸钾饱和溶液中,请计算40℃时,木块受到的浮力大小和木块排开液体的体积。(3)、当温度改变时,图甲中木块排开液体的体积V排随时间变化情况如图乙所示。由此推断温度在 (选填“升高”、“降低”或“不变”)。31. 氢氧化钠是生产和生活中的一种重要原料,也是实验室里常见的一种化学药品。如表是某同学在室温时(20℃时 )将氢氧化钠固体溶解于水的实验数据,请回答下列问题:序号
水的质量(克)
加入氢氧化钠的质量(克)
溶液的质量(克)
1
10
9
19
2
10
10
20
3
10
11
20.9
4
10
12
m
(1)、m=;(2)、在这4次实验中,得到的氢氧化钠溶液属于饱和溶液的是(填实验序号);(3)、将第2次实验所得溶液稀释为5%的稀溶液,用于制作叶脉书签,还需要加入水多少克?(列式计算)32. 某同学在实验室进行有关浓硫酸的实验,观察瓶上的标签(如表所示)。他从瓶中倒出50毫升用于配制成稀硫酸,问:浓硫酸(H2SO4) 500毫升
浓度(质量分数)
98%
密度
1.84克/厘米3
相对分子质量
98
强腐蚀性,阴冷,密封贮藏
(1)、这50毫升浓硫酸中含溶质硫酸克。(2)、他将这50毫升浓硫酸与200克水均匀混合,求所得稀硫酸的质量分数。(结果保留到0.1%)(3)、若实验室用98%的浓硫酸来配制630g溶质质量分数28%的稀硫酸,则需要再加多少毫升的水?33. “新冠”疫情期间, “二氧化氯”消毒液广泛应用于学校教室、 食堂、寝室等的卫生消毒。某校放学后将对全校教室、食堂、寝室等进行全面消毒。小陈观察到瓶上的标签如表所示。求:二氧化氯1000mL
溶质的质量分数
80%
密度
1.2g/cm3
强腐蚀性,阴冷,密封储藏
(1)、这1000毫升二氧化氯消毒液的质量是g,其中含溶质二氧化氯g;(2)、欲配制48千克质量分数为10%的稀二氧化氯消毒液用来消毒,需要取多少千克这种二氧化氯消毒液?五、综合说理题
-
34. 小李同学做了下面两个实验,请解释其中的科学道理:

 (1)、准备了一杯60℃的恰好饱和的硝酸钾溶液,悬浮着一只新鲜鸡蛋。如图,放在室温下,一段时间后,发现鸡蛋下沉,请用学过的知识解释这一现象。(2)、他在一个空矿泉水瓶里面套一个气球,在矿泉水瓶外用绳子扎紧气球的口,然后小明对着气球吹气,可是,小明用了很大的力气也只能吹大一点点,可是矿泉水瓶里还有很大的空间,小明觉得很纳闷,请你来帮忙解释这个现象。
(1)、准备了一杯60℃的恰好饱和的硝酸钾溶液,悬浮着一只新鲜鸡蛋。如图,放在室温下,一段时间后,发现鸡蛋下沉,请用学过的知识解释这一现象。(2)、他在一个空矿泉水瓶里面套一个气球,在矿泉水瓶外用绳子扎紧气球的口,然后小明对着气球吹气,可是,小明用了很大的力气也只能吹大一点点,可是矿泉水瓶里还有很大的空间,小明觉得很纳闷,请你来帮忙解释这个现象。