【备考2024年】2023年高考化学新课标卷真题变式分层精准练第10题
试卷更新日期:2023-08-06 类型:二轮复习
一、原题
-
1. 氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:(1)、根据图1数据计算反应的。
 (2)、研究表明,合成氨反应在催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,表示被吸附于催化剂表面的)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为(填步骤前的标号),理由是。(3)、合成氨催化剂前驱体(主要成分为)使用前经还原,生成包裹的。已知属于立方晶系,晶胞参数 , 密度为 , 则晶胞中含有的原子数为(列出计算式,阿伏加德罗常数的值为)。(4)、在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为 , 另一种为。(物质i的摩尔分数:)
(2)、研究表明,合成氨反应在催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,表示被吸附于催化剂表面的)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为(填步骤前的标号),理由是。(3)、合成氨催化剂前驱体(主要成分为)使用前经还原,生成包裹的。已知属于立方晶系,晶胞参数 , 密度为 , 则晶胞中含有的原子数为(列出计算式,阿伏加德罗常数的值为)。(4)、在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为 , 另一种为。(物质i的摩尔分数:)
①图中压强由小到大的顺序为 , 判断的依据是。
②进料组成中含有情性气体的图是。
③图3中,当、时,氮气的转化率。该温度时,反应的平衡常数(化为最简式)。
二、基础
-
2. 有以下物质①石墨;②钠;③酒精;④氨气;⑤硫化氢;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧纯醋酸;⑨氧化钠固体;⑩液态氯化氢。(1)、其中能导电的是;属于非电解质的是;(2)、若④和⑤中所含氢原子数相等,则④和⑤的质量之比;(3)、写出足量⑥和少量⑦在水溶液中反应的离子方程式;(4)、室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室A室中充入H2、O2混合气体,B室充入1 mol空气,此时活塞的位置如图所示。

实验测得A室混合气体的质量为34 g,若将A室H2、O2的混合气体点燃,恢复原温度后,(非气体体积忽略不计)最终活塞停留的位置在刻度处。
3. 硫酸在国民经济中占有极其重要的地位,工业上常以黄铁矿为原料用接触法制硫酸。(1)、接触室中发生的反应: 。①若测得2h后的浓度为0.6 , 此时间内的消耗速率为0.2 , 则开始时的浓度为。
②将0.050mol (g)和0.030mol (g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测。计算该条件下反应的平衡常数K= , 的平衡转化率为。
③可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为。
 (2)、硫酸的生产中,下列说法错误的是____(填字母)。A、把黄铁矿磨成细粉末在“沸腾”状态下燃烧,可以提高反应速率和原料的利用率 B、气体在进接触室前要先净化,可防止催化剂中毒 C、接触室中反应温度采用400~500℃,主要是为了提高原料的平衡转化率 D、吸收塔中操作采取逆流的形式,从下而上,水从上而下(3)、为减少的排放,工业上将转化为固定,但存在C0会同时发生以下两个反应:
(2)、硫酸的生产中,下列说法错误的是____(填字母)。A、把黄铁矿磨成细粉末在“沸腾”状态下燃烧,可以提高反应速率和原料的利用率 B、气体在进接触室前要先净化,可防止催化剂中毒 C、接触室中反应温度采用400~500℃,主要是为了提高原料的平衡转化率 D、吸收塔中操作采取逆流的形式,从下而上,水从上而下(3)、为减少的排放,工业上将转化为固定,但存在C0会同时发生以下两个反应:反应
活化能
平衡常数
Ⅰ
Ⅱ
恒容、恒温()条件下,反应体系中随时间t变化的总趋势如图。结合已知信息分析随时间t变化的原因:。
 4. 中科院兰州化学物理研究所用催化加氢合成低碳烯烃,反应过程如图所示:
4. 中科院兰州化学物理研究所用催化加氢合成低碳烯烃,反应过程如图所示:
回答下列问题:
(1)、在存在下,加氢反应中,RWGS反应的活化能(填“大于”“小于”或“不能判断”)FTS反应的活化能。同温同压下,无催化剂时RWGS反应很难进行,其原因是。(2)、已知:Ⅰ.Ⅱ.
①由和生成和的热化学方程式为。
②的(填“>”“<”或“=”)0,从化学键的角度说明判断的理由:。
(3)、在催化剂存在下,400kPa、500C条件下,将1mol和加入某密闭容器中合成低碳烯烃: , 40min时反应达到平衡,此时测得的转化率和各含碳产物占所有含碳产物的物质的量分数如下表。的转化率/%
各含碳产物占所有含碳产物的物质的量分数/%
其他
60.0
60.0
40.0
0
反应达到平衡后,的分压是kPa(气体的分压=气体总压×该气体的物质的量分数,结果保留三位有效数字,下同),从反应开始到平衡时,的反应速率是。
5. 在钢铁中添加有固定组成的铝铬合金颗粒,可以增强钢铁的耐腐蚀性、硬度和机械性能。(1)、钢铁中含有适量的碳元素。基态C原子中,核外存在对自旋相反的电子,电子占据最高能级的电子云轮廓图为形。(2)、实验测得FeCl3在蒸汽状态下实际存在形式为Fe2Cl6 , 其分子的球棍模型如图所示。
其中铁的配位数为;Fe2Cl6属于非极性分子的原因为。
(3)、某铝铬合金的晶胞结构如图(1)所示,晶胞俯视图如图(2)所示,则该铝铬合金的化学式可表示为;若NA表示阿伏加德罗常数的值,则该晶体的密度为 g∙cm-3 (用含a、c和的代数式表示)。 6. 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:
6. 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下: (1)、Se与S同族,基态硒原子价电子轨道表示式为 , 分子Ⅱ中碳原子的杂化轨道类型是 , 的沸点低于 , 其原因是。(2)、关于Ⅰ~Ⅲ三种反应物,下列说法正确的有____。A、Ⅰ中仅有σ键 B、Ⅰ中的Se-Se键为非极性共价键 C、Ⅱ易溶于水 D、的立体构型为正四面体(3)、我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
(1)、Se与S同族,基态硒原子价电子轨道表示式为 , 分子Ⅱ中碳原子的杂化轨道类型是 , 的沸点低于 , 其原因是。(2)、关于Ⅰ~Ⅲ三种反应物,下列说法正确的有____。A、Ⅰ中仅有σ键 B、Ⅰ中的Se-Se键为非极性共价键 C、Ⅱ易溶于水 D、的立体构型为正四面体(3)、我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
①化合物X的晶体类型是 , X的化学式为。
三、提高
-
7. 氮的氧化物、硫的氧化物是主要的大气污染物,对这些有害气体的治理及合理利用显得尤为重要。回答下列问题:(1)、I.某MOFs多孔材料孔径大小和形状恰好将N2O4 “固定”,能高效选择性吸附NO2。
废气中的NO2被吸附后,将材料泡入水中并通入氧气能全部转化为HNO3。原理示意图如下:

已知:
请从温度和压强两个角度分析利于NO2吸附的条件。
(2)、①当10 g材料吸附NO2到质量不再发生变化时,下列也能说明吸附反应已达到极限。A.颜色不再发生变化 B.n(NO2):n(N2O4)=2:1
C.2v正(NO2)=v逆(N2O4) D.混合气体的平均分子质量不再发生变化
②当吸附反应达到极限时,测得材料内温度为40℃,压强为10.0 MPa,混合气体平均相对分子质量为69,吸附反应的Kp=。
(3)、由N2O4转化生成HNO3的热化学反应方程式。(4)、Ⅱ.ClO2可对烟气中NO、SO2进行协同脱除。利用 ClO2气体脱硫脱硝的过程中涉及的部分反应及速率常数如下:
a.
b.
c.
d.
①反应d的历程如下图所示。该历程中最大活化能E正=kJ/mol。

②保持其他条件不变,随着的增加,SO2脱除效率的逐渐增加的原因是。
(5)、利用 ClO2溶液脱硫脱硝的过程中,ClO2质量浓度和溶液温度对NO脱除率的影响如下图所示,则最佳的质量浓度和溶液温度是。 8. 碳达峰、碳中和是现在需要继续完成的环保任务,CO2的综合利用成为热点研究对象,CO2作为碳源加氢是再生能源的有效方法,CO2加氢可以合成甲醇,Olah提出“甲醇经济"概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过CO2加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:
8. 碳达峰、碳中和是现在需要继续完成的环保任务,CO2的综合利用成为热点研究对象,CO2作为碳源加氢是再生能源的有效方法,CO2加氢可以合成甲醇,Olah提出“甲醇经济"概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过CO2加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:反应I:CO2(g)+H2(g)CO(g)+H2O(g) △H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H2=-41.1kJ•mol-1
(1)、①相关键能如表,则△H1= , 该反应的活化能Ea(正)Ea(逆)(填“大于”“小于”或“等于”)。化学键
H-H
CO
O-H
C=O
键能/(kJ•mol-1)
436
1071
464
803
②若K1、K2分别表示反应I、反应Ⅱ的平衡常数,则CO(g)+2H2(g)CH3OH(g)的平衡常数K=(用含K1、K2的代数式表示)。
(2)、在一固定容积的密闭容器中发生反应CO(g)+2H2(g)CH3OH(g),若要提高CO的转化率,则可以采取的措施是(填字母)。a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(3)、在催化剂作用下,发生上述反应I、Ⅱ,达平衡时CO2的转化率随温度和压强的变化如图,判断P1、P2、P3的大小关系: , 解释压强一定时,CO2的平衡转化率呈现如图变化的原因:。 (4)、某温度下,初始压强为P,向容积为2L的恒容密闭容器中充入2molCO2、3molH2发生反应I、Ⅱ,平衡时CO2的转化率是50%,体系内剩余1molH2 , 反应Ⅱ的平衡常数K=。9. 地球上的氮元素对动植物有重要的作用,氮元素形成的化合物是当前的研究热点。回答下列问题:(1)、在7℃时,向一个3L的恒容密闭容器中通入 , 发生反应: , 此时的平衡转化率为60%。
(4)、某温度下,初始压强为P,向容积为2L的恒容密闭容器中充入2molCO2、3molH2发生反应I、Ⅱ,平衡时CO2的转化率是50%,体系内剩余1molH2 , 反应Ⅱ的平衡常数K=。9. 地球上的氮元素对动植物有重要的作用,氮元素形成的化合物是当前的研究热点。回答下列问题:(1)、在7℃时,向一个3L的恒容密闭容器中通入 , 发生反应: , 此时的平衡转化率为60%。①科学上规定:在298.15K时,由最稳定的单质生成1mol某纯物质时的焓变,叫做该物质的标准摩尔生成焓();最稳定的单质的标准摩尔生成焓规定为零。已知:部分物质的标准摩尔生成焓数据如表(单位:):
物质
-46.1
0
90.3
-241.8
33.2
11.1
则上述该反应的=。
②下列说法错误的是(填标号)。
a.当混合气体的平均摩尔质量不变时,反应达到平衡
b.当时,反应达到平衡
c.反应过程中分离出 , 正反应速率增大
d.平衡时,若的转化率为60%,则a=5
(2)、把NO与按物质的量之比为2:1充入注射器中,然后迅速推压注射器的活塞至一个位置,看到气体颜色“先变深后变浅”。查文献得知:的反应速率非常快,在气体压缩的同时,反应立刻达到新的平衡,观察不到由旧平衡到新平衡的“过渡态”。如图是利用数字压强传感器记录的反应体系的压强随时间的变化曲线。结合以上信息,分析气体颜色“后变浅”的原因。 (3)、将固体置于一个2L的恒容真空密闭容器中,在一定温度下发生下列反应:① , ② , 经过10min反应达到平衡,此时 , 压强为120kPa。
(3)、将固体置于一个2L的恒容真空密闭容器中,在一定温度下发生下列反应:① , ② , 经过10min反应达到平衡,此时 , 压强为120kPa。①前10min内用表示的平均化学反应速率为。
②反应②的为(分压=总压×物质的量分数)。
③甲同学绘制出如图所示平衡后四种气体在平衡体系中的体积分数随温度的变化情况。

乙同学认为曲线b不可能表示氢气的体积分数,原因是
(4)、一种焦炭催化CO还原NO反应的反应历程如下,请补充完整(“*表示吸附态”)Ⅰ.NONO*
Ⅱ.2NO*ON-NO*
Ⅲ.
Ⅳ.ON-NO-CO*ON-N*+CO2;
Ⅴ.。
10. 落实“双碳”目标,发展绿色能源,首先是对氢能源的开发利用。利用甲烷制氢是当前研究的热点。涉及的反应如下:反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)、反应Ⅰ的活化能为 , 反应Ⅰ逆反应的活化能为。研究发现,以单一负载型催化反应Ⅰ时,反应Ⅰ的逆反应在催化剂表面存在两种活性中心,分别以“*”和“#”表示,在活性位“*”上发生吸附,在活性位“#”上被吸附的发生分解反应生成表面碳,表面碳再与结合生成 , 其催化反应机理的反应式如下:ⅰ. 快速平衡
ⅱ. 慢反应
ⅲ. 快反应
ⅳ. 快反应
反应ⅳ的反应式为;反应Ⅰ逆反应的决速步骤是(填反应序号)。
(2)、时,在某密闭容器中通入一定量的和 , 加入金属镍做催化剂,在一定温度下发生上述反应。①为提高的平衡转化率,除改变温度外,还可以采取的措施是。
②恒温恒容条件下,起始时和的浓度分别为和 , 达平衡时和的浓度分别为和。达平衡时,的浓度是 , 反应Ⅰ的平衡常数K是。(用含a、b、c、d的代数式表示)
③在该温度下,反应Ⅲ的标准平衡常数。[已知:分压=总压×该组分物质的量分数,对于反应 , , 其中 , 为各组分的平衡分压]
(3)、在某一给定进料比的情况下,温度、压强对平衡体系中物质的量分数的影响如下图:
压强由大到小的顺序为 , 体系温度未达到时,物质的量分数几乎为0的原因是。
11. 由与制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由人工合成淀粉(节选途径见图)中的重要反应之一已知:

反应②:
反应③:
(1)、反应①:的。(2)、反应①在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。
该反应历程中,使用催化剂条件下的决速步骤的反应方程式为:。
(3)、某研究小组将通入2L的刚性密闭容器内,只发生反应③,5分钟后容器压强变为原来的2.5倍,则这段时间内,;的转化率为:。(4)、某研究小组采用上述催化剂,向密闭容器中通入和 , 只发生反应①和反应②,在不同条件下达到平衡。其中,在下甲醇的物质的量分数随压强p的变化、在下随温度T的变化,如图所示。
①Y点对应的温度和压强为℃、kPa。
②M点时容器中为 , CO为 , 反应①的压强平衡常数(压强平衡常数是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
③图中M点的高于N点的原因是。
12. 我国含硫、天然气资源丰富,天然气脱硫和甲烷与硫化氢重整制氢具有重要的现实意义。回答下列问题:(1)、天然气脱硫工艺涉及如下反应:2H2S(g) +3O2(g)=2SO2(g)+2H2O(g) ΔH1=akJ ·mol-1
H2S(g)+ SO2(g)=S2(g)+ H2O(g) ΔH2=b kJ ·mol-1
2H2S(g)+O2(g)=2S(g) +2H2O(g) ΔH3=c kJ ·mol-1
则2S(g)=S2(g) △H4= kJ ·mol-1
(2)、甲烷与H2S重整制氢是一条全新的H2S转化与制氢技术路线。为了研究甲烷对H2S制氢的影响,理论计算表明,原料初始组成n(CH4):n(H2S)=1:2,在体系压强恒为1.0MPa,反应CH4(g)+2H2S(g)→CS2 (g)+4H2(g) △H达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
①图中表示H2S、H2变化的曲线分别是 、。反应达平衡的标志是(填标号)。
A.2v正(H2S)=4v逆(H2)
B.CH4的体积分数不再变化
C. 不再变化
D.混合气体的密度不再改变
②由图可知该反应的ΔH0(填“>”“<”或“=”),判断的理由是 。
③M点对应温度下,CH4的转化率为 ;950℃时该反应的Kp= ( MPa)2。
13. 我国科学家首次实现了二氧化碳到淀粉的人工合成,关键的一步是利用化学催化剂将高浓度还原成。催化加氢制的反应体系中,发生的主要反应如下。I.
II.
III.
回答下列问题:
(1)、已知上述反应I、II、III的平衡常数K与温度T的关系为: , , (x、y、z、A、B、C均为常数,A、C均大于零,B小于零)。则反应I的活化能(正)(逆),的数值范围是。(2)、反应I可能的反应历程如下图所示。已知:方框内包含微粒种类及数目、微粒的相对总能量;TS表示过渡态、*表示吸附在催化剂上的微粒。
则反应历程中决速步骤的反应方程式为。
(3)、在催化剂作用下,将和的混合气体充入一恒容密闭容器中进行反应,达平衡时,的转化率和容器中混合气体的平均相对分子质量随温度变化如图。
①250℃后,随温度升高,平衡时混合气体的平均相对分子质量几乎不变的原因是。
②T℃时,反应的初始压强为 , 平衡时甲醇的选择性(生成甲醇消耗的在总消耗量中占比)为 , 反应I的平衡常数(为以分压表示的平衡常数,分压=总压×物质的量的分数)。若再向密闭容器中通入和 , 使二者分压均增大 , 则的转化率(填“增大”“减小”或“不变”)。
四、培优
-
14. 氧化镓是一种新型超宽窄带半导体材料,由于自身的优异性能,在紫外探测、高频功率器件等领域吸引了越来越多的关注和研究,中国科技部将其列入“十四五研发计划”,让第四代半导体获得更广泛的关注。回答下列问题:(1)、基态原子最外层电子排布式为。(2)、①氧化镓的熔点为1740℃,氧化钙的熔点为2613℃,但有的离子晶体如(硝酸乙基铵)的熔点只有12℃。中N原子的杂化轨道类型是 , 离子的空间结构为 , 该物质中所含化学键类型:(填字母)。
A.金属键 B.离子键 C.共价键 D.范德华力 E.σ键
②第一电离能:AlMg(填“>”或“<”),其原因是。
(3)、锑化物是一种超窄禁带半导体材料,可用于红外探测其晶胞结构如图所示。若该晶体的密度为 , 设Ga和Sb的原子半径分别为和 , 则原子的空间占有率为(列出计算表达式,的摩尔质量为 , 阿伏加德罗常数的值为)。 15. 锌及其化合物在医药、科研等方面都有重要应用。回答下列问题:(1)、Zn元素位于元素周期表的区,基态Zn原子核外电子的空间运动状态有种。(2)、一种锌的配合物结构如图所示。
15. 锌及其化合物在医药、科研等方面都有重要应用。回答下列问题:(1)、Zn元素位于元素周期表的区,基态Zn原子核外电子的空间运动状态有种。(2)、一种锌的配合物结构如图所示。
中心离子提供空轨道的能级是;H、C、Cl、Br电负性由大到小的顺序为;C、N原子的杂化方式共有种。该配合物中H-N-H键角为109.5°,而NH3分子中H-N-H键角为107°,原因是。
(3)、ZnO立方晶胞结构如图所示
A点原子的分数坐标为(),则B点原子的分数坐标是。该晶胞中距离最近的两个Zn原子间的长度为anm,设NA为阿伏加德罗常数的值,则ZnO晶体的密度为g·cm-3(用代数式表示)。
16. 二氧化碳作为温室气体,其减排和再利用是世界气候问题的重大课题,而利用二氧化碳催化加氢制甲醇,就是减少温室气体二氧化碳的探索之一。回答下列问题:(1)、分子中存在个键。(2)、我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为固溶体。四方晶胞如图所示,离子在晶胞中的配位数是。 (3)、二氧化碳催化加氢制甲醇,涉及反应有:
(3)、二氧化碳催化加氢制甲醇,涉及反应有:反应I.
反应II.
反应III.
某压强下在体积固定的密闭容器中,按照投料发生反应I、II、III。平衡时,CO、在含碳产物中物质的量分数及转化率随温度的变化如图所示。

n曲线代表的物质为。
②在150~250℃范围内,转化率随温度升高而降低的原因是。
(4)、和反应制备的反应机理如图所示(带*的表示吸附在催化剂表面)
①研究表明,图中过程ii的活化能小但实际反应速率慢,是控速步骤,导致该步反应速率小的原因可能是。
A.对该反应有阻碍作用
B.其它物种的存在削弱了同一吸附位上H的吸附
C.温度变化导致活化能增大
D.温度变化导致平衡常数减小
②已知:图中HCOO为甲酸物种,结构是
 ,为甲氧基物种。从化学键视角将图中i与ii的过程可描述为。17. 二氧化碳催化加氢制甲醇: , 有利于减少温室气体二氧化碳,有利于实现“碳达峰,碳中和”。(1)、该反应在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。
,为甲氧基物种。从化学键视角将图中i与ii的过程可描述为。17. 二氧化碳催化加氢制甲醇: , 有利于减少温室气体二氧化碳,有利于实现“碳达峰,碳中和”。(1)、该反应在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。
该反应历程中,催化剂使决速步骤的活化能降低eV。
(2)、将2.0mol 和6.0mol 充入2L恒容密闭容器中,在不同催化剂作用下,相同时间内的转化率随温度变化如图所示。
①根据图中曲线分析,的催化剂催化效果最好(填“催化剂I”“催化剂II”“催化剂III”)
②下列措施有利于提高转化为的平衡转化率的有(填字母序号)
A.恒容条件下充入不参与反应的
B.选择催化效率更高的催化剂
C.在达到平衡后的体系中移出部分(g)
D.保持反应容器的体积不变,平衡时再充入2.0mol (g)和6.0mol (g)
③温度在之后,使用不同的催化剂,二氧化碳转化率相同的原因是。
(3)、若该反应通过如下步骤来实现:反应I:
反应II:
①。
②其他条件相同的情况下,测得的平衡转化率随温度变化关系如图所示,的平衡转化率随温度变化先下降后升高,温度高于T后的平衡转化率随温度升高而升高的原因为。

③一定条件下,向体积为2L的恒容密闭容器中通入2molCO2 和6molH2发生上述三个反应,达到平衡时,容器温度中CH3OH(g)为x mol,CO为y mol,反应I的平衡常数为(用含x、y的代数式表示)。
18. 以为原料可制备绿色能源甲醇,从而实现“碳达峰”“碳中和”的承诺。制备的反应为 。回答下列问题:(1)、的燃烧热 , 则完全燃烧生成5.6L(标准状况)和一定量液态水时放出的热量为kJ。(2)、在恒容密闭容器中充入一定量、的混合物,只发生上述反应,相同时间内测得容器中的浓度与反应温度(T)变化的关系如图1所示。
①该条件下,制备甲醇选取的最佳温度约为K。
②随着温度的升高,该密闭容器中甲醇浓度先增大后减小的原因是。
(3)、以、为原料合成 , 除发生上述反应外,还发生反应: 。两个反应的平衡常数的自然对数()随温度倒数()变化的关系如图2所示。
①图2中,表示反应 的是直线(填“甲”或“乙”)。
②计算1250K时,反应的平衡常数。
③在图3中补充完成 反应过程中的能量变化曲线。
 19. CO2(g)氢化制备化工原料CO(g)可有效缓解温室效应,此过程主要发生如下反应:
19. CO2(g)氢化制备化工原料CO(g)可有效缓解温室效应,此过程主要发生如下反应:反应Ⅰ:
反应Ⅱ:
(1)、 △H=kJ/mol。(2)、反应Ⅱ在化学热力学上进行的趋势很大,原因为 , 该反应易在(填“较高温度”或“较低温度”)下自发进行。(3)、在某恒压密闭容器中充入一定量CO2(g)和H2(g),使用不同的催化剂反应相同的时间,测得CO2(g)转化率、CH4(g)的选择性(CH4(g)的选择性=)与反应温度(T)的关系分别如图1和图2所示: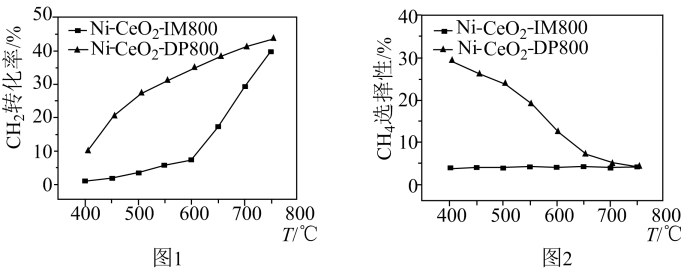
①图1中,选用Ni-CeO2-IM800催化剂时,CO2(g)的转化率在温度高于600℃后迅速增大,解释其原因为。
②600℃时,为提高CO(g)的产率,适宜选择的催化剂为(填“Ni-CeO2-IM800”或“Ni-CeO2-DP800”),解释其原因为。
(4)、在某刚性密闭容器中充入a mol CO2(g)和2a mol H2(g),发生反应Ⅰ和反应Ⅱ,测得CO2(g)的平衡转化率与压强(0.1 MPa、1 MPa、10 MPa)、温度(T)的关系如图3所示。
①图中表征压强为0.1 MPa的是(填“L1”“L2”或“L3”)。温度升高,三条曲线逐渐靠近的主要原因为。
②Q点时,测得CH4(g)的物质的量为b mol。则该温度下,反应Ⅰ的平衡常数K=(用含a、b的代数式表示)。
20. 丙烷脱氢技术是生产丙烯的主要方法之一,反应过程中伴有生成甲烷、乙烷等物质副反应,涉及反应如下:主反应:
I.
副反应:
II.
III.
IV.
回答下列问题:
(1)、反应II在1000K时能自发进行的理由:(用数据说明)。(2)、若仅考虑反应I和II,一定温度下,向1L恒容密闭容器中通入0.3mol丙烷,压强为0.375MPa.反应后测得组分的平衡压强(组分的物质的量分数总压):、①该温度下,反应I用物质的量浓度表示的平衡常数KC为。(保留3位有效数字)。
②平衡时丙烯的选择性为(C3H6的选择性=100%)。
(3)、对于反应I,下图是某课题组研究设计的一套丙烷连续催化脱氢装置:
①恒温下,将1mol丙烷以恒定的流速依次逐个通过三个相同装置,下图是丙烯的产率随着时间的变化阶段一、二、三的图像,其中阶段二图像是(填标号)。

②温度对丙烷脱氢反应的影响见下图:
项目
530℃
550℃
580℃
600℃
620℃
640℃
丙烷转化率%
17.67
27.85
32.54
46.35
53.19
57.28
丙烯选择性%
88.64
84.38
71.16
69.65
63.79
48.26
将1mol丙烷以恒定的流速通过不同温度相同反应的装置,主反应适宜的温度范围是。
(4)、平衡常数Kp与温度T(K)的关系曲线如图所示:下列说法正确的是____。 A、反应III对应的是图中的曲线③ B、若只发生反应IV,恒温恒容下充入原料气体,若压强不再改变则反应达到平衡 C、已知高温条件下,C—C键比C—H键更易断裂,制备丙烯应选择较低温度下的高效催化剂(5)、丙烯与HBr加成制备有机溴代物作为医药合成中间体。反应过程及能量变化师如图:
A、反应III对应的是图中的曲线③ B、若只发生反应IV,恒温恒容下充入原料气体,若压强不再改变则反应达到平衡 C、已知高温条件下,C—C键比C—H键更易断裂,制备丙烯应选择较低温度下的高效催化剂(5)、丙烯与HBr加成制备有机溴代物作为医药合成中间体。反应过程及能量变化师如图:
则:升高温度,反应I速率的增大程度(填“大于”、“等于”或“小于”)反应II速率的增大程度。
21. 利用CO2合成二甲醚有助于实现“碳中和”。CO2加氢合成二甲醚涉及的主要反应如下:I. CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g) ΔH1 = −49 kJ∙mol−1
II. 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2= −24.5 kJ∙mol−1
III. CO2(g)+H2(g) CO(g)+ H2O(g) ΔH3= +41.2 kJ∙mol−1
回答下列问题:
(1)、反应CO(g)+2H2(g) CH3OH(g)的ΔH= kJ∙mol−1。(2)、一定条件下,向恒容密闭容器中充入2 mol CH3OH(g),发生反应: 2CH3OH(g) CH3OCH3(g)+ H2O(g)达平衡时,CH3OH(g)转化率为50%。若反应前容器中含有0.5molH2O(g),则CH3OH(g)的平衡转化率为。(3)、理论计算表明,在260℃和适当催化剂条件下,向恒容密闭容器中充入1 molCO2(g)和3 mol H2(g),初始压强为p kPa,发生上述反应, 10 min时达平衡,生成0.05 molCO(g)和0.3 mol H2O (g),容器中压强为 p kPa。若反应速率用单位时间内气体分压变化表示,则0~10 min内υ(CH3OCH3)=kPa∙min−1; Kx是以物质的量分数表示的平衡常数,反应I平衡常数Kx= (列出计算式即可) 。(4)、起始投料比n(H2)/n(CO2)=4,压强为3.0 MPa的条件下发生上述反应,CO2平衡转化率和平衡时二甲醚的选择性随温度的变化如图所示。
已知:二甲醚选择性=表示平衡时CH3OCH3选择性的曲线是 (填“X”或“Y” );温度高于300℃时,曲线X的纵坐标随温度升高而增大的原因是。
(5)、为同时提高CO2的平衡转化率和平衡时CH3OCH3的选择性,应选择的反应条件为____(填标号)。A、低温、低压 B、低温、高压 C、高温、低压 D、高温、高压
-