【备考2024年】2023年高考化学新课标卷真题变式分层精准练第7题
试卷更新日期:2023-08-05 类型:二轮复习
一、原题
-
1. 向饱和溶液(有足量固体)中滴加氨水,发生反应和 , 与的关系如下图所示(其中M代表、、或)。
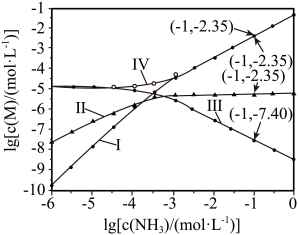
下列说法错误的是
A、曲线I可视为溶解度随浓度变化曲线 B、的溶度积常数 C、反应的平衡常数K的值为 D、时,溶液中二、基础
-
2. 已知某水稻田的土壤带负电,使用含氮量相同的下列化肥时,肥效最差的是( )A、 B、 C、 D、(尿素)3. 化学与社会、生活密切相关。下列说法错误的是( )A、锅炉水垢中含有的 , 可先用溶液处理,后用酸除去 B、在其他外界条件不变的情况下,汽车排气管中使用催化剂,可改变产生尾气的反应方向 C、疫苗一般应冷藏存放,以减小蛋白质变性的速率。 D、用作沉淀剂,除去水中的和4. 常温下,溶液。关于该溶液下列说法正确的是( )A、 B、 C、加水稀释,溶液增大 D、溶液可用玻璃试剂瓶盛装5. 将足量BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。各溶液中Ba2+的浓度最小的为( )A、40mL 水 B、10mL 0.2 mol·L-1Na2CO3溶液 C、50mL 0.01 mol·L-1氯化钡溶液 D、100mL 0.01 mol·L-1盐酸6. 已知,常温下CH3COOH和NH3·H2O的电离常数均为1.8×10-5。某小组进行如图三组实验且实验II、III中Mg(OH)2固体均溶解。下列说法正确的是( )
 A、I中现象说明NH3·H2O碱性强于Mg(OH)2 B、II中总反应为2H++Mg(OH)2=Mg2++2H2O C、实验II、III研究NH4+对Mg(OH)2溶解的作用原理 D、III中CH3COONH4浓度越小,越有利于沉淀的溶解7. 如图所示进行实验,下列分析不正确的是( )
A、I中现象说明NH3·H2O碱性强于Mg(OH)2 B、II中总反应为2H++Mg(OH)2=Mg2++2H2O C、实验II、III研究NH4+对Mg(OH)2溶解的作用原理 D、III中CH3COONH4浓度越小,越有利于沉淀的溶解7. 如图所示进行实验,下列分析不正确的是( ) A、实验②中白色沉淀变成黄色沉淀 B、该实验可说明溶度积Ksp(AgCl)>Ksp(AgI) C、反应后c(Ag+):①<② D、实验②中发生反应:AgCl+I-=AgI+Cl-
A、实验②中白色沉淀变成黄色沉淀 B、该实验可说明溶度积Ksp(AgCl)>Ksp(AgI) C、反应后c(Ag+):①<② D、实验②中发生反应:AgCl+I-=AgI+Cl-三、提高
-
8. 根据下列实验现象所得结论正确的是( )
选项
实验
现象
结论
A
向某溶液中滴加氯水,再滴加KSCN溶液
溶液变成红色
该该溶液中一定含有Fe2+
B
取少量铁与水蒸气反应后的固体,先加入稀盐酸再加KSCN溶液
溶液呈浅绿色
样品中没有+3价铁
C
向蛋白质溶液中加入CuCl2或饱和溶液
均有沉淀
蛋白质均发生了变性
D
向0.1mol/LMgSO4溶液缓慢滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液
白色沉淀逐渐变为蓝色沉淀
A、A B、B C、C D、D9. 室温下,通过实验研究亚硫酸盐的性质,已知Ka1(H2SO3)=1.54×10-2 , Ka2(H2SO3)=1.02×10-7实验
实验操作和现象
1
把SO2通入氨水,测得溶液pH=7
2
向0.1mol/LNa2SO3溶液中加入过量0.2mol/LCaCl2溶液,产生白色沉淀
3
向0.1mol/LNaHSO3溶液中滴入一定量NaOH溶液至pH=7
4
把少量氯气通入Na2SO3溶液中,测得pH变小
下列说法错误的是( )
A、实验1中,可算出=3.04 B、实验2反应静置后的上层清液中有c(Ca2+)·c(SO)=Ksp(CaSO3) C、实验3中:c(Na+)>2[c(HSO)+c(SO)+c(H2SO3)] D、实验4中反应的离子方程式为:H2O+Cl2+SO=SO+2H++2Cl-10. 已知草酸H2C2O4是二元弱酸。室温下向10 mL 0.01 mol·L-1 H2C2O4溶液中逐滴加入0.01 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( ) A、a点pH>2 B、b点表示的溶液中c(C2O42-)>c(H2C2O4) C、c点时加入NaOH溶液的体积为20mL D、d点存在c(Na+)+c(H+)=c(OH-)+2c(C2O42-)+c(HC2O4-)11. 下列方案设计、现象和结论都正确的是( )
A、a点pH>2 B、b点表示的溶液中c(C2O42-)>c(H2C2O4) C、c点时加入NaOH溶液的体积为20mL D、d点存在c(Na+)+c(H+)=c(OH-)+2c(C2O42-)+c(HC2O4-)11. 下列方案设计、现象和结论都正确的是( )目的
方案设计
现象和结论
A
验证NaCl、Na2SO4、NaOH混合溶液中的Cl-
取混合溶液于试管中,加入过量的Ba(NO3)2溶液充分反应,静置,向上清液中滴加AgNO3溶液
若上清液变浑浊。则混合溶液中含有Cl-
B
证明氧化性:Cl2>Fe3+>
向2支盛有FeCl2溶液的试管中分别加入氯水。向其中一支滴加KSCN溶液,向另一支依次滴加H2SO3溶液相BaCl2溶液
第一支试管中溶液变成血红色,
第二支试管中产生白色沉淀,则证明氧化性:Cl2>Fe3+>
C
证明CH4和Cl2光照下发生取代反应
将装有干燥Cl2的集气瓶倒扣在装有干燥CH4的集气瓶上,抽出玻璃片,置于光照条件下反应
观察到集气瓶内出现白雾,则证明CH4与Cl2发生了取代反应
D
探究AgCl和AgI的溶解度的大小
向2支盛有2mL相同浓度硝酸银溶液的试管中分别加入相同滴数同浓度的NaCl和NaI溶液
若一支试管中无明显现象,另一支试管中产生黄色沉淀,则AgCl溶解度大于AgI
A、A B、B C、C D、D12. 已知: 时, 的溶度积分别为 .下列说法正确的是( )A、可溶性硫化物可作为处理上述金属离子的沉淀剂 B、上述三种物质溶解度最小的是 C、在硫化铜悬浊液中滴加几滴 溶液,会生成 沉淀 D、向含 均为 的溶液中通入 气体,产生沉淀的顺序依次为13. 某工业废水中含有较高浓度的Mn2+及少量的Fe2+、Fe3+ , 欲回收锰元素并净化废水,实验小组设计了如图流程:
室温下,相关沉淀物的溶度积常数(Ksp)如表:
沉淀物
Fe(OH)2
Fe(OH)3
Mn(OH)2
MnS
Ksp
8×10-16
4×10-32
4×10-14
4×10-13
下列说法不正确的是( )
A、通空气氧化Fe2+ , 可降低NaOH的用量 B、Mn2+的3d能级处于半充满状态,故不易被氧化 C、试剂X可用Na2S,它比NaOH更有利于滤液检测合格 D、Mn(OH)2悬浊液中加Na2S,Mn(OH)2不可能转化为MnS14. 已知298K时下列物质的溶度积(单位略)CH3COOAg
AgCl
Ag2CrO4
Ag2S
Ksp
2.3×10-3
1.77×10-10
1.12×10-12
6.7×10-15
下列说法正确的是( )
A、等体积、浓度均为0.02 mol·L-1的CH3COONa和AgNO3溶液混合能产生沉淀 B、离子浓度均为0.01 mol·L-1的CrO42-和Cl-混合溶液中慢慢滴入AgNO3溶液时,CrO42-先沉淀 C、在CH3COOAg悬浊液中加入盐酸发生反应的离子方程式为:CH3COOAg+H++Cl-=CH3COOH+AgCl↓ D、298K时,上述四种饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)四、培优
-
15. 常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1 HA溶液和HB溶液,所得滴定曲线如图所示(其中HA的滴定曲线部分未画出)。下列说法错误的是( )
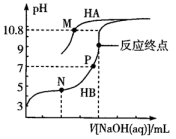
已知:M点溶液中c(A-)=c(HA)
A、=105.8 B、P点溶液中溶质为NaB和HB,由水电离出的c(H+)=1.0×10-7 mol·L-1 C、M点溶液中,2c(Na+)>c(HA)+c(A-) D、等体积等浓度的HB溶液和NaA溶液混合后的溶液中:c(OH-)<c(H+)16. 一定温度下,两种钙盐的沉淀溶解平衡曲线如图所示( , p表示以10为底的负对数)。已知:相同温度下,碳酸钙比硫酸钙更难溶。下列说法错误的是( ) A、该温度下, B、欲使反应正向进行,需满足 C、欲使c点移动到b点,可向c点的饱和溶液中加入适量固体 D、生活中,用饱和碳酸钠溶液浸泡硫酸钙后的滤液中一定存在17. 难溶盐可溶于盐酸,常温下,用调节浊液的 , 测得体系中或与的关系如图所示。下列说法错误的是
A、该温度下, B、欲使反应正向进行,需满足 C、欲使c点移动到b点,可向c点的饱和溶液中加入适量固体 D、生活中,用饱和碳酸钠溶液浸泡硫酸钙后的滤液中一定存在17. 难溶盐可溶于盐酸,常温下,用调节浊液的 , 测得体系中或与的关系如图所示。下列说法错误的是 A、M代表与的变化曲线 B、难溶盐的溶度积常数 C、Y点的溶液中存在 D、Z点的溶液中存在18. 室温下,某二元碱水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是( )
A、M代表与的变化曲线 B、难溶盐的溶度积常数 C、Y点的溶液中存在 D、Z点的溶液中存在18. 室温下,某二元碱水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是( ) A、由图可知一级、二级电离平衡常数 B、水溶液显碱性 C、等物质的量的和混合溶液中 D、在的水溶液中,19. 氢氧化锌的性质和氢氧化铝相似,25℃时,测得溶液中Zn2+、[Zn(OH)4]2-物质的量浓度的对数与溶液pH关系如图所示(已知Ksp[Mg(OH)2]=1.1×10-11 , Ksp[Cu(OH)2]=2.2×10-20)。下列说法正确的是( )
A、由图可知一级、二级电离平衡常数 B、水溶液显碱性 C、等物质的量的和混合溶液中 D、在的水溶液中,19. 氢氧化锌的性质和氢氧化铝相似,25℃时,测得溶液中Zn2+、[Zn(OH)4]2-物质的量浓度的对数与溶液pH关系如图所示(已知Ksp[Mg(OH)2]=1.1×10-11 , Ksp[Cu(OH)2]=2.2×10-20)。下列说法正确的是( ) A、25℃时,Ksp[Zn(OH)2]的数量级为10-17 B、分离Mg2+和Zn2+ , 要控制pH在8~11之间 C、可以用硫酸锌和氢氧化钠溶液反应制备氢氧化锌 D、加入CuO可以除去硫酸铜溶液中的Zn2+20. 常温下,分别用0.1000 mol·L-1 NaOH溶液滴定体积均为25.00 mI的磷酸、硫酸及草酸(H2C2O4)溶液,其滴定曲线如图:
A、25℃时,Ksp[Zn(OH)2]的数量级为10-17 B、分离Mg2+和Zn2+ , 要控制pH在8~11之间 C、可以用硫酸锌和氢氧化钠溶液反应制备氢氧化锌 D、加入CuO可以除去硫酸铜溶液中的Zn2+20. 常温下,分别用0.1000 mol·L-1 NaOH溶液滴定体积均为25.00 mI的磷酸、硫酸及草酸(H2C2O4)溶液,其滴定曲线如图:
已知:常温下,H3PO4的Ka1、Ka2、Ka3依次为7.1×10-3、6.2×10-8、4.5×10-13;H2C2O4的Ka1、Ka2依次为5.6×10-2、5.4×10-5 。
下列说法错误的是( )
A、曲线X、Y、Z分别代表磷酸、草酸、硫酸的pH变化 B、溶液pH=7时,消耗V(NaOH溶液):硫酸>草酸>磷酸 C、当V(NaOH溶液)= 25.00 mL时,草酸溶液中:c()>c( H2C2O4)>c() D、当V(NaOH溶液)=50.00 mL时,磷酸溶液中:c(OH-)-c(H+)= 2c(H3PO4)+ c()-c()21. 甘氨酸(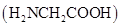 )在水溶液中存在如下两个平衡过程:
)在水溶液中存在如下两个平衡过程: ①

②

常温下用0.1
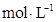 稀盐酸和0.1
稀盐酸和0.1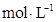
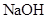 溶液调节100
溶液调节100 0.1
0.1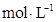 的甘氨酸溶液的pH值,测得溶液pH值与甘氨酸的存在形式分布分数(α)如下图所示。
的甘氨酸溶液的pH值,测得溶液pH值与甘氨酸的存在形式分布分数(α)如下图所示。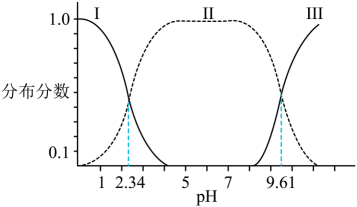
下列说法不正确的是
A、图中Ⅲ代表的是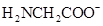 的分布分数曲线
B、甘氨酸溶液呈酸性
C、反应
的分布分数曲线
B、甘氨酸溶液呈酸性
C、反应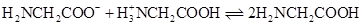 K , 则常温下
K , 则常温下 D、在
D、在 时,加入盐酸,
时,加入盐酸,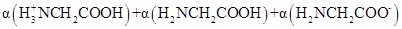 不变
不变
-