【备考2024年】2023年高考化学新课标卷真题变式分层精准练第4题
试卷更新日期:2023-08-05 类型:二轮复习
一、原题
-
1. 一种以和为电极、水溶液为电解质的电池,其示意图如下所示。放电时,可插入层间形成。下列说法错误的是
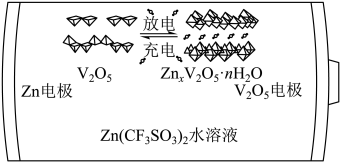 A、放电时为正极 B、放电时由负极向正极迁移 C、充电总反应: D、充电阳极反应:
A、放电时为正极 B、放电时由负极向正极迁移 C、充电总反应: D、充电阳极反应:二、基础
-
2. 下列装置中,可以实现反应的是( )A、
 B、
B、 C、
C、 D、
D、 3. 银锌纽扣电池的电池反应式为:。下列说法正确的是( )
3. 银锌纽扣电池的电池反应式为:。下列说法正确的是( ) A、锌是阴极,发生还原反应 B、电解液可以用硫酸代替 C、电池工作时,移向极 D、工作时转移电子 , 则消耗的质量为6.5g4. 下列有关电池的说法不正确的是( )A、手机中用的锂离子电池属于二次电池 B、甲醇燃料电池可把化学能转化为电能 C、铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 D、铅蓄电池使用一段时间后,电解质溶液的酸性减弱,导电能力下降5. 化学与生产、生活密切相关。下列说法错误的是 ( )A、氯碱工业是电解熔融的 , 在阳极能得到 B、电渗析法淡化海水利用了离子交换膜技术 C、晶体硅制得的光电池,能直接将光能转化为电能 D、煤经过气化和液化等化学变化可转化为清洁能源6. 如图为某电化学装置的一部分,电极材料为单一物质。已知两极反应式分别为a极:Cu2++2e-=Cu,b极:Mg-2e-=Mg2+。下列说法错误的是( )
A、锌是阴极,发生还原反应 B、电解液可以用硫酸代替 C、电池工作时,移向极 D、工作时转移电子 , 则消耗的质量为6.5g4. 下列有关电池的说法不正确的是( )A、手机中用的锂离子电池属于二次电池 B、甲醇燃料电池可把化学能转化为电能 C、铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 D、铅蓄电池使用一段时间后,电解质溶液的酸性减弱,导电能力下降5. 化学与生产、生活密切相关。下列说法错误的是 ( )A、氯碱工业是电解熔融的 , 在阳极能得到 B、电渗析法淡化海水利用了离子交换膜技术 C、晶体硅制得的光电池,能直接将光能转化为电能 D、煤经过气化和液化等化学变化可转化为清洁能源6. 如图为某电化学装置的一部分,电极材料为单一物质。已知两极反应式分别为a极:Cu2++2e-=Cu,b极:Mg-2e-=Mg2+。下列说法错误的是( ) A、a电极上发生还原反应 B、b电极材料是镁 C、该装置一定是原电池装置 D、电解质溶液中含有Cu2+7. 用惰性电极电解下列溶液,电解结束后加适量水,溶液能恢复至电解前状态的是( )A、 B、 C、 D、
A、a电极上发生还原反应 B、b电极材料是镁 C、该装置一定是原电池装置 D、电解质溶液中含有Cu2+7. 用惰性电极电解下列溶液,电解结束后加适量水,溶液能恢复至电解前状态的是( )A、 B、 C、 D、三、提高
-
8. 下列说法正确的是( )
 A、锌是正极,其质量不断减少 B、电子从锌片经导线流向铜片 C、该装置能将电能转化为化学能 D、铜电极发生反应为9. 关于如图装置所示的两个实验,说法正确的是( )
A、锌是正极,其质量不断减少 B、电子从锌片经导线流向铜片 C、该装置能将电能转化为化学能 D、铜电极发生反应为9. 关于如图装置所示的两个实验,说法正确的是( ) A、两个装置中都发生了化学变化,都由化学能转变为电能 B、装置②中电流方向是从Zn经导线流入Cu C、反应开始阶段,两个装置中均有氢气产生 D、电极反应式:阳极 2Cl—-2e-→Cl2↑正极 2H++2e-→H2↑10. 一种检测空气中甲醛(HCHO)含量的电化学传感器的工作原理如图所示。下列说法正确的是( )
A、两个装置中都发生了化学变化,都由化学能转变为电能 B、装置②中电流方向是从Zn经导线流入Cu C、反应开始阶段,两个装置中均有氢气产生 D、电极反应式:阳极 2Cl—-2e-→Cl2↑正极 2H++2e-→H2↑10. 一种检测空气中甲醛(HCHO)含量的电化学传感器的工作原理如图所示。下列说法正确的是( ) A、传感器工作时,工作电极电势高 B、工作时H+通过交换膜向工作电极附近移动 C、当导线中通过1.2×10-6mol电子,进入传感器的甲醛为9×10-3mg D、工作时,对电极区电解质溶液的pH减小11. 工业酸性废水中的可转化为除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为的起始浓度、电压、电解时间均相同),下列说法中,不正确的是( )
A、传感器工作时,工作电极电势高 B、工作时H+通过交换膜向工作电极附近移动 C、当导线中通过1.2×10-6mol电子,进入传感器的甲醛为9×10-3mg D、工作时,对电极区电解质溶液的pH减小11. 工业酸性废水中的可转化为除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为的起始浓度、电压、电解时间均相同),下列说法中,不正确的是( )实验
①
②
③
电解条件
阴、阳极均为石墨
阴、阳极均为石墨,滴加浓硫酸
阴极为石墨,阳极为铁,滴加浓硫酸
的去除率%
0.922
12.7
57.3
A、对比实验①②可知,降低pH可以提高的去除率 B、实验②中,在阴极放电的电极反应式是 C、实验③中,去除率提高的原因是阳极产物还原 D、实验③中,理论上电路中每通过电子,则有被还原12. 一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示(已知:KOH溶液中,Zn2+以Zn(OH)存在)。电池放电时,下列说法正确的是( ) A、MnO2电极为负极 B、I区的SO通过隔膜向Ⅱ区迁移 C、Ⅱ区的K+通过隔膜向Ⅲ区迁移 D、Zn电极反应:Zn+2e-+4OH-=Zn(OH)13. 某传统锌-空气二次电池的放充电原理如下图所示:
A、MnO2电极为负极 B、I区的SO通过隔膜向Ⅱ区迁移 C、Ⅱ区的K+通过隔膜向Ⅲ区迁移 D、Zn电极反应:Zn+2e-+4OH-=Zn(OH)13. 某传统锌-空气二次电池的放充电原理如下图所示:
下列叙述正确的是( )
A、放电时,电子从Zn电极流出经电解液向多孔铜电极移动 B、放电时,负极反应式仅为 C、充电时,Zn电极上“钝化”的ZnO不容易得电子 D、放电时,CO2做氧化剂被还原为K2CO3四、培优
-
14. Na2SO3溶液吸收含SO2的烟气得到NaHSO3溶液(pH=6),可用图装置将吸收液再生循环利用。已知电解过程中I室内气体逐渐减少,下列有关说法错误的是( )
 A、II室的HSO 移向I室 B、I室溶液的pH先减小后增大 C、III室的电极反应:2HSO +2e-=H2↑+2SO D、当电路通过1mol电子时,理论上III室得到11.2L气体(标准状况下)15. 用蒸馏法淡化海水消耗大量能源,成本很高。下图是一种较经济的电渗析法,从海水中得到淡水,下列说法正确的是( )
A、II室的HSO 移向I室 B、I室溶液的pH先减小后增大 C、III室的电极反应:2HSO +2e-=H2↑+2SO D、当电路通过1mol电子时,理论上III室得到11.2L气体(标准状况下)15. 用蒸馏法淡化海水消耗大量能源,成本很高。下图是一种较经济的电渗析法,从海水中得到淡水,下列说法正确的是( ) A、乙处电极接电源的负极 B、丙处出来的为淡水 C、甲处发生氧化反应 D、丁处出来的液体中加入硝酸银溶液,没有沉淀16. 工业上采用电化学法对煤进行脱硫处理,减少硫排放。脱硫原理:将 氧化成 , 再将煤中的含硫物质(主要是 )氧化为 和 , 。模拟装置如图所示。下列说法错误的是( )
A、乙处电极接电源的负极 B、丙处出来的为淡水 C、甲处发生氧化反应 D、丁处出来的液体中加入硝酸银溶液,没有沉淀16. 工业上采用电化学法对煤进行脱硫处理,减少硫排放。脱硫原理:将 氧化成 , 再将煤中的含硫物质(主要是 )氧化为 和 , 。模拟装置如图所示。下列说法错误的是( ) A、电极b为负极 B、石墨1上的反应式为 C、电子流向:b→石墨2,石墨1→a D、电路上转移1.5mol电子理论上处理17. 臭氧(O3)是一种强氧化剂,常用于消毒灭菌等,可用下图电解稀硫酸制得O3 , 下列说法正确的是( )
A、电极b为负极 B、石墨1上的反应式为 C、电子流向:b→石墨2,石墨1→a D、电路上转移1.5mol电子理论上处理17. 臭氧(O3)是一种强氧化剂,常用于消毒灭菌等,可用下图电解稀硫酸制得O3 , 下列说法正确的是( ) A、图中特制惰性电极C为阳极 B、电解一段时间后停止电解,溶液的pH显著变大 C、电解开始后电子的移动方向为:A→C→D→B D、电解一段时间后E、F处分别收集到xL和yL气体(标准状况),则F处收集的气体中O3所占的体积分数为 (忽略O3的分解)18. 已知Fe2+与H2O2溶液混合发生Fenton反应生成氧化性很强的羟基自由基(•OH),可将CN-氧化为低毒的CNO- , 实现废水处理的目的。三维电极电解-Fenton反应处理废水的原理如图所示,多孔焦炭电极将整个电解槽变成了许多微电解池。下列说法错误的是( )
A、图中特制惰性电极C为阳极 B、电解一段时间后停止电解,溶液的pH显著变大 C、电解开始后电子的移动方向为:A→C→D→B D、电解一段时间后E、F处分别收集到xL和yL气体(标准状况),则F处收集的气体中O3所占的体积分数为 (忽略O3的分解)18. 已知Fe2+与H2O2溶液混合发生Fenton反应生成氧化性很强的羟基自由基(•OH),可将CN-氧化为低毒的CNO- , 实现废水处理的目的。三维电极电解-Fenton反应处理废水的原理如图所示,多孔焦炭电极将整个电解槽变成了许多微电解池。下列说法错误的是( )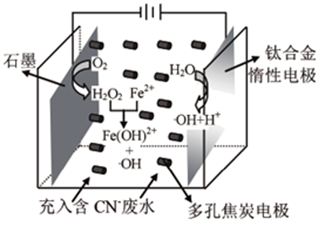 A、钛合金电极反应式为2H2O- 2e- =2H++2•OH B、阴极电极反应式为O2+ 2H++ 2e - = H2O2 C、焦炭电极表面能产生•OH使废水处理效率提高 D、Fe(OH)2+能在钛合金电极实现再生循环利用19. 电致变色器件可通过在膜材料内部Li+定向迁移,实现对器件的光透过率进行多级可逆性调节,其工作原理如图。已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明晶体,LiWO3和Fe4[Fe(CN)6]3均为蓝色晶体。下列有关说法错误的是( )
A、钛合金电极反应式为2H2O- 2e- =2H++2•OH B、阴极电极反应式为O2+ 2H++ 2e - = H2O2 C、焦炭电极表面能产生•OH使废水处理效率提高 D、Fe(OH)2+能在钛合金电极实现再生循环利用19. 电致变色器件可通过在膜材料内部Li+定向迁移,实现对器件的光透过率进行多级可逆性调节,其工作原理如图。已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明晶体,LiWO3和Fe4[Fe(CN)6]3均为蓝色晶体。下列有关说法错误的是( ) A、该装置可用于汽车的玻璃变色调光 B、切换电源正负极使得无色变为蓝色时,Li+通过离子导体层由电致变色层向离子储存层迁移 C、当a接外接电源负极时,膜的透射率降低,可以有效阻挡阳光 D、当b接外接电源负极时,离子储存层发生的反应为Fe4[Fe(CN)6]3+4Li++4e-=Li4Fe4[Fe(CN)6]3
A、该装置可用于汽车的玻璃变色调光 B、切换电源正负极使得无色变为蓝色时,Li+通过离子导体层由电致变色层向离子储存层迁移 C、当a接外接电源负极时,膜的透射率降低,可以有效阻挡阳光 D、当b接外接电源负极时,离子储存层发生的反应为Fe4[Fe(CN)6]3+4Li++4e-=Li4Fe4[Fe(CN)6]3
-