【备考2024年】高考化学全国乙卷真题变式分层精准练第8题
试卷更新日期:2023-08-04 类型:二轮复习
一、原题
-
1. 元素分析是有机化合物的表征手段之一。按下图实验装置(部分装置略)对有机化合物进行C、H元素分析。
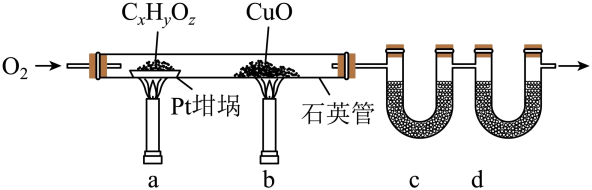
回答下列问题:
(1)、将装有样品的Pt坩埚和CuO放入石英管中,先 , 而后将已称重的U型管c、d与石英管连接,检查。依次点燃煤气灯 , 进行实验。(2)、O2的作用有。CuO的作用是(举1例,用化学方程式表示)。(3)、c和d中的试剂分别是、(填标号)。c和d中的试剂不可调换,理由是。A.CaCl2 B.NaCl C.碱石灰(CaO+NaOH) D.Na2SO3
(4)、Pt坩埚中样品CxHyOz反应完全后,应进行操作:。取下c和d管称重。(5)、若样品CxHyOz为0.0236g,实验结束后,c管增重0.0108g,d管增重0.0352g。质谱测得该有机物的相对分子量为118,其分子式为。二、基础
-
2. 为了检验糖尿病病人的尿液中是否含有葡萄糖,并判断病情轻重,应选用下列试剂中的(填序号) ,进行的操作是(填序号),并根据病情的轻重(任选一种),在结论中用不同数目的“+”号表示。
试剂
操作步骤
发生现象
结论
①氢氧化铜
A.将尿液与试剂混合振荡
甲.蓝色溶液
乙.生成绿色沉淀
②斐林试剂
B.将尿液与试剂混合后加热至沸腾
丙.生成黄绿色沉淀
③硫酸铜
C.将尿液与试剂混合后微热
丁.生成黄色沉淀
戊.生成砖红色沉淀
3. 为测定某有机物A的结构,进行如下实验。(1)、[分子式的确定]将7.4 g某有机物A置于氧气流中充分燃烧,实验测得:生成9.0 g H2O和17.6 g CO2。
则该物质的最简式是 , 据此 (填“能”或“不能”)确定该有机物的分子式。若前一空选填“能”,请在后面横线上写出其分子式;若前一空选填 “不能”,请在后面横线上写出理由:。
(2)、[结构式的确定]核磁共振氢谱显示该有机物A分子内有2种不同环境的氢原子,且A能与金属钠反应放出无色无味的气体,则A的结构简式为。
(3)、[性质实验]A在浓硫酸作用下加热至一定温度可生成不饱和烃B,请写出B发生加聚反应的反应方程式: 。
4. 可作火箭推进剂、炸药配合剂,制造烟火、人工防冰雹的药剂等,受热时先熔化再分解生成、、、(g)。为了验证高温分解的产物,小明同学设计了如图实验(已知加热条件下,Mg能与反应生成固体;过量的焦性没食子酸用于除去过量)。 (1)、仪器a的名称是 , 试剂X为(填写试剂名称)。(2)、证明分解产物中有的实验现象为。(3)、将尾气通入无色酚酞溶液中,溶液显红色,试用化学方程式解释其原因。(4)、小红同学认为该实验设计存在缺陷,不能说明分解产物中一定存在和。你认为该实验的不足之处是(写一点即可)。5. 浓硫酸与木炭在加热条件下可发生化学反应,为检验反应的产物,某同学设计了如下图所示的实验。
(1)、仪器a的名称是 , 试剂X为(填写试剂名称)。(2)、证明分解产物中有的实验现象为。(3)、将尾气通入无色酚酞溶液中,溶液显红色,试用化学方程式解释其原因。(4)、小红同学认为该实验设计存在缺陷,不能说明分解产物中一定存在和。你认为该实验的不足之处是(写一点即可)。5. 浓硫酸与木炭在加热条件下可发生化学反应,为检验反应的产物,某同学设计了如下图所示的实验。
回答下列问题:
(1)、浓硫酸和木炭粉在加热条件下发生反应的化学方程式为。(2)、装置A中的物质名称为 , 实验现象是 , 证明产物中有。(3)、装置B中的实验现象是 , 证明产物中有。(4)、装置C的作用是。(5)、装置D中实验现象是 , 反应的离子方程式为。6. 某课外活动小组用氯化铁制备Fe(OH)3胶体并检验其性质。(1)、现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备。①甲同学的操作是:取一小烧杯,加入40mL蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。
②乙向饱和FeCl3溶液直接加入过量的NaOH溶液。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟。
你认为哪位同学的制备方法正确:(填“甲”、“乙”或“丙”),发生的化学反应方程式是。
(2)、用最简单的方法判断丙中是否成功制备胶体,请写出相关的操作、现象和结论。(3)、Fe(OH)3胶体稳定存在的主要原因是。(4)、下列说法中属于Fe(OH)3胶体区别于FeCl3溶液的选项共有____个(填阿拉伯数字)。A、分散质Fe(OH)3胶体粒子的直径在1~100nm之间 B、Fe(OH)3胶体具有丁达尔效应 C、Fe(OH)3胶体是均一稳定的分散系 D、分散质Fe(OH)3胶体粒子能透过滤纸 E、Fe(OH)3胶体为红褐色透明状液体三、提高
-
7. 草酸亚铁晶体()是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究草酸亚铁晶体的热分解的产物,设计装置图如下。
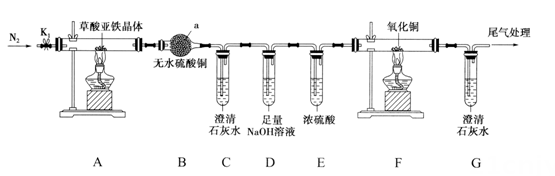 回答下列问题:(1)、装置a的名称是;检验产物是否有水时存在一定的缺陷,改进方法为。(2)、为了保证实验结果的准确性,同时防止加热时发生爆炸,实验前应进行的操作是。实验时夹紧 , 点燃A处与F处的酒精灯进行实验,当观察到(填现象)时,证明气体产物中含有CO。结束时,应首先熄灭(填“A”或“F”)处的酒精灯。(3)、工业制得的草酸亚铁晶体中常含有杂质,测定其纯度的流程如下图:
回答下列问题:(1)、装置a的名称是;检验产物是否有水时存在一定的缺陷,改进方法为。(2)、为了保证实验结果的准确性,同时防止加热时发生爆炸,实验前应进行的操作是。实验时夹紧 , 点燃A处与F处的酒精灯进行实验,当观察到(填现象)时,证明气体产物中含有CO。结束时,应首先熄灭(填“A”或“F”)处的酒精灯。(3)、工业制得的草酸亚铁晶体中常含有杂质,测定其纯度的流程如下图:
①准确量取25.00mL样品溶液的玻璃仪器是;第二次滴定达到终点的现象是。②以M为草酸亚铁晶体的相对质量,该样品的纯度为(用代数式表示),若配制溶液时被氧化,则测定结果将(填“偏高”“偏低”或“不变”)。
8. 硫酸铵常温下是无色结晶或白色颗粒,无气味,280℃以上分解,500℃以上彻底分解为气体。某实验小组设计如下实验验证硫酸铵的分解产物。试回答下列问题。 (1)、组装好装置加入药品前要进行的操作名称为。(2)、当图1与图2连接后,进行实验观察到无水硫酸铜变蓝色,证明硫酸铵分解产物有;还观察到品红溶液褪色,溶液紫色变浅不褪色,量气管中收集到一种气体单质(经检验该气体能使燃着的火柴熄灭),最后大试管中无固体剩余。写出溶液紫色变浅发生反应的离子方程式:。(3)、图1与图3连接后,可以观察到玻璃管中黑色固体变红色,玻璃管中反应的化学方程式为。(4)、如图给出的是不同温度下13.2g硫酸铵固体加热过程中的固体质量变化。写出290℃时硫酸铵分解的化学方程式。350℃时分解产物的化学式为 , 。
(1)、组装好装置加入药品前要进行的操作名称为。(2)、当图1与图2连接后,进行实验观察到无水硫酸铜变蓝色,证明硫酸铵分解产物有;还观察到品红溶液褪色,溶液紫色变浅不褪色,量气管中收集到一种气体单质(经检验该气体能使燃着的火柴熄灭),最后大试管中无固体剩余。写出溶液紫色变浅发生反应的离子方程式:。(3)、图1与图3连接后,可以观察到玻璃管中黑色固体变红色,玻璃管中反应的化学方程式为。(4)、如图给出的是不同温度下13.2g硫酸铵固体加热过程中的固体质量变化。写出290℃时硫酸铵分解的化学方程式。350℃时分解产物的化学式为 , 。 (5)、可以将氧化为和水蒸气,被还原为 , 各物质中的平均键能数据如下表,写出该反应的热化学方程式:。
(5)、可以将氧化为和水蒸气,被还原为 , 各物质中的平均键能数据如下表,写出该反应的热化学方程式:。化学键
N—H
O—H
键能
a
b
c
d
e
9. 碘酸钙是动物饲料的微量元素添加剂。Ca(IO3)2·6H2O制备步骤及装置如图:
已知:冷却结晶过程中得到的产物随温度不同会带不同数目的结晶水,如下表:
碘酸钙存在形式
Ca(IO3)2
Ca(IO3)2·H2O
Ca(IO3)2·6H2O
稳定温度
>57.5℃
32~57.5℃
<32℃
请回答:
 (1)、d烧杯内装的溶液是;作用是。(2)、步骤②碘反应完全的现象是。(3)、步骤⑥,洗涤后检验沉淀洗涤是否干净的方法是。(4)、下列说法不正确的是 。A、步骤②,水浴加热时,冷凝管下口出现固体未作处理会使产率偏低 B、步骤③,可加入K2CO3溶液调节pH值 C、步骤⑤,未使用冰水浴,会使产率偏高 D、步骤⑥,洗涤沉淀时可先用冰水洗涤,再用无水乙醇洗涤,后晾干(5)、产品纯度分析:已知2S2O32—+I2= S4O62—+2I— , 可采用如下方法测定产品中Ca(IO3)2·6H2O纯度。从下列选项中选择最佳操作并排序。准确称取0.600g样品→()→()→()→()→计算
(1)、d烧杯内装的溶液是;作用是。(2)、步骤②碘反应完全的现象是。(3)、步骤⑥,洗涤后检验沉淀洗涤是否干净的方法是。(4)、下列说法不正确的是 。A、步骤②,水浴加热时,冷凝管下口出现固体未作处理会使产率偏低 B、步骤③,可加入K2CO3溶液调节pH值 C、步骤⑤,未使用冰水浴,会使产率偏高 D、步骤⑥,洗涤沉淀时可先用冰水洗涤,再用无水乙醇洗涤,后晾干(5)、产品纯度分析:已知2S2O32—+I2= S4O62—+2I— , 可采用如下方法测定产品中Ca(IO3)2·6H2O纯度。从下列选项中选择最佳操作并排序。准确称取0.600g样品→()→()→()→()→计算
a、加水微热溶解试样,冷却后转移到250mL容量瓶,用水稀释至刻度,摇匀得试液
b、加入1:1高氯酸微热溶解试样,冷却后转移到250mL容量瓶,用水稀释至刻度,摇匀得试液
c、加50mL水,用浓度为0.100mol/L Na2S2O3标准溶液滴定至浅黄色
d、加50mL水,用浓度为0.100mol/L Na2S2O3标准溶液滴定至浅黄色,加入2mL淀粉溶液
e、准确量取50.00mL试液于250mL碘量瓶(如右图)中,加入3g碘化钾,盖上瓶塞,暗处反应3min
f、准确量取50.00mL试液于250mL锥形瓶中,加入3g碘化钾,暗处反应3min
g、继续用Na2S2O3标准溶液滴定,至浅黄色溶液变为无色,半分钟内不恢复,读数
h、继续用Na2S2O3标准溶液滴定,溶液蓝色消失,半分钟内不恢复,读数
10. [Co(en)2Cl2]Cl配合物存在顺反异构现象。制备trans-[Co(en)2Cl2]Cl的实验过程如下。
乙二胺缩写为en,实验过程含钴离子依次发生如下变化:[Co(H2O)6]2+→[Co(en)2(H2O)2]2+→[Co(en)2(H2O)2]3+→[Co(en)2Cl2]+
(1)、“溶解”过程Co(II)的配位数变化(填“发生”或“未发生”)。(2)、“氧化”过程Co(II)转化为Co(III)的离子方程式为。(3)、“氯化”过程使用浓盐酸而不用NaCl。浓盐酸的作用有。(4)、“蒸发浓缩”至停止加热。(5)、trans-[Co(en)2Cl2]Cl转化为cis-[Co(en)2Cl2]Cl的实验如下。

①由上述实验可知;生成trans-[Co(en)2Cl2]Cl是决速(填“热力学”或“动力学”,下同),生成cis-[Co(en)2Cl2]Cl是决速。
②设计实验将cis-[Co(en)2Cl2]Cl转化为trans-[Co(en)2Cl2]Cl。
11. 高锰酸钾是重要的氧化剂。回答下列问题:(1)、工业上常以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体:制备流程如图所示:
已知:锰酸钾(K2MnO4)是墨绿色晶体,水溶液呈深绿色(MnO的特征颜色),在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO会发生歧化反应生成MnO2和MnO。
①煅烧KOH和软锰矿的混合物应放在(填“瓷坩埚”“蒸发皿”或“铁坩埚’)中加热,发生反应的化学方程式为。
②设计实验方案验证K2MnO4歧化反应是否完全:。
(2)、常温下,实验室可用高锰酸钾与浓盐酸反应制备氯气。若已知反应后的溶液中含c(Mn2+)=0.1mol·L-1 , 向该溶液中滴加稀氢氧化钠溶液至Mn2+刚开始沉淀时,此时溶液的pH为{已知:Ksp[Mn(OH)2]=2.0×10-13;lg2≈0.3}。(3)、实验室常用硫酸酸化的草酸(H2C2O4 , 二元弱酸)溶液滴定KMnO4溶液(两者反应后氧化产物和还原产物分别为CO2、Mn2+),测定KMnO4溶液浓度。步骤如下:I.将一定量的高锰酸钾加入烧杯中,倒入蒸馏水使其溶解;
II.取0.100mol·L-1的草酸标准溶液25.00mL置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗VmLKMnO4溶液。
①高锰酸钾溶液盛放在(填“酸式”或“碱式”)滴定管中。
②滴定到达终点的现象是。
③该KMnO4溶液的物质的量浓度为mol·L-1。
12. 化学上常用燃烧法确定有机物的组成,下图装置是用燃烧法确定烃或烃的含氧衍生物分子式的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成(已知A中发生的反应为:2H2O2 2H2O+O2↑)
回答下列问题:
(1)、C装置(燃烧管)中CuO的作用是 。(2)、写出E装置中所盛放物质的名称 ,它的作用是 。(3)、若将B装置去掉会对实验结果造成什么影响? 。(4)、若准确称取1.20g样品(烃或烃的含氧衍生物)经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的实验式为 。(5)、从定量测定准确角度去考虑,该装置应怎样进一步改进 。四、培优
-
13. 二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。回答下列问题:(1)、ClO2的制备
已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4

①装置A中反应的化学方程式为。
②欲收集干燥的ClO2 , 选择图中的装置,其连接顺序为a→(按气流方向,用小写字母表示)。
③装置D的作用是。
(2)、ClO2与Na2S的反应将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入如图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物。

操作步骤
实验现象
结论
取少量Ⅰ中溶液于试管甲中,滴加品红溶液和盐酸。
品红始终不褪色
①无生成
另取少量Ⅰ中溶液于试管乙中,加入Ba(OH)2溶液,振荡。
②
有生成
③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙中,。
有白色沉淀生成
有Cl-生成
④ClO2与Na2S反应的离子方程式为。
14. 胡粉在中国古代曾用于药物和化妆品等行业,主要成分为2PbCO3·Pb(OH)2 , 常含有铁、银、铜、锡等金属的氧化物杂质。某同学设计了如下三个实验方案测定胡粉的纯度:(1)、方案Ⅰ.称取一定质量样品,加入足量的稀硫酸,测定实验前后装置丙的增重来确定胡粉的纯度。
写出装置乙中2PbCO3·Pb(OH)2发生反应的离子方程式(已知生成白色沉淀):。
(2)、仪器接口的连接顺序为(装置可以重复使用)a→ , 装置丁的作用是。(3)、实验前后均需要打开止水夹,通入一段时间空气,实验结束时通入空气的目的是。(4)、方案Ⅱ.实验原理:实验步骤:①称取胡粉样品a g;②将样品充分煅烧,冷却后称量;③重复操作②,测得剩余固体质量为b g。
下列仪器,方案Ⅱ不需要使用的是(用对应仪器的字母填空)。
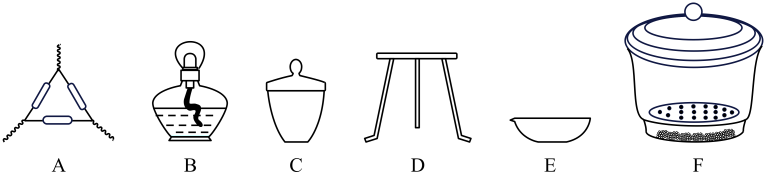 (5)、如何确定样品已完全分解?(6)、方案Ⅲ.实验步骤为:
(5)、如何确定样品已完全分解?(6)、方案Ⅲ.实验步骤为:①如图所示,连接好装置并检查气密性;
②向量气管中注入饱和NaHCO3溶液,并调节两侧液面相平,称取胡粉样品m g于锥形瓶中,打开分液漏斗活塞,将稀硫酸滴入锥形瓶中;
③待反应完全后, , 调节B与C中液面相平,平视读数,测得气体体积为VmL。
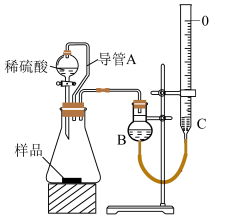
③中所留空的操作为 , 导管A的作用为。
15. 氮化铝广泛应用于集成电路生产领域,合成氮化铝的常见方法有:方法①:金属直接氮化法:2Al+N22AlN或者2Al+3NH32AlN+3H2;
方法②:氧化物还原氮化法:Al2O3+3C+N22AlN+3CO;
方法③:化学气相沉积法等。
(1)、I.某化学研究小组依据方法②氧化物还原氮化法,设计如图(图1)实验装置欲制取氮化铝。
仪器B的名称;装置中橡胶导管A的作用是。
(2)、上述实验装置存在两处不足:、。(3)、反应结束后,某同学按图2装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计)。已知:氮化铝和NaOH溶液反应生成NaAlO2和氨气。
①广口瓶中的试剂X最好选用(填写序号)。
a.汽油 b.酒精 c.植物油 d.CCl4
②下列措施或事实造成测定氮化铝样品的质量分数偏小的是。(填写序号)。
a.广口瓶中的液体没有装满 b.量筒的液面高于试剂X的液面
c.氨气没有全部进入广口瓶 d.撤走橡胶导管E,并将锥形瓶塞改为双孔塞
③若实验中称取氮化铝样品的质量为1.00g,测得氨气的体积336mL(标准状况),则样品中AlN的质量分数为。(保留3位有效数字)。
(4)、II.工业上依据方法③化学气相沉积法合成氯化铝,工艺流程如图:
已知:步骤II中发生的刷反应,AlCl3+nNH3AlCl3•nNH3
步骤III中发生的主反应化学方程式:。
16. 下列装置中有机化合物样品在电炉中充分燃烧,通过测定生成的和的质量,来确定有机化合物的分子式。
请回答下列问题:
(1)、写出装置A反应化学方程式。(2)、B装置中试剂X可选用。(3)、D装置中无水氯化钙的作用是;E装置中碱石灰的作用是。(4)、若实验中所取样品含C、H元素,可能含有O元素,准确称取0.44g样品,经充分反应后,D装置质量增加0.36g,E装置质量增加0.88g,已知该物质的相对分子质量为44,则该样品的分子式为。(5)、若该有机化合物的核磁共振氢谱如图所示,峰面积之比为。
则其结构简式为。
(6)、某同学认为E和空气相通,会影响测定结果的准确性,应在E后再增加一个装置,其主要目的是。17. 某化学小组为测定样品有机物G 的组成和结构,设计如图实验装置:
步骤:
① 搭建装置,检测装置的气密性;
② 准确称取4.3g样品有机物G放于电炉中;
③ 打开分液漏斗活塞,让A装置反应一段时间后;
④ 电炉通电,充分燃烧后产物只有水和二氧化碳,且被充分吸收;
⑤ 样品完全燃烧后,电炉断电,继续让A装置反应一段时间后再停止;
⑥ 测定装置D质量增加2.7g,U形管E质量增加8.8g;
⑦ 拿样品G去相关机构做质谱、红外光谱和核磁共振氢谱,谱图如下所示。

回答下列问题:
(1)、装双氧水的仪器的名称是 。装置F 中碱石灰的作用是。(2)、有机物G的分子式为 ,结构简式为 。(3)、有机物G的一些同分异构体能与碳酸氢钠溶液发生反应有气体生成,写出符合条件的G的所有同分异构体的结构简式(不考虑立体异构) 。(4)、下列说法正确的是____A、若删除装置A,改成通空气,对分子式测定实验结果无影响 B、装置B和D 都可以用装有碱石灰的装置E 替代 C、如果没有CuO,可能导致装置E所测物质的质量偏低 D、如果没有步骤⑤,导致测量的分子式中氧元素含量偏高18. 借助于李比希法、现代科学仪器及化学实验可以测定有机物的组成和结构。如图是确定有机物化学式常用的装置,其中管式炉可提供有机物燃烧所需的高温。 (1)、装置C中CuO的作用是。(2)、装置F的作用是。(3)、准确称取23.20g有机物M(只含C、H、O三种元素中的两种或三种),经充分燃烧后,D管质量增加7.20g,E管质量增加35.20g,则该有机物的最简式为。(4)、若利用质谱法测定M的相对分子质量,其质谱图如图(图1),则M的分子式为__。
(1)、装置C中CuO的作用是。(2)、装置F的作用是。(3)、准确称取23.20g有机物M(只含C、H、O三种元素中的两种或三种),经充分燃烧后,D管质量增加7.20g,E管质量增加35.20g,则该有机物的最简式为。(4)、若利用质谱法测定M的相对分子质量,其质谱图如图(图1),则M的分子式为__。
结合M的红外光谱图(图2)及核磁共振氢谱图(图3),综合分析得出M的结构简式为_。
 (5)、若实验测得相同状况下,M蒸汽的密度是H2密度的29倍,M能发生银镜反应,则M的结构简式为。
(5)、若实验测得相同状况下,M蒸汽的密度是H2密度的29倍,M能发生银镜反应,则M的结构简式为。
-