【备考2024年】高考化学全国乙卷真题变式分层精准练第7题
试卷更新日期:2023-08-04 类型:二轮复习
一、原题
-
1. 一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
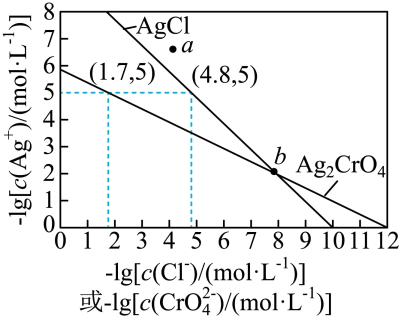
下列说法正确的是
A、a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀 B、b点时,c(Cl-)=c(CrO),Ksp(AgCl)=Ksp(Ag2CrO4) C、Ag2CrO4+2Cl-2AgCl+CrO的平衡常数K=107.9 D、向NaCl、Na2CrO4均为0.1mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀二、基础
-
2. 对下列事实解释的方程式错误的是( )A、向悬浊液中加入几滴溶液,沉淀变为红褐色: B、过氧化钠用作潜水艇中的供氧剂: C、收集的酸雨过一段时间后pH值会减小: D、工业上用情性电极电解饱和氯化钠溶液生产氢氧化钠:3. 化学与生活密切相关,下列说法错误的是( )A、热的纯碱溶液去污能力强 B、电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极保护法 C、可用溶液与溶液混合制取 D、锅炉水垢中含有 , 可先用饱和溶液浸泡,再用盐酸除去4. 化学与生产、生活密切相关。下列叙述不正确的是( )A、电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极法 B、人们洗发时使用的护发素具有调节头发pH使之达到适宜酸碱度的功能 C、工业上处理废水时,只能使用可溶性硫化物(如Na2S)除去废水中的Hg2+ D、蔗糖分子通过分子结构修饰,可得到三氯蔗糖,被认为是近乎完美的甜味剂,可供糖尿病患者食用5. 下列对应的方程式错误的是( )A、水的电离:2H2OH3O++OH- B、明矾净水的原理:Al3++3H2OAl(OH)3(胶体)+3H+ C、酸性氢氧燃料电池的正极反应:O2+4e-+2H2O=4OH- D、闪锌矿(ZnS)经CuSO4溶液淋滤后转化为更难溶的CuS:ZnS(s)+Cu2+(aq)CuS(s)+Zn2+(aq)6. 下列有关沉淀溶解平衡的说法中不正确的是( )A、的溶度积常数表达式 B、难溶于水,溶液中没有和SO C、升高温度,的溶解度增大 D、向悬浊液中加入固体,溶解的量减少7. 下列有关沉淀溶解平衡的说法中错误的是( )A、的溶度积常数表达式 B、难溶于水,溶液中没有和SO C、升高温度,的溶解度增大 D、向悬浊液中加入固体,溶解的量减少
三、提高
-
8. 在25 ℃时,FeS的Ksp=6.3×10-18 , CuS的Ksp=1.3×10-36 , ZnS的Ksp=1.3×10-24。下列有关说法中正确的是( )A、25 ℃时,CuS的溶解度大于ZnS的溶解度 B、25 ℃时,饱和CuS溶液中Cu2+的浓度为1.3×10-36mol·L-1 C、向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成 D、除去某溶液中的Cu2+ , 可以选用FeS作沉淀剂9. 下列实验操作所观察到的实验现象正确且能得出相应实验结论的是( )
选项
实验操作
实验现象
实验结论
A
用精密pH试纸分别测定相同浓度NaClO和溶液的pH值
pH:
酸性强弱:
B
向盛有2.0 mL甲苯的试管中加入3滴酸性溶液,用力振荡
紫色褪去
甲苯中含有碳碳双键,可被酸性溶液氧化
C
取5 mL 0.1 mol KI溶液于试管中,加入1 mL 0.1 mol•L溶液,充分反应后滴入5滴15% KSCN溶液
溶液变血红色
KI与的反应有一定限度
D
向盛有2 mL 0.1 mol/L NaOH溶液的试管中滴加4~5滴0.1 mol/L 溶液,再向其中滴加0.1 mol/L 溶液
先生成白色沉淀,后生成蓝色沉淀
说明
A、A B、B C、C D、D10. 下列实验方案中,不能达到实验目的的是( )选项
实验目的
实验方案
A
验证Cl2的氧化性强于I2
向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,可观察到溶液变成蓝色
B
配制100mL 1.0 mol·L-1CuSO4溶液
将25gCuSO4·5H2O溶于100mL蒸馏水中
C
比较水与乙醇中氢的活泼性
分别将少量钠投入到盛有水和乙醇的烧杯中
D
验证Cu(OH)2的溶解度小于Mg(OH)2
将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol·L-1CuSO4溶液,可观察到先有白色沉淀生成,后变为浅蓝色沉淀
A、A B、B C、C D、D11. 某科研工作者设计用工厂废渣(主要成分为ZnO,另含少量FeO、CuO、SiO2、MnO等)制取高纯ZnO的工艺流程图如图所示。已知常温下 , , 。下列说法错误的是( ) A、“酸浸”中,滤渣A主要成分为SiO2 B、“除锰”中,H2O2的作用是将Mn2+、Fe2+氧化 C、“除铁”中,ZnO与Fe3+发生反应生成Fe D、“除锰”后滤液中 , “除铁”操作中可以调节pH的范围是3<pH<5.5(当离子浓度时,表示该离子沉淀完全)12. 一定温度下,向足量的AgBr固体中加入100mL水,充分搅拌,慢慢加入NaCl固体,随着增大,溶液中的变化曲线如图所示。下列说法不正确的是( )
A、“酸浸”中,滤渣A主要成分为SiO2 B、“除锰”中,H2O2的作用是将Mn2+、Fe2+氧化 C、“除铁”中,ZnO与Fe3+发生反应生成Fe D、“除锰”后滤液中 , “除铁”操作中可以调节pH的范围是3<pH<5.5(当离子浓度时,表示该离子沉淀完全)12. 一定温度下,向足量的AgBr固体中加入100mL水,充分搅拌,慢慢加入NaCl固体,随着增大,溶液中的变化曲线如图所示。下列说法不正确的是( ) A、该温度下 B、从Y点到Z点发生的离子反应为 C、AgBr与AgCl在一定条件下可以相互转化 D、P点溶液中13. 向含MgCl2和CuCl2的溶液中逐滴加入0.1mol/L的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2=3V1 , 下列说法正确的是
A、该温度下 B、从Y点到Z点发生的离子反应为 C、AgBr与AgCl在一定条件下可以相互转化 D、P点溶液中13. 向含MgCl2和CuCl2的溶液中逐滴加入0.1mol/L的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2=3V1 , 下列说法正确的是 A、原溶液中MgCl2和CuCl2的物质的量浓度之比为3:1 B、该实验不能证明Cu(OH)2的Ksp比Mg(OH)2的Ksp小 C、若向Mg(OH)2悬浊液中滴入CuCl2溶液,一定会有Cu(OH)2生成 D、水的电离程度:A>B>C14. 常温下,用溶液分别滴定浓度均为的KCl、溶液,所得的沉淀溶解平衡图像如图所示(不考虑的水解)。下列叙述不正确的是( )
A、原溶液中MgCl2和CuCl2的物质的量浓度之比为3:1 B、该实验不能证明Cu(OH)2的Ksp比Mg(OH)2的Ksp小 C、若向Mg(OH)2悬浊液中滴入CuCl2溶液,一定会有Cu(OH)2生成 D、水的电离程度:A>B>C14. 常温下,用溶液分别滴定浓度均为的KCl、溶液,所得的沉淀溶解平衡图像如图所示(不考虑的水解)。下列叙述不正确的是( ) A、计算可得 B、a点表示的是AgCl的不饱和溶液 C、向的混合液中滴入溶液时,先生成AgCl沉淀 D、的平衡常数为
A、计算可得 B、a点表示的是AgCl的不饱和溶液 C、向的混合液中滴入溶液时,先生成AgCl沉淀 D、的平衡常数为四、培优
-
15. 由下列实验及现象不能推出相应结论的是( )
实验
现象
结论
A
向2 mL0.1 mol·L-1KI溶液中滴加5滴0.1 mol·L-1的FeCl3溶液,振荡,再滴加1~2滴KSCN溶液
溶液呈血红色
FeCl3与KI的反应是可逆反应
B
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C
加热乙醇与浓硫酸的混合溶液,将产生的气体通入少量酸性KMnO4溶液
溶液紫红色褪去
有乙烯生成
D
向5 mL0.1 mol·L-1ZnSO4溶液中加入1 mL0.1 mol·L-1 Na2S溶液,再滴加几滴CuSO4溶液
先有白色沉淀生成,后转化为黑色沉淀
Ksp(CuS)<Ksp(ZnS)
A、A B、B C、C D、D16. 下列实验探究方案不能达到探究目的的是( )选项
探究方案
探究目的
A
向两支盛有2mL 5% 溶液的试管中分别加入1 溶液和1 溶液,比较产生气泡速率
催化分解效果优于
B
两个封有和混合气体的圆底烧瓶分别浸泡在热水和冷水中,比较两个烧瓶里气体的颜色
温度升高,化学平衡向着吸热反应方向移动
C
用pH计测定不同浓度溶液的pH,记录并比较pH变化
随着溶液中减小,的电离程度增大
D
向盛有2mL 0.1 NaCl溶液的试管中滴加2滴0.1 溶液,振荡,再向其中滴加4滴0.1 KI溶液,观察沉淀及颜色变化
A、A B、B C、C D、D17. 工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)制备PbSO4晶体的工艺流程如图:
已知:PbCl2难溶于冷水,易溶于热水;PbCl2(s)+2Cl-(aq)(aq) △H>0;Ksp(PbSO4)=1. 08×10-8 , Ksp(PbCl2)=1.6×10-5。
下列说法正确的是( )
A、“浸取”时发生的主要离子反应为MnO2+PbS+4H++4Cl-=PbCl2+S+MnCl2+2H2O B、“沉淀转化”过程中,当溶液中c(Cl-)=0.1 mol/L时,c()=6.75×10-6 mol/L C、“沉降”时加入冰水使PbCl2(s)+2Cl-(aq) (aq)平衡向右移 D、“滤渣2”的主要成分是Fe(OH)218. 一定温度下,三种碳酸盐 (M: 、 、 )的沉淀溶解平衡曲线如图所示。下列说法错误的是( ) A、 的数量级为 B、向 的悬浊液中加入少量水,充分振荡后 不变 C、a点表示的溶液中, D、向浓度均为 的 、 、 的混合溶液中逐滴加入 溶液,最先生成 沉淀19. 某温度时,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法中,错误的是( )
A、 的数量级为 B、向 的悬浊液中加入少量水,充分振荡后 不变 C、a点表示的溶液中, D、向浓度均为 的 、 、 的混合溶液中逐滴加入 溶液,最先生成 沉淀19. 某温度时,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法中,错误的是( ) A、CaSO4在水中存在沉淀溶解平衡:CaSO4Ca2+(aq)+SO(aq) B、a点表示CaSO4在水中达到沉淀溶解平衡 C、b点有CaSO4沉淀生成 D、由图可知,含大量SO的溶液中不存在Ca2+20. 某温度下,、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断不正确的是( )
A、CaSO4在水中存在沉淀溶解平衡:CaSO4Ca2+(aq)+SO(aq) B、a点表示CaSO4在水中达到沉淀溶解平衡 C、b点有CaSO4沉淀生成 D、由图可知,含大量SO的溶液中不存在Ca2+20. 某温度下,、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断不正确的是( )
 A、 B、加适量固体可使溶液由点变到点 C、两点代表的溶液中与乘积相等 D、、分别在、两点代表的溶液中达到饱和21. 已知298K时,Ksp(NiS)=1.0×10-21 , Ksp(NiCO3)=1.0×10-7;p(Ni)=-lgc(Ni2+),p(B)=-lgc(S2-)或-lgc(CO)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是( )
A、 B、加适量固体可使溶液由点变到点 C、两点代表的溶液中与乘积相等 D、、分别在、两点代表的溶液中达到饱和21. 已知298K时,Ksp(NiS)=1.0×10-21 , Ksp(NiCO3)=1.0×10-7;p(Ni)=-lgc(Ni2+),p(B)=-lgc(S2-)或-lgc(CO)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是( ) A、常温下NiCO3的溶解度大于NiS的溶解度 B、向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动 C、对于曲线Ⅰ,在b点加热,b点向c点移动 D、P为3.5且对应的阴离子是CO
A、常温下NiCO3的溶解度大于NiS的溶解度 B、向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动 C、对于曲线Ⅰ,在b点加热,b点向c点移动 D、P为3.5且对应的阴离子是CO
-