【备考2024年】高考化学全国乙卷真题变式分层精准练第5题
试卷更新日期:2023-08-04 类型:二轮复习
一、原题
-
1. 一些化学试剂久置后易发生化学变化。下列化学方程式可正确解释相应变化的是
A
硫酸亚铁溶液出现棕黄色沉淀
B
硫化钠溶液出现浑浊颜色变深
C
溴水颜色逐渐褪去
D
胆矾表面出现白色粉末
A、A B、B C、C D、D二、基础
-
2. 下列反应方程式书写正确的是( )A、铁与足量氯气反应:2Fe+3Cl22FeCl3 B、金属Na在空气中加热:4Na+O2Na2O C、NaAlO2溶液中通入过量CO2:2AlO+CO2+3H2O=2Al(OH)3↓+CO D、Cl2与水反应:Cl2+H2O⇌2H++Cl-+ClO-3. “三效催化转化器”可将汽车尾气中的有毒气体转化为无污染的气体,下图为该反应的微观示意图(末配平),其中不同符号的球代表不同种原子。下列说法错误的是( )
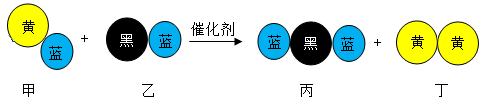 A、该反应属于氧化还原反应 B、配平后甲、乙、丙的化学计量数均为2 C、甲和丙中同种元素化合价不可能相同 D、丁物质一定是非金属单质4. 火药是中国古代四大发明之一,由硫磺、火硝和木炭粉均匀混合而成,点燃后可能发生的反应:S+2KNO3+3C=N2↑+3CO2↑+X(已配平),则物质X是( )A、K2S B、SO2 C、H2S D、SO35. 下列说法错误的是( )A、在化学反应过程中,发生物质变化的同时不一定发生能量变化 B、化学键的断裂与形成是化学反应中能量变化的主要原因 C、当生成物总能量高于反应物总能量时,反应吸热 D、化学反应能量变化多少与反应物和生成物的聚集状态有关6. 科学家结合实验和计算机模拟结果,研究了在贵重金属催化剂表面上的气态体系中,一个CO分子还原NO的能量变化与反应历程如图所示。下列说法错误的是( )
A、该反应属于氧化还原反应 B、配平后甲、乙、丙的化学计量数均为2 C、甲和丙中同种元素化合价不可能相同 D、丁物质一定是非金属单质4. 火药是中国古代四大发明之一,由硫磺、火硝和木炭粉均匀混合而成,点燃后可能发生的反应:S+2KNO3+3C=N2↑+3CO2↑+X(已配平),则物质X是( )A、K2S B、SO2 C、H2S D、SO35. 下列说法错误的是( )A、在化学反应过程中,发生物质变化的同时不一定发生能量变化 B、化学键的断裂与形成是化学反应中能量变化的主要原因 C、当生成物总能量高于反应物总能量时,反应吸热 D、化学反应能量变化多少与反应物和生成物的聚集状态有关6. 科学家结合实验和计算机模拟结果,研究了在贵重金属催化剂表面上的气态体系中,一个CO分子还原NO的能量变化与反应历程如图所示。下列说法错误的是( ) A、该反应的热化学方程式为2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=Ed-EakJ•mol-1 B、决定整个反应速率快慢的步骤是① C、反应过程中断裂与形成的化学键都包含极性键 D、改变催化剂不能使反应的焓变和熵变发生改变7. 下列说法中错误的是( )A、降低温度能使化学反应速率减小,主要原因是降低了反应物中活化分子的百分数 B、减小反应物浓度,可降低单位体积内活化分子的百分数,从而使有效碰撞次数减少 C、对反应来说,若增大压强,产生气泡的速率不变 D、催化剂可以改变化学反应速率,虽然在反应过程中参与反应,但反应前后的质量不变
A、该反应的热化学方程式为2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=Ed-EakJ•mol-1 B、决定整个反应速率快慢的步骤是① C、反应过程中断裂与形成的化学键都包含极性键 D、改变催化剂不能使反应的焓变和熵变发生改变7. 下列说法中错误的是( )A、降低温度能使化学反应速率减小,主要原因是降低了反应物中活化分子的百分数 B、减小反应物浓度,可降低单位体积内活化分子的百分数,从而使有效碰撞次数减少 C、对反应来说,若增大压强,产生气泡的速率不变 D、催化剂可以改变化学反应速率,虽然在反应过程中参与反应,但反应前后的质量不变三、提高
-
8. 氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程如图所示。

相关反应的热化学方程式为:
反应I: SO2(g)+I2(g)+ 2H2O(1)= 2HI(aq)+H2SO4(aq) △H1 = -213kJ·mol-1
反应II: H2SO4(aq)= SO2(g)+H2O(1)+ O2(g) △H2 = +327 kJ·mol-1
反应III: 2HI(aq)=H2(g)+I2(g) △H3 = +172 kJ· mol-1
下列说法错误的是( )
A、该过程实现了太阳能到化学能的转化 B、总反应的热化学方程式为2H2O(1)=2H2(g)+O2(g) △H = +286 kJ· mol-1 C、升高温度可使反应II、III的化学平衡常数均增大 D、该制氢方法生成1molH2(g)的反应热与直接电解水生成1 molH2(g)的反应热相等9. 2022年诺贝尔化学奖授予在“点击化学和生物正交化学”领域做出贡献的三位科学家。点击化学经典反应之一是一价铜[Cu]催化的叠氮化物-端炔烃环加成反应,反应机理示意如图:
下列说法正确的是
A、反应③过程中,不涉及极性键的断裂和形成 B、转化过程中N的杂化方式发生改变 C、该反应的总反应是取代反应,反应历程是离子反应历程 D、一价铜[Cu]催化剂能有效降低总反应的焓变,加快反应速率10. 一定温度下,在2L密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示,下列说法正确的是( ) A、a点时,v(A)=v(B) B、5min时,反应停止 C、反应的化学方程式为3A(g)⇌2B(g)+C(g) D、反应开始到5min,v(C)=0.04mol/(L·min)11. 二氧化氯(ClO2)是一种优良的消毒剂,可用氯酸钠和双氧水在酸性条件下制备,反应方程式为:NaClO3 + H2O2 + H2SO4 → ClO2↑ + Na2SO4 + H2O + O2↑(未配平)。下列说法不正确的是( )A、NaClO3做氧化剂,发生还原反应 B、将该方程式配平后H2O的化学计量数应为2 C、NaClO3与H2O2的化学计量系数之比为2 :1 D、反应过程中每生成2.24LO2转移0.2mol电子12. 已知:2H2O(l)=2H2(g)+O2(g) △H=+571.0 kJ/mol。以太阳能为热源分解Fe3O4 , 经热化学铁氧化合物循环分解水制H2的过程如下:
A、a点时,v(A)=v(B) B、5min时,反应停止 C、反应的化学方程式为3A(g)⇌2B(g)+C(g) D、反应开始到5min,v(C)=0.04mol/(L·min)11. 二氧化氯(ClO2)是一种优良的消毒剂,可用氯酸钠和双氧水在酸性条件下制备,反应方程式为:NaClO3 + H2O2 + H2SO4 → ClO2↑ + Na2SO4 + H2O + O2↑(未配平)。下列说法不正确的是( )A、NaClO3做氧化剂,发生还原反应 B、将该方程式配平后H2O的化学计量数应为2 C、NaClO3与H2O2的化学计量系数之比为2 :1 D、反应过程中每生成2.24LO2转移0.2mol电子12. 已知:2H2O(l)=2H2(g)+O2(g) △H=+571.0 kJ/mol。以太阳能为热源分解Fe3O4 , 经热化学铁氧化合物循环分解水制H2的过程如下:过程I:2Fe3O4(s)=6FeO(s)+O2(g) △H=+313.2 kJ/mol
过程II:……
下列说法不正确的是( )
 A、铁氧化物循环制H2的方法相较于电解法成本更低 B、过程II热化学方程式为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+128.9 kJ/mol C、过程I、II中能量转化的形式依次是:太阳能→化学能→热能 D、过程I中正反应的活化能大于逆反应的活化能13. 近年来,利用半导体光催化实现还原氮气制备氨气引起全世界极大关注。如图是在半导体光催化的作用下,N2被光催化材料捕获进而被还原实现“N2→NH3”的转化示意图。下列说法不正确的是( )
A、铁氧化物循环制H2的方法相较于电解法成本更低 B、过程II热化学方程式为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+128.9 kJ/mol C、过程I、II中能量转化的形式依次是:太阳能→化学能→热能 D、过程I中正反应的活化能大于逆反应的活化能13. 近年来,利用半导体光催化实现还原氮气制备氨气引起全世界极大关注。如图是在半导体光催化的作用下,N2被光催化材料捕获进而被还原实现“N2→NH3”的转化示意图。下列说法不正确的是( ) A、此方法属于人工固氮技术 B、该过程涉及到光能转化为化学能 C、该反应过程既有极性键的断裂和形成又有非极性键的断裂和形成 D、该反应的化学方程式是N2+3H22NH3
A、此方法属于人工固氮技术 B、该过程涉及到光能转化为化学能 C、该反应过程既有极性键的断裂和形成又有非极性键的断裂和形成 D、该反应的化学方程式是N2+3H22NH3四、培优
-
14. 下图是计算机模拟的在催化剂表面上水煤气变化的反应历程。吸附在催化剂表面的物种用“*”标注。
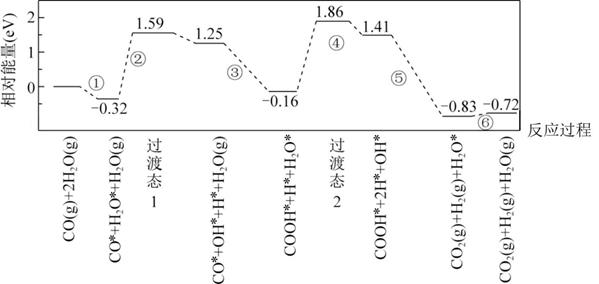
下列说法正确的是( )
A、①表示CO和H2O从催化剂表面脱离的过程 B、②和④中化学键变化相同,因此吸收的能量相同 C、由图可知CO(g)+H2O(g)=CO2(g)+H2(g)为吸热反应 D、本历程中的催化剂通过改变水煤气变化反应的焓变,来实现改变其反应速率15. 我国科学家实现了在铜催化剂条件下将DMF[(CH3)2NCHO]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示(已知NA表示阿伏加德罗常数的值)下列,说法错误的是( ) A、该历程中最大能垒的化学方程式为N(CH3)3+OH*+H*=N(CH3)3+H2O B、增大DMF的浓度能加快反应速率,并增大DMF的平衡转化率 C、该反应的热化学方程式为(CH3)2NCHO(g)+2H2(g)=N(CH3)3(g)+H2O(g) △H=-1.02NAeV·mol-1 D、该历程中最小能垒(活化能)为0.22eV16. 从铝土矿(主要成分Al2O3)中提取铝的工艺流程如图。下列说法不正确的是( )
A、该历程中最大能垒的化学方程式为N(CH3)3+OH*+H*=N(CH3)3+H2O B、增大DMF的浓度能加快反应速率,并增大DMF的平衡转化率 C、该反应的热化学方程式为(CH3)2NCHO(g)+2H2(g)=N(CH3)3(g)+H2O(g) △H=-1.02NAeV·mol-1 D、该历程中最小能垒(活化能)为0.22eV16. 从铝土矿(主要成分Al2O3)中提取铝的工艺流程如图。下列说法不正确的是( ) A、从NaAlO2→Al(OH)3→Al2O3的转化过程中涉及的反应均为非氧化还原反应 B、Al2O3与NaOH溶液反应的化学方程式:Al2O3+2NaOH=2NaAlO2+H2O C、NaAlO2生成Al(OH)3的离子方程式:AlO+CO2+2H2O=Al(OH)3↓+HCO D、电解熔融Al2O3阳极的电极反应式:Al3++3e-=Al17. 宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书写正确的是( )A、 放入水中: B、 通过灼热铁粉: C、铜丝插入热的浓硫酸中: D、 通入酸性 溶液中:18. 工业上常用NaClO碱性溶液吸收工业废气中的SO2 , 为了提高吸收效率,常用Ni2O3 , 作为催化剂,在反应过程中产生的四价镍和氧原子都具有极强的氧化能力,可加快对SO2的吸收,其中的催化过程如图所示:
A、从NaAlO2→Al(OH)3→Al2O3的转化过程中涉及的反应均为非氧化还原反应 B、Al2O3与NaOH溶液反应的化学方程式:Al2O3+2NaOH=2NaAlO2+H2O C、NaAlO2生成Al(OH)3的离子方程式:AlO+CO2+2H2O=Al(OH)3↓+HCO D、电解熔融Al2O3阳极的电极反应式:Al3++3e-=Al17. 宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书写正确的是( )A、 放入水中: B、 通过灼热铁粉: C、铜丝插入热的浓硫酸中: D、 通入酸性 溶液中:18. 工业上常用NaClO碱性溶液吸收工业废气中的SO2 , 为了提高吸收效率,常用Ni2O3 , 作为催化剂,在反应过程中产生的四价镍和氧原子都具有极强的氧化能力,可加快对SO2的吸收,其中的催化过程如图所示:
下列说法不正确的是( )
A、NaClO碱性溶液吸收SO2的离子方程式是:ClO-+SO2+2OH-=Cl-+SO42-+H2O B、过程1的离子方程式是:ClO-+Ni2O3=2NiO2+Cl- C、过程2中,氧化剂是ClO- , 还原剂是NiO2 D、此催化过程的离子反应为:ClO-Cl-+O19. 下列离子方程式书写正确的是( )A、NH4HCO3溶液与足量NaOH溶液反应:NH4++OH-=NH3•H2O B、澄清石灰水与过量NaHCO3溶液反应:HCO3-+Ca2++OH-=CaCO3+H2O C、氢氧化钠溶液通入过量SO2:OH-+SO2=HSO3- D、Cl2与FeBr2物质的量之比1:1的离子反应方程式:Cl2 +2 Fe2+= 2Fe3++ 2Cl-20. 下列方程式正确的是( )A、铁与稀硫酸反应的离子方程式:2Fe+6H+=2Fe3++3H2↑ B、乙烯与Br2的CCl4溶液反应的方程式:CH2=CH2 +Br2→CH2=CHBr+ HBr C、碳酸钠在水中的电离方程式:Na2CO3=2Na++CO32- D、二氧化硅溶于氢氧化钠溶液的离子方程式:SiO2+2Na++2OH-=Na2SiO3+H2O21. 烧杯中盛有100 mL1mol/L的NaHSO4溶液,向其中逐滴滴加1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法中正确的是( ) A、曲线d表示Na+的物质的量的变化 B、曲线c表示OH-的物质的量的变化 C、加入Ba(OH)2溶液50 mL反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O D、加入Ba(OH)2溶液大于50mL后,反应的离子方程式为:OH-+H+=H2O
A、曲线d表示Na+的物质的量的变化 B、曲线c表示OH-的物质的量的变化 C、加入Ba(OH)2溶液50 mL反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O D、加入Ba(OH)2溶液大于50mL后,反应的离子方程式为:OH-+H+=H2O
-