【备考2024年】高考化学全国乙卷真题变式分层精准练第1题
试卷更新日期:2023-08-04 类型:二轮复习
一、原题
-
1. 下列应用中涉及到氧化还原反应的是A、使用明矾对水进行净化 B、雪天道路上撒盐融雪 C、暖贴中的铁粉遇空气放热 D、荧光指示牌被照发光
二、基础
-
2. 某工厂的废渣中混有少量的锌粉和氧化铜(其它成分不跟酸反应),跟废盐酸接触形成污水。若向该污水中撒入铁粉,反应后铁粉有剩余,所得溶液中一定含有的金属离子是( )A、Fe2+、Cu2+ B、Cu2+、Zn2+ C、Zn2+、Fe2+ D、Zn2+、Fe3+3. 中国古代就有着璀璨的文明,其中很多都蕴含着丰富的化学知识,下列说法正确的是( )A、“每红铜六斤,入倭铅四斤,先后入罐熔化,冷定取出,即成黄铜”,黄铜比纯铜硬度更高 B、“古人以剂钢为刃,柔铁为茎干”,相比较铁,钢的韧性更好,这是因为钢的含碳量更高 C、“丹砂(注:HgS)烧之成水银,积变又还成丹砂”,煅烧丹砂过程中,汞元素被氧化 D、“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”,古人通常利用纯碱来洗衣服4. 下列我国古代的几种技术应用,不涉及氧化还原反应的是( )A、卤水煮盐 B、铁矿石炼铁 C、化丹(Pb3O4)为铅 D、火药爆炸5. 下列说法不正确的是( )A、利用丁达尔效应鉴别氢氧化铁胶体和氯化铁溶液 B、硫黄在过量空气中燃烧生成 C、在食品包装袋内放入铁系保鲜剂可以防止食品因氧化而变质 D、医疗上硫酸钡可用于肠胃X射线造影检查6. 黑火药爆炸时的反应为: , 该反应的还原剂是( )A、C B、 C、 D、S7. 暖宝宝是一种可供取暖的工具,其内主要成分为铁粉、活性炭、无机盐、水等。在使用时,去掉外袋,让内袋(无纺布袋)暴露在空气里产生热量,下列说法错误的是( )A、暖宝宝工作时,存在化学能转化为热能的过程 B、暖宝宝工作时,发生了氧化还原反应 C、暖宝宝工作时,铁粉、活性炭、无机盐、水构成了原电池 D、暖宝宝工作时,活性炭为原电池的负极8. 已知微粒还原性强弱顺序:I->Fe2+>Cl- , 则下列离子方程式不符合事实的是( )A、2Fe3++2I-→2Fe2++I2 B、Cl2+2I-→2Cl-+I2 C、2Fe2++I2→2Fe3++2I- D、Fe2++Cl2→2Fe3++2Cl-9. 下列过程不涉及氧化还原反应的是( )A、金属的冶炼 B、湿润的红色布条遇到氯气褪色 C、明矾净水 D、刻蚀印刷电路板
三、提高
-
10. 已知卤素单质的氧化性强弱为F2>Cl2>Br2>I2 , 排在前面的卤素单质可将排在后面的卤素从它的盐溶液中置换出来,如Cl2+2NaBr=2NaCl+Br2。下列说法或化学方程式不成立的是( )A、Cl2与I-在水溶液中不能大量共存 B、2NaF+I2=2NaI+F2 C、还原性:Cl-<Br-<I- D、少量Cl2通入到NaBr和NaI的混合溶液中,Cl2优先氧化I-11. 向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知:b-a=5,线段Ⅳ表示生成一种含氧酸(HIO3),且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法不正确的是( )
 A、线段Ⅱ表示Fe2+的变化情况 B、线段Ⅳ发生反应的离子方程式为:I2+5Cl2+12OH-=2IO3-+10Cl-+6H2O C、根据图象可计算a=6 D、原溶液中c(Fe2+)∶c(I-)∶c(Br-)=2∶1∶312. 向FeBr2和FeI2的混合溶液中通入氯气至恰好完全反应,Fe2+、I-、Br-的物质的量的变化如下图所示。下列说法正确的是( )
A、线段Ⅱ表示Fe2+的变化情况 B、线段Ⅳ发生反应的离子方程式为:I2+5Cl2+12OH-=2IO3-+10Cl-+6H2O C、根据图象可计算a=6 D、原溶液中c(Fe2+)∶c(I-)∶c(Br-)=2∶1∶312. 向FeBr2和FeI2的混合溶液中通入氯气至恰好完全反应,Fe2+、I-、Br-的物质的量的变化如下图所示。下列说法正确的是( ) A、还原性:I-<Fe2+<Br- B、通入氯气的总量为6mol C、若反应过程中滴入KSCN溶液,呈血红色,则amol<n(Cl2)≤bmol D、c点时加入过量NaOH溶液,反应后溶液中只含Na+、H+、Cl-、OH-四种离子13. 将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法不正确的是( )
A、还原性:I-<Fe2+<Br- B、通入氯气的总量为6mol C、若反应过程中滴入KSCN溶液,呈血红色,则amol<n(Cl2)≤bmol D、c点时加入过量NaOH溶液,反应后溶液中只含Na+、H+、Cl-、OH-四种离子13. 将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法不正确的是( ) A、回收S的总反应为2H2S+O2=2H2O+2S↓ B、在图示的转化中,化合价不变的元素只有铜 C、由图示的转化可得出氧化性的强弱顺序:O2>Fe3+>S D、提高混合气体中空气的比例,可使生成的硫单质中不含CuS14. 我国科学家被遴选为“全球青年化学家元素周期表硫元素代言人”。某小组同学利用反应:S+2H2SO4(浓)3SO2↑+2H2O,进行如图所示的含硫物质的转化实验(夹持装置略)。下列说法正确的是( )
A、回收S的总反应为2H2S+O2=2H2O+2S↓ B、在图示的转化中,化合价不变的元素只有铜 C、由图示的转化可得出氧化性的强弱顺序:O2>Fe3+>S D、提高混合气体中空气的比例,可使生成的硫单质中不含CuS14. 我国科学家被遴选为“全球青年化学家元素周期表硫元素代言人”。某小组同学利用反应:S+2H2SO4(浓)3SO2↑+2H2O,进行如图所示的含硫物质的转化实验(夹持装置略)。下列说法正确的是( ) A、试管①中,浓硫酸体现了强氧化性和脱水性 B、试管②中,溶液褪色,体现+4价硫元素的氧化性 C、试管③中,有淡黄色沉淀出现,体现-2价硫元素的还原性 D、烧杯中的反应为SO3+2NaOH=Na2SO4+H2O15. 下列反应属于氧化还原反应,且能量变化如图所示的是( )
A、试管①中,浓硫酸体现了强氧化性和脱水性 B、试管②中,溶液褪色,体现+4价硫元素的氧化性 C、试管③中,有淡黄色沉淀出现,体现-2价硫元素的还原性 D、烧杯中的反应为SO3+2NaOH=Na2SO4+H2O15. 下列反应属于氧化还原反应,且能量变化如图所示的是( ) A、甲烷在空气中燃烧的反应 B、灼热的木炭与CO2反应 C、锌粒和稀硫酸反应 D、Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
A、甲烷在空气中燃烧的反应 B、灼热的木炭与CO2反应 C、锌粒和稀硫酸反应 D、Ba(OH)2·8H2O晶体与NH4Cl晶体的反应四、培优
-
16. 工业烟气中含有较高浓度的氮氧化物,需进行脱除处理才能排放到大气中。下图是一种利用
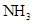 在催化剂条件下脱除
在催化剂条件下脱除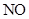 的原理示意图:
的原理示意图:

下列说法错误的是
A、步骤①中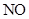 发生氧化反应
B、步骤②中包含有σ键和π键的断裂
C、若参与反应的
发生氧化反应
B、步骤②中包含有σ键和π键的断裂
C、若参与反应的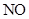 和
和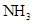 的物质的量相等,则该过程的总反应化学方程式为4NH3+4NO+O24N2+6H2O
D、当消耗a
的物质的量相等,则该过程的总反应化学方程式为4NH3+4NO+O24N2+6H2O
D、当消耗a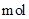
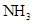 和b
和b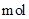
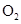 时,消耗
时,消耗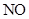 的物质的量为
的物质的量为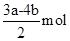 17. 工业上常用NaClO碱性溶液吸收工业废气中的SO2 , 为了提高吸收效率,常用Ni2O3 , 作为催化剂,在反应过程中产生的四价镍和氧原子都具有极强的氧化能力,可加快对SO2的吸收,其中的催化过程如图所示:
17. 工业上常用NaClO碱性溶液吸收工业废气中的SO2 , 为了提高吸收效率,常用Ni2O3 , 作为催化剂,在反应过程中产生的四价镍和氧原子都具有极强的氧化能力,可加快对SO2的吸收,其中的催化过程如图所示:
下列说法不正确的是( )
A、NaClO碱性溶液吸收SO2的离子方程式是:ClO-+SO2+2OH-=Cl-+SO42-+H2O B、过程1的离子方程式是:ClO-+Ni2O3=2NiO2+Cl- C、过程2中,氧化剂是ClO- , 还原剂是NiO2 D、此催化过程的离子反应为:ClO-Cl-+O18. X溶液中含有下表所示离子中的5种,且其离子个数相等。向X溶液中加入足量稀盐酸有气体生成,反应前后阴离子种类不变。下列叙述不正确的是(已知对应还原产物为NO)( )阳离子
Na+、Fe3+、Ba2+、Fe2+、Mg2+、Al3+
阴离子
OH-、、、、、Cl-
A、X溶液中含有3种阳离子、2种阴离子 B、原溶液中一定含有Mg2+ C、溶液中不可能含有和 D、生成气体的离子反应方程式为3Fe2+++4H+=3Fe3++NO↑+2H2O19. 已知:; , 向、的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。下列有关说法中,正确的是( ) A、还原性: B、原混合溶液中的物质的量为3mol C、当通入1mol时,溶液中发生的离子反应为 D、原溶液中:20. 从铝土矿(主要成分Al2O3)中提取铝的工艺流程如图。下列说法不正确的是( )
A、还原性: B、原混合溶液中的物质的量为3mol C、当通入1mol时,溶液中发生的离子反应为 D、原溶液中:20. 从铝土矿(主要成分Al2O3)中提取铝的工艺流程如图。下列说法不正确的是( ) A、从NaAlO2→Al(OH)3→Al2O3的转化过程中涉及的反应均为非氧化还原反应 B、Al2O3与NaOH溶液反应的化学方程式:Al2O3+2NaOH=2NaAlO2+H2O C、NaAlO2生成Al(OH)3的离子方程式:AlO+CO2+2H2O=Al(OH)3↓+HCO D、电解熔融Al2O3阳极的电极反应式:Al3++3e-=Al21. 将氧化铜和铜粉的混合物样品加入到体积为的和的混合溶液中,样品完全溶解,反应后溶液中只有三种阳离子,且三种阳离子物质的量之比为(不考虑盐的水解及溶液体积的变化)。若测得反应后溶液的 , 下列说法正确的是( )A、原溶液中为 B、向反应前的溶液中加入足量铁粉,产生的气体体积为 C、混合物中铜的质量分数为 D、将足量的通入灼热的混合物,反应结束后,混合物的质量减少了22. 碘是合成有机和无机碘化物的基本原料,卤水中提取碘具有成本低,资源丰富的优点。其中活性炭吸附法基本流程如图:
A、从NaAlO2→Al(OH)3→Al2O3的转化过程中涉及的反应均为非氧化还原反应 B、Al2O3与NaOH溶液反应的化学方程式:Al2O3+2NaOH=2NaAlO2+H2O C、NaAlO2生成Al(OH)3的离子方程式:AlO+CO2+2H2O=Al(OH)3↓+HCO D、电解熔融Al2O3阳极的电极反应式:Al3++3e-=Al21. 将氧化铜和铜粉的混合物样品加入到体积为的和的混合溶液中,样品完全溶解,反应后溶液中只有三种阳离子,且三种阳离子物质的量之比为(不考虑盐的水解及溶液体积的变化)。若测得反应后溶液的 , 下列说法正确的是( )A、原溶液中为 B、向反应前的溶液中加入足量铁粉,产生的气体体积为 C、混合物中铜的质量分数为 D、将足量的通入灼热的混合物,反应结束后,混合物的质量减少了22. 碘是合成有机和无机碘化物的基本原料,卤水中提取碘具有成本低,资源丰富的优点。其中活性炭吸附法基本流程如图:
下列说法错误的是( )
A、“氧化”步骤中发生的离子反应:2NO +H++2I-=2NO↑+I2+2H2O B、“吸附”、“吸收”、“酸化”的目的是富集碘元素 C、由于反应放热,为了防止产生的碘升华,“酸化”需要在低温或冰水浴条件下进行 D、“提取碘”可以用乙醇作萃取剂,振荡静止后分液23. “西门子”制硅法是以硅石(SiO2)为原料制备冶金级高纯硅,其工艺流程如图。下列叙述错误的是( )已知:SiHCl3室温下易挥发、易水解的无色液体。
 A、“酸浸”过程主要是酸溶除去粗硅中的氧化镁,可用稀盐酸代替稀硫酸 B、该生产工艺中可循环使用的物质只有H2 C、“氧化”、“分离”与“热解”的过程均需要在无水、无氧的条件下进行 D、“氧化”过程的化学方程式为Si+3HCl SiHCl3+H2
A、“酸浸”过程主要是酸溶除去粗硅中的氧化镁,可用稀盐酸代替稀硫酸 B、该生产工艺中可循环使用的物质只有H2 C、“氧化”、“分离”与“热解”的过程均需要在无水、无氧的条件下进行 D、“氧化”过程的化学方程式为Si+3HCl SiHCl3+H2
-