【备考2024年】高考化学全国甲卷真题变式分层精准练第7题
试卷更新日期:2023-08-04 类型:二轮复习
一、原题
-
1. 下图为和在水中达沉淀溶解平衡时的关系图(;可认为离子沉淀完全)。下列叙述正确的是
 A、由点可求得 B、时的溶解度为 C、浓度均为的和可通过分步沉淀进行分离 D、混合溶液中时二者不会同时沉淀
A、由点可求得 B、时的溶解度为 C、浓度均为的和可通过分步沉淀进行分离 D、混合溶液中时二者不会同时沉淀二、基础
-
2. 下列物质的水溶液呈酸性的是A、 B、 C、 D、3. 化学与生产、生活紧密相关,下列说法错误的是A、太阳能属于一次能源,也属于清洁能源 B、用热的碳酸钠溶液去油污,利用了盐类水解原理 C、自热饭盒中盛放氧化钙与水,二者混合时反应放出大量热 D、用硫化钠做沉淀剂除去废水中的铜离子,利用了氧化还原反应原理4. 化学与生产、生活密切相关。下列说法错误的是( )A、盐碱地(含较多的)不利于农作物生长,可施加适量石膏降低土壤碱性 B、人们洗头时使用的护发素,其主要功能是调节头发的pH使之达到适宜的酸碱度 C、为除去水垢中的 , 可直接加酸除去 D、黄铜(铜锌合金)制作的铜锣不易产生铜绿5. 化学与生活、生产密切相关。下列说法错误的是( )A、空气中的水蒸气被冷凝成饮用水的过程是放热反应 B、用可除去工业废水中的等重金属离子 C、研发新型催化剂,使工业合成氨在温和条件下发生,可降低能耗 D、回收利用废旧的铅酸蓄电池,既可以减少环境污染,又可以节约资源6. 下列物质属于盐且水溶液呈酸性是A、 B、 C、 D、7. 一定温度下,满足下列条件的溶液一定呈酸性的是 ( )A、pH=6 的水溶液 B、加酚酞后显红色的溶液 C、c(H+)>c(OH-)的水溶液 D、能与金属 Al 反应放出 H2 的溶液8. 下列有关明矾的说法不正确的是( )A、Al元素位于周期表的p区 B、明矾晶体不能导电 C、明矾溶液呈酸性 D、明矾能使蛋白质变性
三、提高
-
9. 回收利用工业废气中的和 , 实验原理示意图如下。

下列说法不正确的是( )
A、废气中排放到大气中会形成酸雨 B、装置中溶液显碱性的原因是的水解程度大于的电离程度 C、装置中溶液的作用是吸收废气中的和 D、装置中的总反应为10. 测定0.1 溶液升温过程中的pH(不考虑水的蒸发),数据如下。温度/℃
20
40
60
80
pH
11.80
11.68
11.54
11.42
下列说法正确的是( )
A、温度升高,溶液中降低 B、温度升高时溶液pH降低,原因是水解生成少量 C、溶液pH的变化是改变与水解平衡移动共同作用的结果 D、溶液中始终等于0.111. 证据推理是学习化学的重要方法,下列证据与推理的关系正确的是( )证据
推理
A
室温下,用pH试纸分别测定浓度均为0.1mol·L-1的Na2SO3和NaHSO3两种溶液的pH,其中Na2SO3溶液的pH更大
HSO3结合H+的能力比的强
B
在Na2S溶液中滴加新制氯水,产生浅黄色沉淀
Cl2的氧化性强于S
C
向1mL2 mol·L-1AgNO3溶液中依次加入2滴浓度均为0.1mol·L-1的NaCl溶液和Kl溶液,先出现白色沉淀,后出现黄色沉淀
Kap(AgCl)>Kap(AgI)
D
向淀粉溶液中加入稀硫酸,水浴加热一段时间后,再加入碘水,溶液变蓝
淀粉未发生水解
A、A B、B C、C D、D12. 室温下,用浓度为0.1000mol·L-1的盐酸分别逐滴加入到20.00mL0.1000mol·L-1的两种一元碱溶液中,曲线Ⅰ和Ⅱ分别为滴定MOH和NOH这两种碱时pH随盐酸溶液体积的变化图。下列说法不正确的是( ) A、MOH为强碱,NOH为弱碱,恰好中和时两溶液消耗的盐酸体积相同 B、Ⅱ表示的是滴定NOH的曲线,NOH的电离度是1%,当V(HCl)=10mL时,c(N+)>c(Cl-)>c(NOH)>c(OH-)>c(H+) C、滴定MOH溶液时,若V(HCl)>20mL,则一定有:c(Cl-)>c(M+)>c(H+)>c(OH-) D、假设NOH为氨水,当滴定氨水消耗V(HCl)=20mL时,c(Cl-)=c(NH)+c(NH3·H2O)+c(NH3)13. 甘氨酸盐酸盐(HOOCCH2NH3Cl)的水溶液呈酸性,溶液中存在以下平衡:
A、MOH为强碱,NOH为弱碱,恰好中和时两溶液消耗的盐酸体积相同 B、Ⅱ表示的是滴定NOH的曲线,NOH的电离度是1%,当V(HCl)=10mL时,c(N+)>c(Cl-)>c(NOH)>c(OH-)>c(H+) C、滴定MOH溶液时,若V(HCl)>20mL,则一定有:c(Cl-)>c(M+)>c(H+)>c(OH-) D、假设NOH为氨水,当滴定氨水消耗V(HCl)=20mL时,c(Cl-)=c(NH)+c(NH3·H2O)+c(NH3)13. 甘氨酸盐酸盐(HOOCCH2NH3Cl)的水溶液呈酸性,溶液中存在以下平衡:HOOCCH2NH-OOCCH2NH+H+ K1
-OOCCH2NH-OOCCH2NH2+H+ K2
常温时,向10mL一定浓度的HOOCCH2NH3Cl的水溶液中滴入同浓度的NaOH溶液。混合溶液pH随加入NaOH溶液体积的变化如图所示。下列说法错误的是( )
 A、Q→X过程中:逐渐减小 B、X点的溶液中:c(-OOCCH2NH2)>c(HOOCCH2NH) C、P点的溶液中:c(HOOCCH2NH)+c(H+)=c(-OOCCH2NH2)+c(OH-) D、当V(NaOH)=20mL时,混合溶液中的溶质主要为NaOOCCH2NH2和NaCl
A、Q→X过程中:逐渐减小 B、X点的溶液中:c(-OOCCH2NH2)>c(HOOCCH2NH) C、P点的溶液中:c(HOOCCH2NH)+c(H+)=c(-OOCCH2NH2)+c(OH-) D、当V(NaOH)=20mL时,混合溶液中的溶质主要为NaOOCCH2NH2和NaCl四、培优
-
14. 室温下,用过量溶液浸泡粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。(当溶液中剩余的离子浓度小于时,化学上通常认为生成沉淀的反应已经完全进行了。已知: , ),下列说法正确的是A、浸泡后未完全转化为 B、溶液中存在: C、反应正向进行,需满足 D、过滤后所得清液中一定存在:且15. 处理某铜冶金污水(含)的部分流程如下:
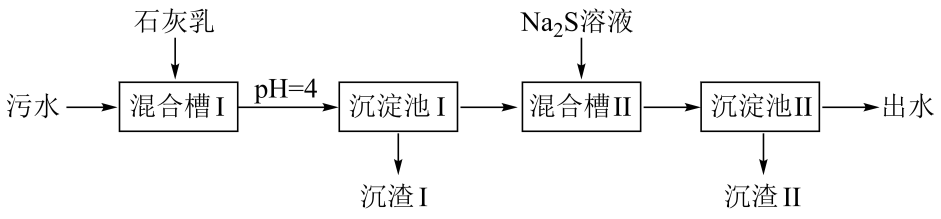
已知:①溶液中金属离子开始沉淀和完全沉淀的如下表所示:
物质
开始沉淀
1.9
4.2
6.2
3.5
完全沉淀
3.2
6.7
8.2
4.6
②。
下列说法错误的是
A、“沉渣Ⅰ”中含有和 B、溶液呈碱性,其主要原因是 C、“沉淀池Ⅱ”中,当和完全沉淀时,溶液中 D、“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水16. 向饱和溶液(有足量固体)中滴加氨水,发生反应和 , 与的关系如下图所示(其中M代表、、或)。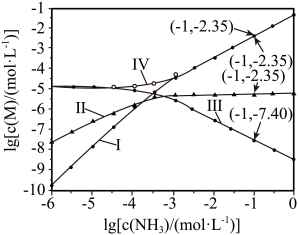
下列说法错误的是
A、曲线I可视为溶解度随浓度变化曲线 B、的溶度积常数 C、反应的平衡常数K的值为 D、时,溶液中17. 利用平衡移动原理,分析一定温度下在不同的体系中的可能产物。已知:图中曲线表示体系中各含碳粒子的物质的量分数与的关系。
图中曲线Ⅰ的离子浓度关系符合;曲线Ⅱ的离子浓度关系符合注:起始 , 不同下由图得到。
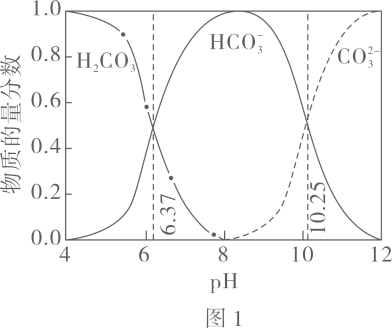
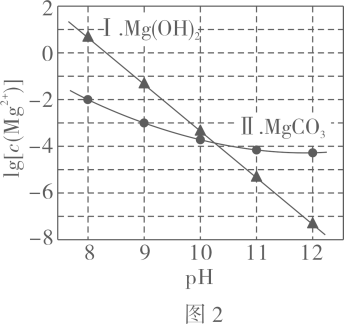
下列说法不正确的是( )
A、由图 , B、由图 , 初始状态 , 无沉淀生成 C、由图 , 初始状态 , 平衡后溶液中存在 D、由图和图 , 初始状态、 , 发生反应:18. 秦俑彩绘中的铅白(PbCO3)和黄金雨中黄色的PbI2都是难溶的铅盐。室温下,PbCO3和PbI2达到溶解平衡时,-lgc(Pb2+)与-lgc()或-lgc(I-)的关系如图,下列说法错误的是( ) A、L2曲线代表PbCO3 , 其Ksp(PbCO3) =1.0×10-13.1 B、p点对应的PbI2溶液中,滴入0.1 mol·L-1 Pb(NO3)2溶液,将析出固体PbI2 C、反应PbI2(s)+(aq)PbCO3(s)+2I-(aq)的平衡常数K=105.1 D、向等浓度的Na2CO3与NaI的混合溶液中滴入Pb(NO3)2 溶液先产生黄色沉淀19. 为某邻苯二酚类配体,其 , 。常温下构建溶液体系,其中 , 。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数 , 已知 , 。下列说法正确的是
A、L2曲线代表PbCO3 , 其Ksp(PbCO3) =1.0×10-13.1 B、p点对应的PbI2溶液中,滴入0.1 mol·L-1 Pb(NO3)2溶液,将析出固体PbI2 C、反应PbI2(s)+(aq)PbCO3(s)+2I-(aq)的平衡常数K=105.1 D、向等浓度的Na2CO3与NaI的混合溶液中滴入Pb(NO3)2 溶液先产生黄色沉淀19. 为某邻苯二酚类配体,其 , 。常温下构建溶液体系,其中 , 。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数 , 已知 , 。下列说法正确的是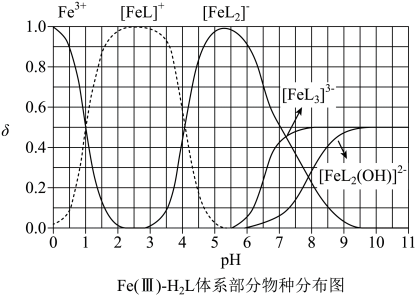 A、当时,体系中 B、pH在9.5~10.5之间,含L的物种主要为 C、的平衡常数的lgK约为14 D、当时,参与配位的
A、当时,体系中 B、pH在9.5~10.5之间,含L的物种主要为 C、的平衡常数的lgK约为14 D、当时,参与配位的
-