吉林省两地六县重点中学2022-2023学年高一下学期7月期末考试化学试题
试卷更新日期:2023-08-04 类型:期末考试
一、选择题:本题共20小题,共50分。第1~10小题,每小题2分;第11~20小题,每小题3分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 2022年里,我国的科技发展成果举世瞩目。下列说法错误的是( )A、2022年冬奥会中,国家速滑馆“冰丝带”采用了跨临界制冰,比氟利昂制冰更环保 B、2022年我国风电光伏发电量突破一万亿千瓦时,光伏发电更符合绿色发展理念 C、2022年我国嫦娥五号返回器携带月球样品成功着陆,返回器外壳的主要材料为复合铝合金 D、2022年中国空间站全面建成,空间站所使用的太阳能电池板的主要成分为2. 化学物质在体育领域有广泛应用。下列说法错误的是( )A、涤纶可作为制作运动服的材料 B、纤维素可以为运动员提供能量 C、木糖醇可用作运动饮料的甜味剂 D、复方氯乙烷气雾剂可用于运动中急性损伤镇痛3. 化学在人类社会的可持续发展中发挥着重要作用。下列说法错误的是( )A、工业上通常以海水提取粗食盐后的母液为原料制取溴 B、随着科技的发展,以生物质燃料替代化石燃料将是一条可持续发展途径 C、包装上有“OTC”标识的药为处方药,需凭医生处方才能购买 D、防腐剂能延长食品的保质期,但需注意使用量及残留量4. 下列化学用语表示错误的是( )A、熟石膏的化学式: B、甘氨酸的空间填充模型:
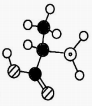 C、淀粉的分子式:
D、的结构示意图:
C、淀粉的分子式:
D、的结构示意图: 5. 下列反应属于氧化还原反应,且能量变化如图所示的是( )
5. 下列反应属于氧化还原反应,且能量变化如图所示的是( )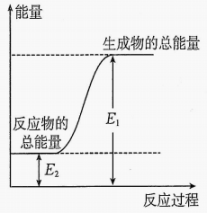 A、甲烷的燃烧反应 B、碳与在高温下化合 C、柠檬酸溶解水垢 D、铝与氧化铁高温下反应6. 下列关于金属冶炼方法的叙述错误的是( )A、用电解熔融的方法来冶炼铝 B、对于一些不活泼的金属,如、 , 可以用加热分解它们氧化物的方法来冶炼 C、在高温下,、、等还原剂可以将还原为 D、火法炼铜反应中,得到的同时转移电子7. 下列反应的化学方程式书写和所对应的反应类型均正确的是( )A、(稀)氧化还原反应 B、 加成反应 C、 酯化反应 D、 化合反应8. 硫代硫酸钠与硫酸反应会生成不溶于水的硫: , 下列说法正确的是( )A、每生成 , 同时生成 B、能使溴水褪色,体现了的漂白性 C、葡萄酒中添加适量的可起到杀菌和保质的作用 D、中硫元素的化合价为价9. 对可逆反应 , 下列叙述错误的是( )A、时,反应达到平衡,反应停止 B、达到化学平衡时,的浓度不再变化 C、达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率也减小 D、若单位时间内生成的同时生成 , 则反应达到平衡状态10. 反应 , 在下列四种不同情况下的反应速率最快的是( )A、 B、 C、 D、11. 天冬氨酸能调节脑和神经的代谢功能,广泛用作氨解毒剂、肝机能促进剂、疲劳恢复剂等医药用品。其结构如图。下列关于天冬氨酸的说法正确的是( )
A、甲烷的燃烧反应 B、碳与在高温下化合 C、柠檬酸溶解水垢 D、铝与氧化铁高温下反应6. 下列关于金属冶炼方法的叙述错误的是( )A、用电解熔融的方法来冶炼铝 B、对于一些不活泼的金属,如、 , 可以用加热分解它们氧化物的方法来冶炼 C、在高温下,、、等还原剂可以将还原为 D、火法炼铜反应中,得到的同时转移电子7. 下列反应的化学方程式书写和所对应的反应类型均正确的是( )A、(稀)氧化还原反应 B、 加成反应 C、 酯化反应 D、 化合反应8. 硫代硫酸钠与硫酸反应会生成不溶于水的硫: , 下列说法正确的是( )A、每生成 , 同时生成 B、能使溴水褪色,体现了的漂白性 C、葡萄酒中添加适量的可起到杀菌和保质的作用 D、中硫元素的化合价为价9. 对可逆反应 , 下列叙述错误的是( )A、时,反应达到平衡,反应停止 B、达到化学平衡时,的浓度不再变化 C、达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率也减小 D、若单位时间内生成的同时生成 , 则反应达到平衡状态10. 反应 , 在下列四种不同情况下的反应速率最快的是( )A、 B、 C、 D、11. 天冬氨酸能调节脑和神经的代谢功能,广泛用作氨解毒剂、肝机能促进剂、疲劳恢复剂等医药用品。其结构如图。下列关于天冬氨酸的说法正确的是( )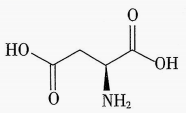 A、分子式为 B、能与溶液反应生成 C、分子中所有原子可能共平面 D、含有3种官能团12. 下列反应的离子方程式书写正确的是( )A、氯气溶于水: B、用过量氨水吸收工业尾气中的: C、小苏打与氢氧化钠溶液混合: D、磁性氧化铁溶于足量稀硝酸中:13. 除去下列物质中杂质(括号内为杂质)所选用的除杂试剂和除杂方法都正确的是( )
A、分子式为 B、能与溶液反应生成 C、分子中所有原子可能共平面 D、含有3种官能团12. 下列反应的离子方程式书写正确的是( )A、氯气溶于水: B、用过量氨水吸收工业尾气中的: C、小苏打与氢氧化钠溶液混合: D、磁性氧化铁溶于足量稀硝酸中:13. 除去下列物质中杂质(括号内为杂质)所选用的除杂试剂和除杂方法都正确的是( )选项
物质(杂质)
除杂试剂
除杂方法
A
饱和食盐水
洗气
B
溴水
洗气
C
饱和碳酸钠溶液
洗气
D
固体()
无
加热
A、A B、B C、C D、D14. 某化学小组进行乙醇的催化氧化及产物检验的实验装置如图所示,下列有关说法错误的是( )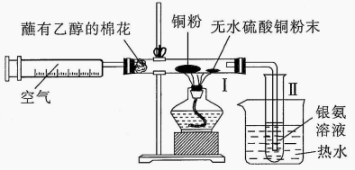 A、乙醇在铜粉催化作用下发生氧化反应 B、Ⅰ中铜粉颜色按“红色→黑色→红色”变化 C、无水硫酸铜粉末从白色变为蓝色 D、向2%的稀氨水中滴加溶液可制备银氨溶液15. 分子式为的链状结构有机物的同分异构体共有(不考虑立体异构)( )A、6种 B、7种 C、8种 D、9种16. 柠檬中富含柠檬酸(
A、乙醇在铜粉催化作用下发生氧化反应 B、Ⅰ中铜粉颜色按“红色→黑色→红色”变化 C、无水硫酸铜粉末从白色变为蓝色 D、向2%的稀氨水中滴加溶液可制备银氨溶液15. 分子式为的链状结构有机物的同分异构体共有(不考虑立体异构)( )A、6种 B、7种 C、8种 D、9种16. 柠檬中富含柠檬酸(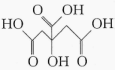 ),将锌片和石墨片按图示方式插入柠檬中,电流计指针发生偏转。下列说法正确的是( )
),将锌片和石墨片按图示方式插入柠檬中,电流计指针发生偏转。下列说法正确的是( )
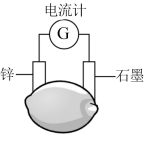 A、锌片发生了还原反应 B、柠檬酸能与小苏打反应 C、电子从锌片流出,经过柠檬汁流向石墨片 D、将锌片换成银片,电流计指针也能发生偏转17. 下列说法正确的是( )A、氨基酸能发生水解反应 B、油脂均不能使溴水褪色 C、向鸡蛋清溶液中加入醋酸铅溶液,鸡蛋清会发生变性 D、煤的液化、气化均属于物理变化18. 几种物质的转化关系如图所示。下列说法正确的是( )
A、锌片发生了还原反应 B、柠檬酸能与小苏打反应 C、电子从锌片流出,经过柠檬汁流向石墨片 D、将锌片换成银片,电流计指针也能发生偏转17. 下列说法正确的是( )A、氨基酸能发生水解反应 B、油脂均不能使溴水褪色 C、向鸡蛋清溶液中加入醋酸铅溶液,鸡蛋清会发生变性 D、煤的液化、气化均属于物理变化18. 几种物质的转化关系如图所示。下列说法正确的是( )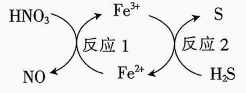 A、若将反应1设计成原电池,则在正极放电 B、反应2中氧化剂与还原剂的物质的量之比为 C、反应2的离子方程式为 D、能和大量共存19. 下列操作、现象和结论都正确的是( )
A、若将反应1设计成原电池,则在正极放电 B、反应2中氧化剂与还原剂的物质的量之比为 C、反应2的离子方程式为 D、能和大量共存19. 下列操作、现象和结论都正确的是( )选项
操作
现象
结论
A
向酸性溶液中通入足量的乙烯
紫色溶液变为无色
乙烯具有漂白性
B
向新制的悬浊液中加入葡萄糖溶液并加热
产生砖红色沉淀
葡萄糖具有还原性
C
在酒精灯火焰上分别灼烧头发和丝织品
有烧焦羽毛气味
可区分丝织品和头发
D
向某溶液中依次滴加氯水、溶液
溶液变为红色
原溶液中一定含有
A、A B、B C、C D、D20. 一定条件下,向体积为的恒容密闭容器中充入气体和气体 , 生成气体和固体 , 产物的物质的量随反应时间的变化图像如图,测得第时容器内剩余气体和气体 , 下列说法正确的是( )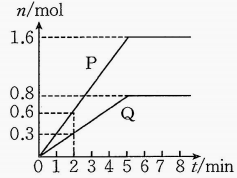 A、内,的平均反应速率为 B、该反应的化学方程式为 C、升高反应温度,逆反应速率会减小 D、后,反应停止,正反应速率与逆反应速率均为0
A、内,的平均反应速率为 B、该反应的化学方程式为 C、升高反应温度,逆反应速率会减小 D、后,反应停止,正反应速率与逆反应速率均为0二、非选择题:本题共4小题,共50分。
-
21. 亚硝酸钠可用作建筑钢材的缓蚀剂;也可用作食品添加剂,抑制微生物的生长,保持肉制品的结构和营养价值,但是过量摄入会导致中毒。
Ⅰ.某工厂以浓、、溶液等为原料生产 , 其流程如图:
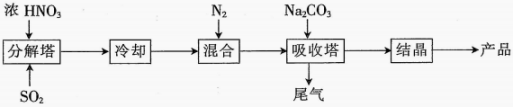 (1)、在“分解塔”中,按一定比例通入和喷入浓 , 产生和。操作时将从塔底通入,浓从塔顶向下喷淋,这种加料操作的目的是。(2)、“分解塔”中的温度不宜过高,其主要原因是。(3)、“吸收塔”中主要发生的反应为、与溶液反应生成。写出、按物质的量之比与反应生成的化学方程式:。(4)、Ⅱ.某化学研究小组在实验室用稀、为原料制备 , 实验装置如图(夹持装置已省略)。
(1)、在“分解塔”中,按一定比例通入和喷入浓 , 产生和。操作时将从塔底通入,浓从塔顶向下喷淋,这种加料操作的目的是。(2)、“分解塔”中的温度不宜过高,其主要原因是。(3)、“吸收塔”中主要发生的反应为、与溶液反应生成。写出、按物质的量之比与反应生成的化学方程式:。(4)、Ⅱ.某化学研究小组在实验室用稀、为原料制备 , 实验装置如图(夹持装置已省略)。
已知: , ;
酸性条件下,、或都能与反应生成和。
向三颈烧瓶中加入稀前,需要先打开止水夹 , 向装置中通入一段时间 , 目的是。
(5)、装置中发生反应的离子方程式为。(6)、装置、不可省去,否则会导致产品中混有(填化学式)杂质。22. 石油裂解气是一种复杂的混合气体,主要含有乙烯、丙烯、等不饱和烃,以石油裂解气为原料可以生产很多化工产品,其中生成部分产品的流程图如图所示。已知为有香味的液体。请回答下列问题: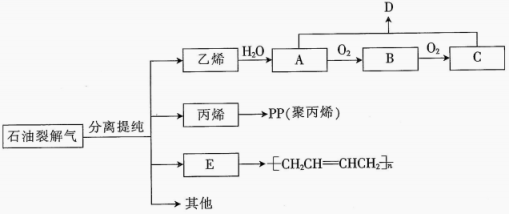 (1)、的名称为 , 写出乙烯与水反应生成的化学方程式:。(2)、、中所含官能团的名称分别为、。的反应类型为。(3)、(填“能”或“不能”)用一种试剂鉴别出、两种物质,若能请马出简要的步骤:(若不能,此空不填)。(4)、写出由丙烯生成聚丙烯的化学方程式:。(5)、合成
(1)、的名称为 , 写出乙烯与水反应生成的化学方程式:。(2)、、中所含官能团的名称分别为、。的反应类型为。(3)、(填“能”或“不能”)用一种试剂鉴别出、两种物质,若能请马出简要的步骤:(若不能,此空不填)。(4)、写出由丙烯生成聚丙烯的化学方程式:。(5)、合成 的单体的结构简式为 , 若与按物质的量之比为发生加成反应,写出可能生成的一种产物的结构简式:。 23. 化学反应在发生物质变化的同时伴随着能量的变化,它是人类获取能量的重要途径,而许多能量的利用与化学反应中的能量变化密切相关。
的单体的结构简式为 , 若与按物质的量之比为发生加成反应,写出可能生成的一种产物的结构简式:。 23. 化学反应在发生物质变化的同时伴随着能量的变化,它是人类获取能量的重要途径,而许多能量的利用与化学反应中的能量变化密切相关。回答下列问题:
(1)、的反应过程如图所示:

该反应为(填“放热”或“吸热”)反应,生成吸收或放出的热量为。
(2)、下列变化中属于吸热反应的是(填标号)。①液态水汽化 ②生石灰与水反应生成熟石灰 ③
④与固体混合
(3)、某化学反应中,设反应物的总能量为 , 生成物的总能量为。若 , 则该反应可用图(填“A”或“B”)表示。
 (4)、为了验证与的氧化性强弱,图中能达到实验目的的装置是(填标号),其正极的电极反应式为;若构建该原电池时两个电极的质量相等,当导线中通过电子时,两个电极的质量差为g。
(4)、为了验证与的氧化性强弱,图中能达到实验目的的装置是(填标号),其正极的电极反应式为;若构建该原电池时两个电极的质量相等,当导线中通过电子时,两个电极的质量差为g。
 (5)、用于燃料电池后,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得定向移向电极,则(填“A”或“B”)电极入口处通 , 参与的电极反应为。
(5)、用于燃料电池后,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得定向移向电极,则(填“A”或“B”)电极入口处通 , 参与的电极反应为。
 24. 海水是一个巨大的化学资源宝库。请回答下列问题:
24. 海水是一个巨大的化学资源宝库。请回答下列问题:Ⅰ.从海带中提取碘单质
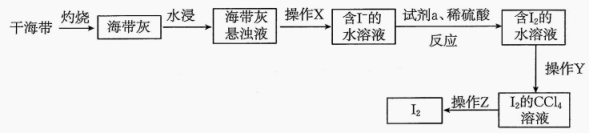 (1)、“灼烧”过程需要用到的仪器为酒精灯、三脚架、泥三角、 , “操作X”的名称为。(2)、若试剂选择 , 试剂参与反应的离子方程式为 , 氧化性:(填“>”或“<”)。(3)、“操作Y”为萃取分液,萃取后分液时,转移的溶液至烧杯中的操作是。(4)、Ⅱ.海水提溴:海水→海水淡化→氧化→空气吹出→吸收→……→液溴
(1)、“灼烧”过程需要用到的仪器为酒精灯、三脚架、泥三角、 , “操作X”的名称为。(2)、若试剂选择 , 试剂参与反应的离子方程式为 , 氧化性:(填“>”或“<”)。(3)、“操作Y”为萃取分液,萃取后分液时,转移的溶液至烧杯中的操作是。(4)、Ⅱ.海水提溴:海水→海水淡化→氧化→空气吹出→吸收→……→液溴“空气吹出”体现了溴的性,该步骤的目的是。
(5)、若“吸收”步骤使用浓的溶液,则反应后产物有、 , 该过程发生反应的离子方程式为。若反应后得到、、的混合溶液,经测定,与的物质的量之比为 , 则与反应时,被还原的溴元素和被氧化的溴元素的物质的量之比。