吉林省长春名校2022-2023学年高一下学期7月期末考试化学试题
试卷更新日期:2023-08-04 类型:期末考试
一、选择题(40分)
-
1. 下列关于合理用药和食品添加剂的说法正确的是( )A、处方药的包装上印有“OTC”标识 B、为了使婴儿对食品有浓厚兴趣,可以在婴儿食品中加大量着色剂 C、长期服用阿司匹林可预防某些疾病,没有副作用 D、味精能增加食品的鲜味,是一种常用的增味剂,其化学名称为谷氨酸钠2. 《内经》曰:“五谷为养,五果为助,五畜为益,五菜为充”。合理膳食,能提高免疫力。下列说法正确的是( )A、“五谷”富含淀粉,淀粉的最终水解产物为蔗糖 B、“五畜”富含油脂和蛋白质,植物油能使溴的四氯化碳溶液褪色 C、淀粉通过发酵法制得的乳酸[CH₃CH(OH)COOH]是乙酸的同系物 D、食盐水可以破坏蛋白质结构,用盐水漱口可以杀灭病毒3. 化学与生活、生产、科技等息息相关。下列说法错误的是( )A、可用聚氯丙烯为原料制作医用外科口罩 B、三元催化器是汽车排气系统重要的机外净化装置 C、某些放射性同位素发出的射线可进行金属制品探伤 D、能量转换率高和长时供电的燃料电池常用于航天领域4. 中华传统文化蕴含着丰富的化学知识,下列诗句中主要涉及吸热反应的是( )A、白居易《赋得古原草送别》:“野火烧不尽,春风吹又生。” B、苏轼《石炭》:“投泥泼水愈光明,烁玉流金见精悍。” C、于谦《咏煤炭》:“爝火燃回春浩浩,烘炉照破夜沉沉。” D、李商隐《相见时难别亦难》:“春蚕到死丝方尽,蜡炬成灰泪始干。”5. 下列物质的名称正确的是( )A、聚异戊二烯:
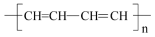 B、生石膏:CaSO4·2H2O
C、麦芽糖:C6H12O6
D、乙二酸:
B、生石膏:CaSO4·2H2O
C、麦芽糖:C6H12O6
D、乙二酸: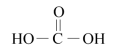 6. 由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程示意图如下:
6. 由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程示意图如下: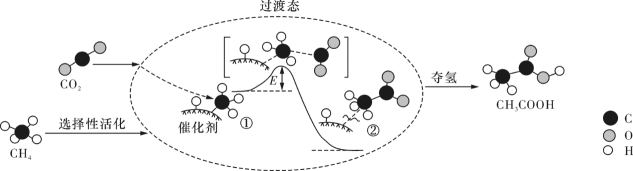
下列说法错误的是( )
A、生成CH3COOH总反应的原子利用率为100% B、CH4 →CH3COOH过程中,有C-H键发生断裂 C、①→②放出能量并形成了C-C键 D、该催化剂能改变反应的焓变7. 下列说法正确的是( )A、为增强高锰酸钾溶液的氧化能力,通常在其中加入适量的盐酸 B、同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积相等 C、少量NO2和足量SO2混合气体通入BaCl2溶液中,产生的沉淀只有BaSO4 D、Na2O2和SO2均有漂白性,将二者分别加入紫色石蕊溶液中,最后均变为无色8. 设 NA为阿伏加德罗常数,下列说法正确的是( )A、28g聚乙烯中含有的碳原子数为NA B、16g甲烷中含有非极性共价键的数目为 4NA C、常温常压下,15g甲基(-CH₃)含有电子数为 9NA D、标准状况下,11.2 L CCl₄中所含氯原子数目为2NA9. 下列“类比”合理的是( )A、HCl中的化学键是共价键,则同主族的钠形成的NaCl中的化学键也是共价键 B、2Cu+O22CuO,则同族的硫也有Cu+SCuS C、NH3与HCl反应生成NH4Cl,则N2H4与HCl反应生成N2H6Cl2 D、CO2与Na2O2反应只生成Na2CO3和O2 , 则SO2与Na2O2反应只生成Na2SO3和O210. 下列有关实验的操作、现象和实验结论正确的是( )选项
操作
现象
实验结论
A
将乙烯通入溴的四氯化碳溶液
溶液最终变为无色且有分层现象
生成的1,2-二溴乙烷无色、不溶于四氯化碳
B
向某溶液中加入BaCl₂溶液,有白色沉淀生成,再滴加过量稀盐酸
沉淀不溶解
该溶液中一定含有SO42-
C
将SO₂通入酸性KMnO₄溶液
溶液褪色
SO₂具有还原性
D
向淀粉溶液中加入几滴稀硫酸,煮沸几分钟,向冷却液中加入新制Cu(OH)₂,加热
无砖红色沉淀生成
淀粉没有水解
A、A B、B C、C D、D11. 最近科学发现,一种形状像蝴蝶结的有机分子Bowtiediene,其形状和结构如图所示,下列有关该分子的说法中不正确的是( )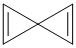 A、该有机物的分子式为C5H4 B、该分子中所有碳原子在同一平面内 C、1 mol该有机物最多可与2 mol Br2发生加成反应 D、与其互为同分异构体,且只含碳碳三键的链烃只有一种12. 下列实验中,能达到相应实验目的的是( )
A、该有机物的分子式为C5H4 B、该分子中所有碳原子在同一平面内 C、1 mol该有机物最多可与2 mol Br2发生加成反应 D、与其互为同分异构体,且只含碳碳三键的链烃只有一种12. 下列实验中,能达到相应实验目的的是( )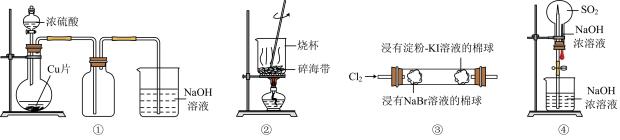 A、图①可用于制备和收集 SO₂ B、图②可灼烧海带 C、图③可证明氧化性:Cl₂>Br₂>I₂ D、图④可进行喷泉实验13. 抗坏血酸(即维生素 C)是水果罐头中常用的食品添加剂。在空气中发生变化:
A、图①可用于制备和收集 SO₂ B、图②可灼烧海带 C、图③可证明氧化性:Cl₂>Br₂>I₂ D、图④可进行喷泉实验13. 抗坏血酸(即维生素 C)是水果罐头中常用的食品添加剂。在空气中发生变化: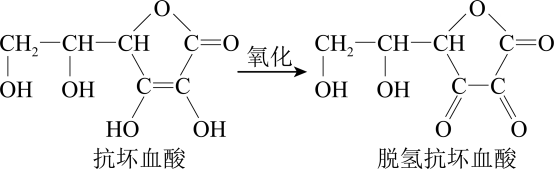
下列有关说法中错误的是( )
A、水果罐头中加入抗坏血酸作抗氧化剂 B、抗坏血酸能发生酯化反应、水解反应、加成反应 C、1mol脱氢抗坏血酸与足量 Na反应生成22.4 L(标准状况下)H₂ D、抗坏血酸能使酸性KMnO₄溶液褪色,脱氢抗坏血酸则不能14. 有机化合物在人类生活和生产中必不可少,下列对有机化合物的叙述正确的是( )A、凡是含碳元素的化合物都属于有机化合物 B、乙烯、乙炔分子中所有原子在同一个平面中 C、环己烷(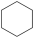 )和苯(
)和苯(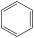 )均属于不饱和烃
D、某有机物完全燃烧后生成CO2和H2O,说明该有机物中一定含有C、H、O元素
15. 短周期元素W、X、Z、Y、N,原子序数依次增大,W与Y原子最外层电子数之和等于X原子最外层电子数,它们形成如图物质,下列说法正确的是( )
)均属于不饱和烃
D、某有机物完全燃烧后生成CO2和H2O,说明该有机物中一定含有C、H、O元素
15. 短周期元素W、X、Z、Y、N,原子序数依次增大,W与Y原子最外层电子数之和等于X原子最外层电子数,它们形成如图物质,下列说法正确的是( )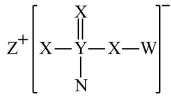 A、原子半径W<X<Y<N<Z B、N的含氧酸酸性比Y的强 C、Z、N都能与X形成有漂白性的物质,且漂白原理相似 D、该化合物中所有原子都满足结构16. 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是( )
A、原子半径W<X<Y<N<Z B、N的含氧酸酸性比Y的强 C、Z、N都能与X形成有漂白性的物质,且漂白原理相似 D、该化合物中所有原子都满足结构16. 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是( )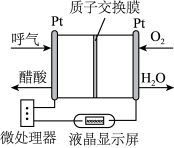 A、H+在电池工作时向O2所在的铂电极移动 B、电子由呼气的铂电极经电解质溶液流向O2所在的铂电极 C、微处理器通过检测电流大小而计算出被测气体中酒精的含量 D、该电池的负极反应式为:CH3CH2OH + 3H2O-12e- = 2CO2↑ + 12H+17. 由甲醇制备二甲醚涉及如下反应:
A、H+在电池工作时向O2所在的铂电极移动 B、电子由呼气的铂电极经电解质溶液流向O2所在的铂电极 C、微处理器通过检测电流大小而计算出被测气体中酒精的含量 D、该电池的负极反应式为:CH3CH2OH + 3H2O-12e- = 2CO2↑ + 12H+17. 由甲醇制备二甲醚涉及如下反应: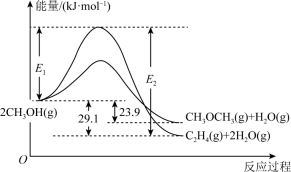
①2CH3OH(g) ⇌ C2H4(g)+2H2O(g) △H1;
2CH3OH(g) ⇌ CH3OCH3(g)+H2O(g) △H2。
下列说法正确的是( )
A、△H1<△H2 B、反应②为吸热反应 C、C2H4(g)+H2O(g) ⇌ CH3OCH3(g) △H=-5.2kJ•mol-1 D、相同条件下,CH3OCH3(g)比C2H4(g)稳定18. 某实验小组用0.1 mol·L-1 Na2S2O3溶液和0.1 mol·L-1 H2SO4溶液为反应物,探究外界条件对化学反应速率的影响,实验记录如下:实验序号
温度/℃
H2SO4溶液体积/mL
Na2S2O3溶液体积/mL
H2O体积/mL
出现沉淀所需的时间/s
Ⅰ
30
10
5
5
t1
Ⅱ
30
5
5
a
t2
Ⅲ
60
10
5
5
t3
已知:①Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S↓+ H2O ②实验结果:t2>t1>t3。
下列说法错误的是( )
A、a = 10 B、对比实验Ⅰ、Ⅲ可知,升高温度能加快该反应速率 C、除了用产生沉淀所需时间,还可以用产生气泡所需时间来记录和比较反应速率 D、进行实验Ⅰ、Ⅱ时,可依次向试管中加入H2SO4溶液、H2O、Na2S2O3溶液19. 向2L绝热(不与外界发生热交换)恒容密闭容器中通入1mol CO(g)和2mol H2S(g),发生反应CO(g) + H2S(g) ⇌ COS(g) + H2 (g),反应5min达到平衡状态,测得平衡时COS(g)体积分数为20%。下列说法正确的是( )A、CO和H2S的平衡转化率均为60% B、v(COS) = v(H2S) = 0.12 mol·L-1·min-1 C、将绝热恒容容器改为恒温恒容容器,反应达平衡时间大于5min,则该反应为放热反应 D、由保持不变或容器压强不变,均可判断该反应已达到平衡状态20. 下列有关说法正确的是( )A、已知2C(s)+2O2(g)=2CO2(g) ΔH1 , 2C(s)+O2(g)=2CO(g) ΔH2 , 则ΔH1<ΔH2 B、已知2H2(g)+O2(g)=2H2O(g) ΔH=-571.6kJ·mol-1 , 则H2的燃烧热为285.8kJ·mol-1 C、已知HI(g) ⇌ 1/2H2(g)+1/2I2(s) ΔH=-26.5kJ·mol-1 , 由此可知,在密闭容器中充入1mol HI气体,充分分解后可以放出26.5kJ的热量 D、HCl和NaOH反应中和热ΔH=-57.3kJ·mol-1 , H2SO4(aq)+Ca(OH)2(aq)=CaSO4(s)+2H2O(l) ΔH=-114.6kJ·mol-1二、填空题
-
21. 工业合成氨的反应如下:N2 + 3H22NH3。某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2 , 一段时间后反应达平衡状态,实验数据如下表所示:
t/s
0
50
150
250
350
n(NH3)
0
0.24
0.36
0.40
0.40
(1)、0~50s内的平均反应速率 v(N2) = 。(2)、250s时,H2的转化率为。(3)、已知N≡N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中的热量变化 kJ。下图能正确表示该反应中能量变化的是。 (4)、为加快反应速率,可以采取的措施。
(4)、为加快反应速率,可以采取的措施。a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离NH3
(5)、下列说法错误的是____。A、使用催化剂是为了加快反应速率,提高生产效率 B、上述条件下,N2不可能100%转化为NH3 C、为了提高N2的转化率,应适当提高H2的浓度 D、250~350s生成物浓度保持不变,反应停止22. 为验证甲烷的某些化学性质,实验室可用无水乙酸钠和碱石灰混合共热制甲烷,方程式如下:。已知甲烷可被CuO氧化,方程式如下:。实验所需装置如图甲所示(部分夹持仪器已略去),B中试剂为酸性高锰酸钾溶液。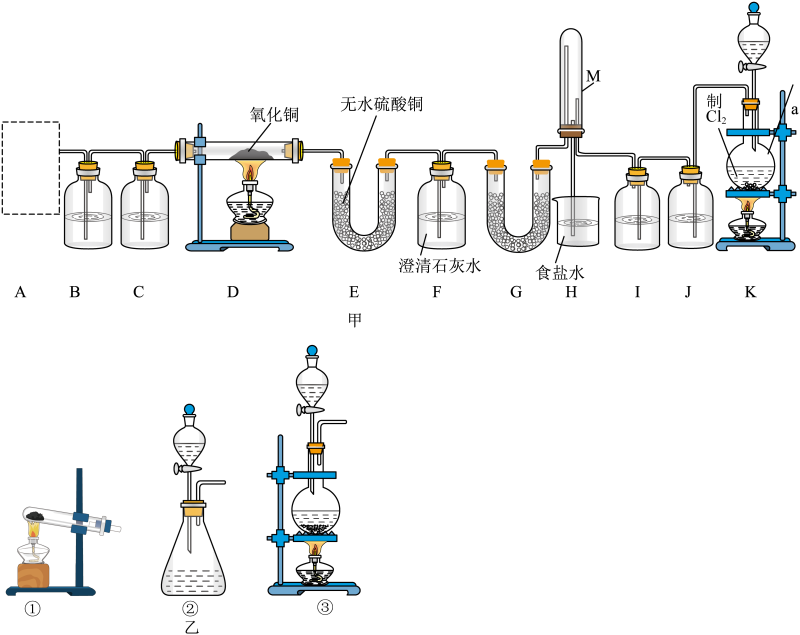 (1)、装置A应选择图乙中的(填编号),仪器a的名称是。(2)、B中的现象是 , 装置C中的试剂为。(3)、装置E、F中的现象分别是 , 。(4)、装置K中发生反应的离子方程式为。(5)、收集气体后对装置M中的混合气体进行光照,装置M中可观察到的现象为黄绿色变浅、、有白雾产生、装置H中的导管内液面上升。生成一氯甲烷的化学方程式为。23. 工业上常用电解熔融氧化铝的方法来生产铝锭,其电解的氧化铝纯度不得低于 98.2%,而天然铝土矿中的氧化铝含量为 50%~70%,杂质主要为 SiO2、Fe2O3、MgO 等。工业生产铝锭的工艺流程如下图:
(1)、装置A应选择图乙中的(填编号),仪器a的名称是。(2)、B中的现象是 , 装置C中的试剂为。(3)、装置E、F中的现象分别是 , 。(4)、装置K中发生反应的离子方程式为。(5)、收集气体后对装置M中的混合气体进行光照,装置M中可观察到的现象为黄绿色变浅、、有白雾产生、装置H中的导管内液面上升。生成一氯甲烷的化学方程式为。23. 工业上常用电解熔融氧化铝的方法来生产铝锭,其电解的氧化铝纯度不得低于 98.2%,而天然铝土矿中的氧化铝含量为 50%~70%,杂质主要为 SiO2、Fe2O3、MgO 等。工业生产铝锭的工艺流程如下图: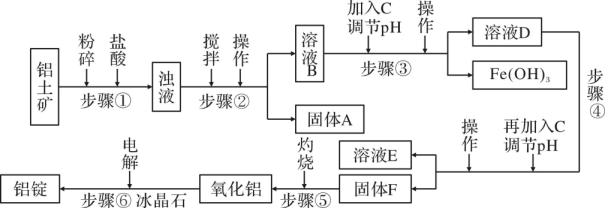
一些难溶物开始沉淀和完全沉淀的 pH 如表所示:
沉淀物
Al(OH)3
Fe(OH)3
Mg(OH)2
开始沉淀 pH(离子初始浓度为 0.01mol·L-1)
4
2.3
10.4
完全沉淀 pH(离子浓度<10-5mol·L-1)
5.2
3.2
12.4
请回答下列问题:
(1)、步骤①粉碎的目的;步骤②③④中操作均为;固体A的化学式为;(2)、物质 C 可以为(填序号)a.Fe b.氨 c.过量氢氧化钠稀溶液
(3)、步骤③中调节溶液 pH 的数值范围为;(4)、步骤④中溶液 E 主要含 Mg2+、Cl-等,故分离固体F时,必须对F进行洗涤。如何检验F是否洗涤干净;(5)、步骤⑥的化学方程式为。24. 高分子化合物H是一种重要工业原料,其单体A不溶于水,可以发生如图变化。请回答下列问题: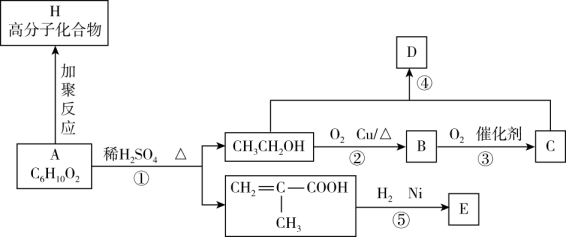 (1)、有机物C的分子式是。(2)、有机物A 中官能团的名称为、。(3)、反应①的反应类型为;反应⑤的反应类型为。(4)、的某种同分异构体符合下列条件,其结构简式为。
(1)、有机物C的分子式是。(2)、有机物A 中官能团的名称为、。(3)、反应①的反应类型为;反应⑤的反应类型为。(4)、的某种同分异构体符合下列条件,其结构简式为。①能发生银镜反应
②分子中含两个甲基
③能和金属钠反应生成氢气
(5)、反应②的化学方程式是。(6)、反应①的化学反应方程式。(7)、写出高分子化合物H的结构简式:。