广东省云浮市2022-2023学年高一下学期7月期末考试化学试题
试卷更新日期:2023-08-04 类型:期末考试
一、选择题:本题共16小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 豆腐营养丰富、味道鲜美,是大众喜爱的传统美食,豆腐的传统制作过程如图所示,下列说法错误的是( )
 A、“滤渣”过程中利用了过滤原理 B、豆腐中含有丰富的蛋白质,在人体内可水解生成葡萄糖 C、“煮浆”涉及化学变化 D、“点卤”涉及胶体聚沉2. 下列所涉及的材料中,不属于有机高分子材料的是( )A、光导纤维 B、涤纶 C、橡胶消声瓦 D、脲醛塑料3. 物质的性质决定用途,下列物质的性质与用途无关的是( )
A、“滤渣”过程中利用了过滤原理 B、豆腐中含有丰富的蛋白质,在人体内可水解生成葡萄糖 C、“煮浆”涉及化学变化 D、“点卤”涉及胶体聚沉2. 下列所涉及的材料中,不属于有机高分子材料的是( )A、光导纤维 B、涤纶 C、橡胶消声瓦 D、脲醛塑料3. 物质的性质决定用途,下列物质的性质与用途无关的是( )选项
物质
性质
用途
A
熔点高
制作耐高温材料
B
极易溶于水
作制冷剂
C
燃烧放出的热量多,污染小
作燃料
D
水玻璃
硅酸钠不燃不爆
作防火剂
A、A B、B C、C D、D4. 下列反应中,属于取代反应的是( )A、 B、 C、 D、5. 25 ℃时,在无色溶液中下列各组离子能够大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、6. 化学是人类利用自然资源和应对环境问题的重要科学依据。下列说法正确的是( )A、煤的干馏过程中主要发生化学变化 B、长期使用DDT不会导致残留污染 C、工业冶炼Ag常用电解法 D、石油裂化和裂解的目的都是生产汽油7. 和在一定条件下能发生反应 , 该反应过程中能量变化趋势如图,下列说法正确的是( )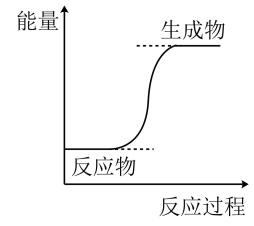 A、甲烷的分子结构模型为
A、甲烷的分子结构模型为 B、该反应过程中有非极性键的断裂和生成
C、提高反应时的温度,可以实现 , 的完全转化
D、该反应中反应物断键吸收的总能量大于生成物成键放出的总能量
8. 客家黄酒是广东名酒,有活气养血、活络通经之功效,黄酒中含有丰富的维生素、氨基酸等营养成分。下列有关说法中错误的是( )A、黄酒微酸是因为黄酒中的乙醇电离出了氢离子 B、酒越陈越香与生成的酯类物质有关 C、粮食酿黄酒涉及反应 D、氨基酸中均含有氮元素9. 设为阿伏加德罗常数的值,下列说法正确的是( )A、 中含有的数为 B、50 g质量分数为30%的乙酸溶液中含有的C原子数为 C、18 g 中含有的电子数为 D、标准状况下,11.2 L 中含有的非极性键数目为10. 硫是生命代谢与发育必不可少的元素,在微生物作用下硫循环的一种途径如图所示,下列说法错误的是( )
B、该反应过程中有非极性键的断裂和生成
C、提高反应时的温度,可以实现 , 的完全转化
D、该反应中反应物断键吸收的总能量大于生成物成键放出的总能量
8. 客家黄酒是广东名酒,有活气养血、活络通经之功效,黄酒中含有丰富的维生素、氨基酸等营养成分。下列有关说法中错误的是( )A、黄酒微酸是因为黄酒中的乙醇电离出了氢离子 B、酒越陈越香与生成的酯类物质有关 C、粮食酿黄酒涉及反应 D、氨基酸中均含有氮元素9. 设为阿伏加德罗常数的值,下列说法正确的是( )A、 中含有的数为 B、50 g质量分数为30%的乙酸溶液中含有的C原子数为 C、18 g 中含有的电子数为 D、标准状况下,11.2 L 中含有的非极性键数目为10. 硫是生命代谢与发育必不可少的元素,在微生物作用下硫循环的一种途径如图所示,下列说法错误的是( )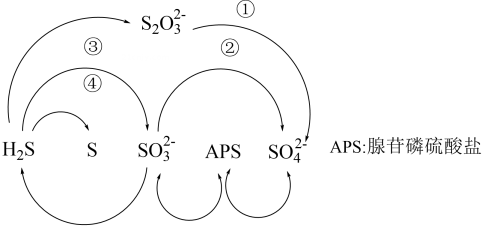 A、自然界中存在游离态的硫 B、过程①②③④均属于氧化还原反应 C、人类对化石燃料的过度开采及使用会对硫循环造成巨大影响 D、S在足量的氧气中燃烧可以一步转化为11. Na、Mg、N、S、Cl是短周期中的主族元素。下列叙述正确的是( )A、原子半径: B、N位于元素周期表第二周期第Ⅴ族 C、最高价氧化物对应水化物的碱性: D、Na、S两种元素可形成共价化合物12. 罗定肉桂是广东省罗定市的特产,其富含的一种有机物M的结构如图所示,下列有关有机物M的说法中正确的是( )
A、自然界中存在游离态的硫 B、过程①②③④均属于氧化还原反应 C、人类对化石燃料的过度开采及使用会对硫循环造成巨大影响 D、S在足量的氧气中燃烧可以一步转化为11. Na、Mg、N、S、Cl是短周期中的主族元素。下列叙述正确的是( )A、原子半径: B、N位于元素周期表第二周期第Ⅴ族 C、最高价氧化物对应水化物的碱性: D、Na、S两种元素可形成共价化合物12. 罗定肉桂是广东省罗定市的特产,其富含的一种有机物M的结构如图所示,下列有关有机物M的说法中正确的是( )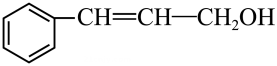 A、分子中所有原子在同一平面上 B、不能使酸性高锰酸钾溶液褪色 C、能与钠反应产生氢气 D、M中含氧官能团的电子式为
A、分子中所有原子在同一平面上 B、不能使酸性高锰酸钾溶液褪色 C、能与钠反应产生氢气 D、M中含氧官能团的电子式为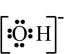 13. 化学课外活动小组设计的用化学电源使LED灯发光的装置示意图如图。下列有关该装置的说法正确的是( )
13. 化学课外活动小组设计的用化学电源使LED灯发光的装置示意图如图。下列有关该装置的说法正确的是( )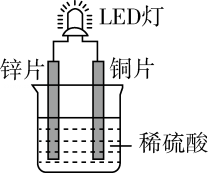 A、如果将锌片换成铁片,那么电路中的电流方向将改变锌片铜片 B、该装置工作时,电解质溶液中阴离子移向锌片 C、铜片为负极,其附近的溶液变蓝 D、如果将稀硫酸换成柠檬汁,那么LED灯一定不会发光14. 某同学用如图装置探究浓硫酸与蔗糖反应,下列说法正确的是( )
A、如果将锌片换成铁片,那么电路中的电流方向将改变锌片铜片 B、该装置工作时,电解质溶液中阴离子移向锌片 C、铜片为负极,其附近的溶液变蓝 D、如果将稀硫酸换成柠檬汁,那么LED灯一定不会发光14. 某同学用如图装置探究浓硫酸与蔗糖反应,下列说法正确的是( ) A、蔗糖和葡萄糖互为同分异构体 B、加入浓硫酸后试管内固体由白色变为褐色再变为黑色,并且体积膨胀,体现了浓硫酸的脱水性和强氧化性 C、澄清石灰水变浑浊说明反应生成了 D、的漂白性会导致品红溶液和酸性高锰酸钾溶液均褪色15. 溴是一种重要的基础化工原料,在阻燃剂、感光材料、油田开采等领域中应用广泛。从海水中提溴的一种方法如图所示,下列说法正确的是( )
A、蔗糖和葡萄糖互为同分异构体 B、加入浓硫酸后试管内固体由白色变为褐色再变为黑色,并且体积膨胀,体现了浓硫酸的脱水性和强氧化性 C、澄清石灰水变浑浊说明反应生成了 D、的漂白性会导致品红溶液和酸性高锰酸钾溶液均褪色15. 溴是一种重要的基础化工原料,在阻燃剂、感光材料、油田开采等领域中应用广泛。从海水中提溴的一种方法如图所示,下列说法正确的是( )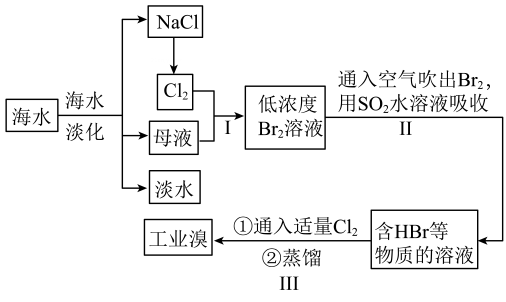 A、Br的非金属性强于Cl B、反应Ⅰ中,发生了氧化反应 C、蒸馏是利用各物质的溶解度不同进行分离的过程 D、反应Ⅱ的化学方程式为16. 下列根据实验现象得出的结论正确的是( )
A、Br的非金属性强于Cl B、反应Ⅰ中,发生了氧化反应 C、蒸馏是利用各物质的溶解度不同进行分离的过程 D、反应Ⅱ的化学方程式为16. 下列根据实验现象得出的结论正确的是( )选项
实验
现象
结论
A
向装有某盐溶液的试管中加入浓的NaOH溶液,加热,将湿润的红色石蕊试纸放在试管口
红色石蕊试纸变蓝
该溶液中含有
B
向装有稀硝酸的试管中加入铁粉
试管口产生红棕色气体
稀硝酸与铁反应生成了
C
向装有溶液的试管中加入铜粉
铜粉溶解
还原性:
D
向淀粉溶液中加入少量稀 , 加热,冷却后再加少量新制的 , 加热
未生成砖红色沉淀
淀粉未水解
A、A B、B C、C D、D二、非选择题:本题共4小题,共52分。
-
17. 某化学兴趣小组用如图装置(夹持和加热装置已省略)来研究乙醇催化氧化的实验。
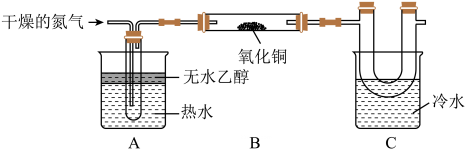
回答下列问题:
(1)、A中热水可实现均匀加热,使挥发;C中U形管收集到的液体中,含有的有机物为(填名称)。(2)、B中氧化铜生成铜的化学方程式为。(3)、反应结束后,硬质玻璃管中黑色固体全部变红,查阅资料得知:氧化亚铜为红色固体,可以发生反应:。同学们对反应结束后的红色固体成分提出猜想。猜想1:固体为铜
猜想2:固体为氧化亚铜
猜想3:固体为铜和氧化亚铜的混合物
①甲同学取少量反应后的固体,加入足量的稀硫酸中,固体部分溶解,溶液变蓝,则猜想不成立。
②乙同学取少量反应后的固体,加入稀硝酸中,固体全部溶解,得出猜想2成立,其他同学对此提出质疑,理由是。
③在老师的指导下,丙同学取20 g反应后的固体于试管中,加入足量稀硫酸,充分反应后,过滤、、干燥,称量得知干燥后的固体为18 g,得出猜想成立。
18. 硝酸铵的化学式为 , 是白色结晶性粉末,极易溶于水。硝酸铵在现代农业、工业和国防中都占有重要地位。工业生产硝酸铵的简要流程如图。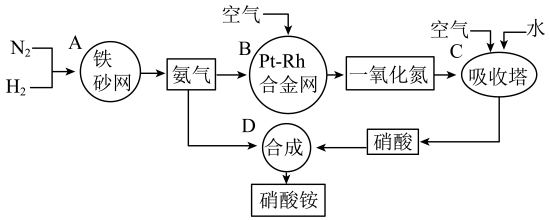 (1)、的结构式为;中氮元素的化合价依次为、。(2)、B装置中合金网的作用是 , 其中发生反应的化学方程式为(3)、 C、D两个装置中发生的反应,属于氧化还原反应的是(填标号),其中氧化剂为(填化学式)。(4)、常温下,铝在浓硝酸中会发生钝化,其本质是发生氧化还原反应,使铝的表面形成一层致密的氧化膜,同时生成二氧化氮,其反应的离子方程式为。19. 可转化成有机物实现碳循环。在体积为2 L的恒容绝热(与外界没有热交换)密闭容器中,充入2 mol 和5 mol , 一定条件下发生反应: , 此反应为放热反应,测得的物质的量随时间变化如图1所示。
(1)、的结构式为;中氮元素的化合价依次为、。(2)、B装置中合金网的作用是 , 其中发生反应的化学方程式为(3)、 C、D两个装置中发生的反应,属于氧化还原反应的是(填标号),其中氧化剂为(填化学式)。(4)、常温下,铝在浓硝酸中会发生钝化,其本质是发生氧化还原反应,使铝的表面形成一层致密的氧化膜,同时生成二氧化氮,其反应的离子方程式为。19. 可转化成有机物实现碳循环。在体积为2 L的恒容绝热(与外界没有热交换)密闭容器中,充入2 mol 和5 mol , 一定条件下发生反应: , 此反应为放热反应,测得的物质的量随时间变化如图1所示。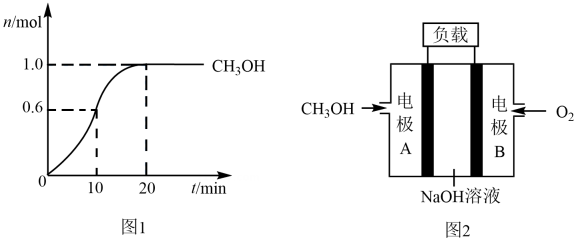 (1)、0~10 min内,的平均反应速率 , 第20 min时,的浓度。(2)、0~10 min内的平均反应速率(填“>”、“<”或“=”)10~20 min内的平均反应速率,可能的原因是(填标号)。
(1)、0~10 min内,的平均反应速率 , 第20 min时,的浓度。(2)、0~10 min内的平均反应速率(填“>”、“<”或“=”)10~20 min内的平均反应速率,可能的原因是(填标号)。a.0~10 min内,反应物浓度更大
b.0~10 min内,容器内温度较低
c.0~10 min内,生成物浓度更大
(3)、下列能说明上述反应达到平衡状态的是(填标号)。a.容器内温度不随时间的变化而变化
b.混合气体中各成分浓度之比为
c.单位时间内消耗a mol , 同时生成a mol
d.混合气体的平均相对分子质量不随时间的变化而变化
(4)、CO与反应可制备 , 可作为燃料使用,用和组成的碱性燃料电池的结构示意图如图2,电池总反应为 , 则该燃料电池的正极为电极(填“A”或“B”),负极的电极反应式为。CH,
20. 异丁酸乙酯主要用于配制奶油及草莓、樱桃等水果型香精,它的一种合成路线如图所示。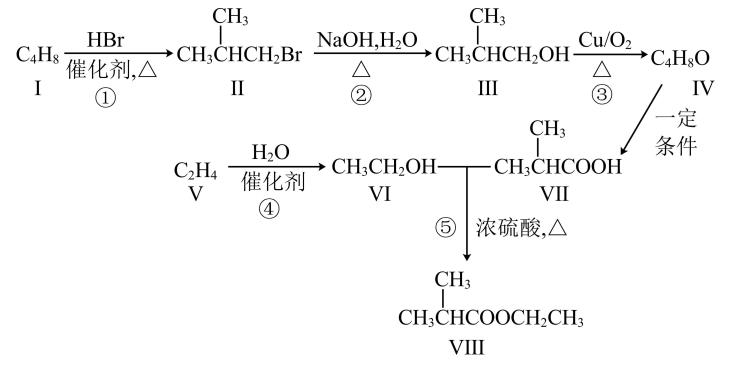
请回答下列问题:
(1)、反应①属于反应。(2)、按照官能团对有机物进行分类,Ⅲ属于类物质。Ⅶ的官能团名称为。(3)、Ⅴ的名称为 , 其发生加聚反应产物的结构简式是。(4)、⑤的化学方程式为;下列关于有机物Ⅶ的说法中,正确的是(填标号)。a.与乙酸互为同系物
b.属于不饱和烃
c.不能与溶液反应
d.能发生取代、氧化反应
(5)、Ⅰ的一种同分异构体Ⅸ为环状烃且只有一种一氯取代物,Ⅸ的结构简式为 , Ⅸ与反应生成的二氯取代物有种。