广东省汕尾市2022-2023学年高一下学期期末教学质量监测化学试题
试卷更新日期:2023-08-04 类型:期末考试
一、选择题:本题共16小题,共54分。第1~10小题,每小题3分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 化学与生产、生活密切相关。下列说法正确的是( )A、铁粉可用作食品袋内的干燥剂 B、酱油是中国传统的调味品,主要成分为油脂 C、“84”消毒液、漂白粉、过氧化氢、医用酒精的消毒原理相同 D、利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境2. 中华传统文化中富载许多化学知识。下列说法正确的是( )A、闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成 B、《物理小识·金石类》记载的“有硇水(硝酸)者,剪银块投之,则旋而为水”中没有涉及氧化还原反应 C、我国清代《本草纲目拾遗》中记叙“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指HF D、“春蚕到死丝方尽,蜡炬成灰泪始干”,古代的蜡主要成分是高级脂肪酸酯,属于有机高分子化合物3. 下列有关化学用语表示正确的是( )A、中子数为7的碳原子: B、HClO的结构式:H—Cl—O C、NH4Cl的电子式: D、的结构示意图:
 4. 科学技术的发展改变人们的生活。下列说法不正确的是( )A、“奋斗者号”潜水器的外壳是耐超高压的钛合金,钛合金的熔点低于金属钛 B、我国自主研发的某芯片,其主要成分与光导纤维的成分相同 C、制造“天问一号”火星车热控保温材料的纳米气凝胶,可产生丁达尔效应 D、碳中和是指特定时期内全球人为CO2排放量与CO2消除量相当5. 某实验小组从废旧干电池内黑色粉末中回收二氧化锰并验证其催化作用,下列所选择的装置不正确的是( )
4. 科学技术的发展改变人们的生活。下列说法不正确的是( )A、“奋斗者号”潜水器的外壳是耐超高压的钛合金,钛合金的熔点低于金属钛 B、我国自主研发的某芯片,其主要成分与光导纤维的成分相同 C、制造“天问一号”火星车热控保温材料的纳米气凝胶,可产生丁达尔效应 D、碳中和是指特定时期内全球人为CO2排放量与CO2消除量相当5. 某实验小组从废旧干电池内黑色粉末中回收二氧化锰并验证其催化作用,下列所选择的装置不正确的是( ) A、装置甲溶解固体 B、装置乙过滤溶液 C、装置丙灼烧固体 D、装置丁验证MnO2的催化作用6. 通过对实验现象的观察、分析推理得出结论是化学学习的方法之一。下列对实验现象的解释正确的是( )
A、装置甲溶解固体 B、装置乙过滤溶液 C、装置丙灼烧固体 D、装置丁验证MnO2的催化作用6. 通过对实验现象的观察、分析推理得出结论是化学学习的方法之一。下列对实验现象的解释正确的是( )选项
实验现象
解释
A
向KI淀粉溶液中通入Cl2 , 溶液变蓝
Cl2能与淀粉发生显色反应
B
加热分别盛有氯化铵和碘的两支试管,试管底部固体均减少
二者均发生升华
C
浓硝酸在光照条件下变黄
浓硝酸不稳定,生成的有色产物能溶于硝酸
D
Fe与稀HNO3、稀H2SO4反应均有气泡产生
Fe与两种酸均发生置换反应
A、A B、B C、C D、D7. 一种镁—空气电池装置如图所示,电极材料为金属镁和吸附氧气的活性炭,电解质为KOH浓溶液。下列说法不正确的是( ) A、电流方向从b经外电路到a B、活性炭对O2有吸附作用,可以加快O2在电极上的反应速率 C、负极的电极反应式为 D、当电路中转移1mol电子时,消耗标准状况下5.6LO28. 某有机物的结构简式如图所示。下列关于该有机物的说法不正确的是( )
A、电流方向从b经外电路到a B、活性炭对O2有吸附作用,可以加快O2在电极上的反应速率 C、负极的电极反应式为 D、当电路中转移1mol电子时,消耗标准状况下5.6LO28. 某有机物的结构简式如图所示。下列关于该有机物的说法不正确的是( ) A、可以与溴水发生加成反应 B、可以与乙酸发生酯化反应 C、既能与Na反应,又能与NaOH、Na2CO3反应 D、1mol该有机物最多可以与6molH2发生加成反应9. 反应是潜艇中氧气来源之一。用表示阿伏加德罗常数的值。下列说法不正确的是( )A、含有个电子 B、反应中每生成转移电子 C、标准状况下,含有个氧原子 D、将溶于水配成溶液,则10. 火星气体及岩石中富含原子序数递增的四种短周期元素 , 其中为短周期元素中原子半径最大的元素(除稀有气体元素),为同一主族元素,是地壳中含量最高的元素,火星岩石中含有。下列判断正确的是( )A、离子半径: B、最高价氧化物对应的水化物的酸性: C、简单氢化物的稳定性: D、化合物只含离子键11. 下列对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
A、可以与溴水发生加成反应 B、可以与乙酸发生酯化反应 C、既能与Na反应,又能与NaOH、Na2CO3反应 D、1mol该有机物最多可以与6molH2发生加成反应9. 反应是潜艇中氧气来源之一。用表示阿伏加德罗常数的值。下列说法不正确的是( )A、含有个电子 B、反应中每生成转移电子 C、标准状况下,含有个氧原子 D、将溶于水配成溶液,则10. 火星气体及岩石中富含原子序数递增的四种短周期元素 , 其中为短周期元素中原子半径最大的元素(除稀有气体元素),为同一主族元素,是地壳中含量最高的元素,火星岩石中含有。下列判断正确的是( )A、离子半径: B、最高价氧化物对应的水化物的酸性: C、简单氢化物的稳定性: D、化合物只含离子键11. 下列对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )选项
陈述Ⅰ
陈述Ⅱ
判断
A
向浓盐酸中加入浓硫酸可制备氯化氢气体
浓盐酸易挥发,浓硫酸与水作用放出大量的热
Ⅰ对,Ⅱ对;有
B
能与浓反应
具有还原性,具有氧化性,二者在任何条件下反应生成的气体一定是
Ⅰ对,Ⅱ对;无
C
硫单质在纯氧中燃烧有少量生成
能与在一定条件下反应生成
Ⅰ对,Ⅱ对;无
D
硝酸铵和碱石灰共热用于实验室制备
铵盐与碱能发生复分解反应
Ⅰ对,Ⅱ对;有
A、A B、B C、C D、D12. 下列实验操作、现象及结论都正确的是( )选项
实验操作
现象
结论
A
将浓硫酸滴入蔗糖中,产生的气体导入澄清石灰水中
蔗糖变黑、体积膨胀,澄清石灰水变浑浊
浓硫酸具有脱水性和强氧化性
B
向亚硫酸钠溶液中滴加足量盐酸,将反应产生的气体通入品红溶液中
品红溶液褪色
氯的非金属性比硫的非金属性强
C
向装有锌和稀硫酸的试管中滴加几滴溶液
气泡生成速率加快
是该反应的催化剂
D
取溶液于试管中,加入溶液,充分反应后滴入5滴溶液
溶液变为红色
与的反应有一定限度
A、A B、B C、C D、D13. 某反应分两步完成,其反应能量变化曲线如图所示。下列叙述正确的是( )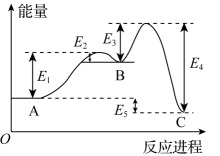 A、两步反应均为吸热反应 B、A与C的能量差为E4 C、三种物质中C最稳定 D、A→B的反应一定需要加热14. 常用作橡胶的硫化剂,能改变生橡胶遇冷变硬的性质。各原子最外层均达到8电子稳定结构,极易与水反应生成淡黄色沉淀和能使品红溶液裉色的气体。下列说法不正确的是( )A、中硫元素化合价是+1 B、的结构式是 C、与水反应时,氧化产物与还原产物的物质的量之比为 D、向中滴加溶液,有白色沉淀产生,则证明中含有15. 光催化固氮被认为是一种极具前景的人工固氮技术,光照条件下,在催化剂表面进行固氮反应的两种途径如图所示。下列说法不正确的是( )
A、两步反应均为吸热反应 B、A与C的能量差为E4 C、三种物质中C最稳定 D、A→B的反应一定需要加热14. 常用作橡胶的硫化剂,能改变生橡胶遇冷变硬的性质。各原子最外层均达到8电子稳定结构,极易与水反应生成淡黄色沉淀和能使品红溶液裉色的气体。下列说法不正确的是( )A、中硫元素化合价是+1 B、的结构式是 C、与水反应时,氧化产物与还原产物的物质的量之比为 D、向中滴加溶液,有白色沉淀产生,则证明中含有15. 光催化固氮被认为是一种极具前景的人工固氮技术,光照条件下,在催化剂表面进行固氮反应的两种途径如图所示。下列说法不正确的是( )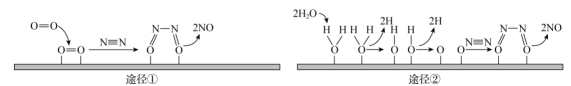 A、将大气中游离态的氮转化为氮的化合物的过程叫作氮的固定 B、途径②中,N2发生氧化反应 C、途径①和途径②发生反应的化学方程式相同 D、NO是含有极性共价键的共价化合物16. 一定温度下,将和充入容积为的恒容密闭容器中,发生反应 , 后,测得容器内的浓度减少了。下列叙述正确的是( )A、内,的平均反应速率为 B、时,容器内气体的总物质的量为 C、反应达到平衡前,随反应的进行,容器内压强逐渐减小 D、其他条件不变,增大的浓度,正反应速率增大,逆反应速率减小
A、将大气中游离态的氮转化为氮的化合物的过程叫作氮的固定 B、途径②中,N2发生氧化反应 C、途径①和途径②发生反应的化学方程式相同 D、NO是含有极性共价键的共价化合物16. 一定温度下,将和充入容积为的恒容密闭容器中,发生反应 , 后,测得容器内的浓度减少了。下列叙述正确的是( )A、内,的平均反应速率为 B、时,容器内气体的总物质的量为 C、反应达到平衡前,随反应的进行,容器内压强逐渐减小 D、其他条件不变,增大的浓度,正反应速率增大,逆反应速率减小二、非选择题:本题共3小题,共46分。
-
17. 现代社会中,人类的一切活动都离不开能量。化学反应中,不仅有新物质的生成,而且伴随着能量的变化,同时,化学电池也成为人类生产和生活的重要能量来源之一。回答下列问题:(1)、已知:键能是在标准状况下,将气态分子解离为气态原子所需的能量。请从断键和成键的角度分析下列反应中能量的变化。部分化学键的键能如表所示:
化学键
键能
436
496
463
反应 , 生成放出热量。
(2)、若将反应设计成如图所示的原电池装置,已知电极为负极,则电极的电极反应式为。 (3)、物质的类别和核心元素的化合价是研究物质性质的两个重要角度。硫及其部分化合物的“价类二维图”如图所示。
(3)、物质的类别和核心元素的化合价是研究物质性质的两个重要角度。硫及其部分化合物的“价类二维图”如图所示。
①将足量通入品红溶液中,溶液褪色,体现了的性;将足量通入溴水中,溶液褪色,体现了的性;气体和中,不能用的浓溶液干燥的是(填化学式)。
②欲制备 , 从氧化还原角度分析,下列选项中合理的是(填标号)。
A. B. C. D.
(4)、一定温度下,向某密闭容器中加入足量铁粉并充入一定量的气体,发生反应:。反应过程中和的浓度与时间的关系如图所示。
①时,正、逆反应速率的大小关系为(填“>”“<”或“=”)。
②内,的平均反应速率。
(5)、③下列条件的改变能加快其反应速率的是(填标号)。A.升高温度
B.增加铁粉的质量
C.保持压强不变,充入He使容器的容积增大
D.保持容积不变,充入He使体系压强增大
(6)、④下列能说明上述反应已达平衡状态的是(填标号)。A.
B.单位时间内生成的同时生成
C.容器中气体的压强不随时间变化而变化
D.容器中气体的平均相对分子质量不随时间变化而变化
18. 某研究性学习小组对实验室制取、收集、吸收,以及的还原性探究进行了如下实验设计。回答下列问题:(1)、Ⅰ.的收集和吸收若用图甲装置进行排空气法收集 , 气体应从(填“m”或“n”)口进入。
(2)、已知难溶于。图乙、丙、丁、戊四种装置中,不能用来吸收的是。 (3)、Ⅱ.的还原性探究
(3)、Ⅱ.的还原性探究利用如图所示装置,进行还原的反应。

已知:与反应生成和无毒气体 , 且不能被浓硫酸和碱石灰吸收。
采用装置作为制取的发生装置,写出该装置中发生反应的化学方程式:。
(4)、按气流方向,装置连接顺序为(填序号,每个装置只用一次)。装置连接后,首先应进行的操作是。(5)、实验结束时,应先熄灭(填“A”或“B”)装置的酒精灯。(6)、若称取 , 完全反应后,测得生成气体的体积为(标准状况下),通过计算推测中与反应的化学方程式为。19. 工业中很多重要的化工原料,如图中的苯、丙烯、有机物等都来源于石油化工,其中的产量可以用来衡量一个国家的石油化工发展水平。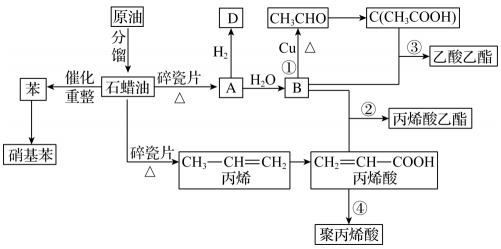
回答下列问题:
(1)、丙烯酸中含氧官能团的名称为 , B的结构简式为。(2)、写出下列反应的反应类型:③ , ④。(3)、有机物M含有4个碳原子,且与D互为同系物,写出M的所有同分异构体的结构简式:。(4)、下列说法正确的是(填标号)。a.除去乙酸乙酯中混有的乙酸,可加入NaOH溶液,静置,分液
b.聚丙烯酸不能使酸性高锰酸钾溶液褪色
c.有机物C与丙烯酸互为同系物
(5)、写出下列反应的化学方程式:① , ②。