浙江省嘉兴市2022-2023学年高一下学期期末考试化学试题
试卷更新日期:2023-08-04 类型:期末考试
一、选择题1(本大题共15小题,每小题2分,共30分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
-
1. 氮气的分子式是( )A、 B、 C、 D、He2. 按物质的组成进行分类,属于( )A、酸 B、碱 C、盐 D、氧化物3. 仪器名称为蒸发皿的是( )A、
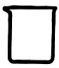 B、
B、 C、
C、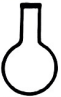 D、
D、 4. 下列物质能使湿润的蓝色石蕊试纸先变红后褪色的是( )A、 B、 C、HCl D、5. 下列物质属于电解质的是( )A、溶液 B、 C、Cu D、熔融NaCl6. 反应中,氧化剂是( )A、 B、C C、 D、CO7. 下列不能产生丁达尔效应的分散系是( )A、雾 B、有色玻璃 C、溶液 D、墨水8. 下列表示正确的是( )A、的离子结构示意图:
4. 下列物质能使湿润的蓝色石蕊试纸先变红后褪色的是( )A、 B、 C、HCl D、5. 下列物质属于电解质的是( )A、溶液 B、 C、Cu D、熔融NaCl6. 反应中,氧化剂是( )A、 B、C C、 D、CO7. 下列不能产生丁达尔效应的分散系是( )A、雾 B、有色玻璃 C、溶液 D、墨水8. 下列表示正确的是( )A、的离子结构示意图: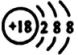 B、乙酸的结构式:
C、的空间填充模型:
B、乙酸的结构式:
C、的空间填充模型: D、的电子式:
9. 下列说法正确的是( )A、葡萄糖和蔗糖互为同分异构体 B、和互为同系物 C、、互为同素异形体 D、
D、的电子式:
9. 下列说法正确的是( )A、葡萄糖和蔗糖互为同分异构体 B、和互为同系物 C、、互为同素异形体 D、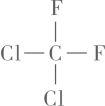 和
和 是同一种物质
10. 下列叙述不正确的是( )A、纯铝的硬度和强度较大,适合制造机器零件 B、钾钠合金室温下呈液态,可用作核反应堆的传热介质 C、碳酸钠、碳酸氢钠的水溶液均呈碱性,可用作食用碱或工业用碱 D、食品中添加适量的二氧化硫可以起到漂白、防腐和抗氧化等作用11. 短周期元素X、Y、Z、W在元素周期表中的相对位置如下表所示,其中Z元素的最外层电子数是电子层数的2倍。下列说法正确的是( )
是同一种物质
10. 下列叙述不正确的是( )A、纯铝的硬度和强度较大,适合制造机器零件 B、钾钠合金室温下呈液态,可用作核反应堆的传热介质 C、碳酸钠、碳酸氢钠的水溶液均呈碱性,可用作食用碱或工业用碱 D、食品中添加适量的二氧化硫可以起到漂白、防腐和抗氧化等作用11. 短周期元素X、Y、Z、W在元素周期表中的相对位置如下表所示,其中Z元素的最外层电子数是电子层数的2倍。下列说法正确的是( )X
Y
Z
W
A、原子半径:W>Z>Y B、X的氢化物的沸点比Y的氢化物低 C、X和Z可以形成 D、氧化物对应水化物的酸性:W>Z12. 下列方程式书写不正确的是( )A、硫酸氢钠在水中的电离方程式: B、向氯化铝溶液中加入足量氨水的离子方程式: C、氯化铁溶液腐蚀铜板的离子方程式: D、甲烷和氯气在光照条件下生成气态有机物的化学方程式:13. 某化学兴趣小组设计如下装置(棉花球沾有无水硫酸铜粉末)进行实验,证明热稳定性比强。下列说法不正确的是( )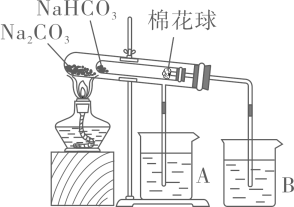 A、处的温度高于处的温度 B、加热一段时间后,棉花球处变蓝色 C、实验结束时,应先移开烧杯A、B,再熄灭酒精灯 D、烧杯A、B中均盛放NaOH溶液14. 下列说法不正确的是( )A、聚乙烯不能使酸性高锰酸钾溶液褪色 B、煤的干馏是将煤隔绝空气加强热使之分解的过程 C、淀粉和纤维素都能在人体内发生水解 D、油脂在酸性条件下水解获得高级脂肪酸和甘油15. 下列说法不正确的是( )A、用化学沉淀法去除粗盐中的、、 , 依次加入过量的NaOH、、溶液 B、如果不慎将碱沾到皮肤上,应立即用大量水冲洗,然后涂上1%的硼酸 C、用容量瓶配制溶液,定容时若加水不慎超过了刻度线,则需要重新配制 D、通过装有饱和碳酸氢钠溶液的洗气瓶可除去中混有的
A、处的温度高于处的温度 B、加热一段时间后,棉花球处变蓝色 C、实验结束时,应先移开烧杯A、B,再熄灭酒精灯 D、烧杯A、B中均盛放NaOH溶液14. 下列说法不正确的是( )A、聚乙烯不能使酸性高锰酸钾溶液褪色 B、煤的干馏是将煤隔绝空气加强热使之分解的过程 C、淀粉和纤维素都能在人体内发生水解 D、油脂在酸性条件下水解获得高级脂肪酸和甘油15. 下列说法不正确的是( )A、用化学沉淀法去除粗盐中的、、 , 依次加入过量的NaOH、、溶液 B、如果不慎将碱沾到皮肤上,应立即用大量水冲洗,然后涂上1%的硼酸 C、用容量瓶配制溶液,定容时若加水不慎超过了刻度线,则需要重新配制 D、通过装有饱和碳酸氢钠溶液的洗气瓶可除去中混有的二、选择题Ⅱ(本大题共10小题,每小题3分.共30分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
-
16. 根据能量变化示意图,下列说法正确的是( )
 A、反应 , 反应物的总能量小于生成物的总能量 B、可推测,断开1 mol O-H键共放出463 kJ能量 C、1 mol 分解生成和吸收484 kJ能量 D、和生成2 mol 放出的能量大于484 kJ17. 锌-空气电池(装置如图所示),放电总反应式为 , 该电池工作时,下列说法不正确的是( )
A、反应 , 反应物的总能量小于生成物的总能量 B、可推测,断开1 mol O-H键共放出463 kJ能量 C、1 mol 分解生成和吸收484 kJ能量 D、和生成2 mol 放出的能量大于484 kJ17. 锌-空气电池(装置如图所示),放电总反应式为 , 该电池工作时,下列说法不正确的是( )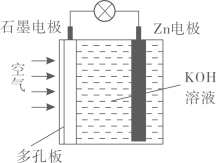 A、负极的电极反应式为 B、电子由Zn电极经导线流向石墨电极 C、该电池放电时向Zn电极移动 D、多孔电极有利于增大接触面积和氧气扩散18. 下列说法不正确的是( )A、依据物质类别和元素价态,可以解释和预测物质的性质 B、金属钠不能保存在石蜡中,以免两者相互反应产生氢气发生爆炸 C、技术员用铬酸氧化法对金属铝表面处理,为了增加膜的厚度和美丽的色彩 D、测试工程师利用化学仪器或化学检测方法测定材料的元素组成及含量19. 下列说法不正确的是( )A、分子中既有极性键也有非极性键 B、NaOH、溶于水均克服离子键 C、、中所有原子最外层都满足8电子稳定结构 D、熔融时能导电的化合物一定是离子化合物20. 化学与人类社会生活、生产环境密切相关。下列说法不正确的是( )A、维生素C可用作食品的防腐剂 B、工业上常用电解熔融的氯化镁制取金属镁 C、原子经济性反应就是反应物的原子全部转化为期望的最终产物 D、75%的酒精和84消毒液都可使新冠病毒变性而失活21. NA是阿伏加德罗常数的值,下列说法正确的是( )A、25℃,101 kPa时,22.4 L 中含有的原子数小于 B、32 g甲醇分子中含有C-H键的数目为 C、1 L 1 mol⋅L盐酸中,HCl分子的数目为 D、密闭容器中,2 mol 和1 mol 催化反应后分子总数为22. 反应 , 在200℃和℃时,X的物质的量浓度(单位:mol·L)
A、负极的电极反应式为 B、电子由Zn电极经导线流向石墨电极 C、该电池放电时向Zn电极移动 D、多孔电极有利于增大接触面积和氧气扩散18. 下列说法不正确的是( )A、依据物质类别和元素价态,可以解释和预测物质的性质 B、金属钠不能保存在石蜡中,以免两者相互反应产生氢气发生爆炸 C、技术员用铬酸氧化法对金属铝表面处理,为了增加膜的厚度和美丽的色彩 D、测试工程师利用化学仪器或化学检测方法测定材料的元素组成及含量19. 下列说法不正确的是( )A、分子中既有极性键也有非极性键 B、NaOH、溶于水均克服离子键 C、、中所有原子最外层都满足8电子稳定结构 D、熔融时能导电的化合物一定是离子化合物20. 化学与人类社会生活、生产环境密切相关。下列说法不正确的是( )A、维生素C可用作食品的防腐剂 B、工业上常用电解熔融的氯化镁制取金属镁 C、原子经济性反应就是反应物的原子全部转化为期望的最终产物 D、75%的酒精和84消毒液都可使新冠病毒变性而失活21. NA是阿伏加德罗常数的值,下列说法正确的是( )A、25℃,101 kPa时,22.4 L 中含有的原子数小于 B、32 g甲醇分子中含有C-H键的数目为 C、1 L 1 mol⋅L盐酸中,HCl分子的数目为 D、密闭容器中,2 mol 和1 mol 催化反应后分子总数为22. 反应 , 在200℃和℃时,X的物质的量浓度(单位:mol·L)随时间变化的有关实验数据见下表:
时间/min
0
2
4
6
8
10
200℃
1.60
1.10
0.70
0.40
0.30
0.30
t℃
2.00
1.30
0.70
0.36
0.36
0.36
下列有关该反应的描述正确的是( )
A、在200℃时,4 min内用Y表示的化学反应速率为 B、t℃下,6 min时反应刚好达到平衡状态 C、根据上表内X的浓度变化,可知浓度越大,反应速率越大 D、从表中可以看出23. “空气吹出法”是工业上常用的一种海水提溴技术,流程图如下。下列说法不正确的是( )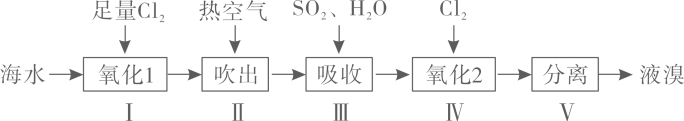 A、步骤Ⅱ→步骤Ⅲ,达到了富集溴的目的 B、步骤Ⅱ用热空气吹出溴,利用了溴的易挥发性 C、步骤Ⅲ发生反应的离子方程式为 D、步骤V用蒸馏法分离出液溴24. 酸性高锰酸钾溶液可用于测定室内空气甲醛含量,发生的反应为: , 将室内空气通入20 mL mol⋅L酸性溶液中,当通入10 L空气时,溶液恰好变为无色(假定空气中无其它还原性气体,甲醛可被溶液完全吸收),则室内空气中甲醛的浓度(单位:mg/L)为( )A、 B、 C、 D、25. 根据实验操作和现象得出的结论正确的是( )
A、步骤Ⅱ→步骤Ⅲ,达到了富集溴的目的 B、步骤Ⅱ用热空气吹出溴,利用了溴的易挥发性 C、步骤Ⅲ发生反应的离子方程式为 D、步骤V用蒸馏法分离出液溴24. 酸性高锰酸钾溶液可用于测定室内空气甲醛含量,发生的反应为: , 将室内空气通入20 mL mol⋅L酸性溶液中,当通入10 L空气时,溶液恰好变为无色(假定空气中无其它还原性气体,甲醛可被溶液完全吸收),则室内空气中甲醛的浓度(单位:mg/L)为( )A、 B、 C、 D、25. 根据实验操作和现象得出的结论正确的是( )选项
实验操作和现象
结论
A
用光洁无锈的铁丝取无色溶液在灯焰上灼烧,火焰呈黄色
溶液中一定含有 , 不含有
B
向溶液中滴加适量盐酸,产生气泡
氯元素的非金属性大于碳
C
检验铁与水蒸气高温反应后所得固体中是否含有二价铁,取少量所得固体溶于稀硫酸,再加入少量酸性溶液,紫色褪去
铁与水蒸气反应后的固体产物中有+2价的铁元素
D
向试管中加入淀粉溶液和稀硫酸,加热3~5 min,冷却后加入碘水,溶液未变蓝
淀粉已完全水解
A、A B、B C、C D、D三、非选择题(本大题共5小题,共40分)
-
26. 请回答:(1)、的电子式是;乙烯的结构式是 .(2)、证明集气瓶中的无色气体是氨气的实验操作是 .(3)、将Al片放入NaOH溶液中,写出反应的离子方程式 .27. 已知烃A在标准状况下的密度为1.16 g⋅L , B能发生银镜反应,E天然存在于菠萝等水果中。以A和CO为原料制取有机物E的流程如下:
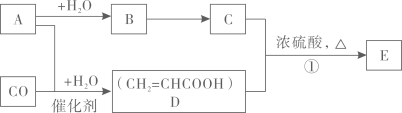
请回答:
(1)、B的结构简式是;C中所含官能团的名称是 .(2)、关于物质D()的化学性质,下列说法正确的是____.A、D是不饱和烃,能发生加成反应而使酸性高锰酸钾溶液褪色 B、用溶液可以鉴别 C、D和乙酸互为同系物 D、等物质的量的C和D完全燃烧消耗的量相等(3)、反应①的反应机理与制取乙酸乙酯相似,写出其化学方程式 .28. 盐A由三种元素组成,其中一种为常见金属元素,某化学研究小组按如下流程图探究其组成:
混合气体B已经折算成标况下的体积。
请回答:
(1)、组成盐A的三种元素是O和(写元素符号)。(2)、混合气体B的组成成分为 .(3)、检验溶液E中阳离子的方法是 .(4)、盐A隔绝空气加热反应的化学方程式是 .29. 如图所示是制取无水氯化铜的实验装置图,将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中,请回答:
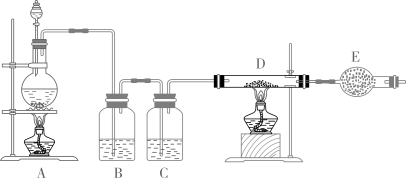 (1)、仪器E的名称是。(2)、装置B中盛放的试剂是:装置C的作用是 .(3)、装置A中浓盐酸与二氧化锰反应的离子方程式是 .(4)、用简单实验验证D中的单质铜是否完全反应 .30. 现有一份部分被氧化的铜片(氧化产物为CuO),称取8.64 g该铜片,溶于280 mL 1.00 mol⋅L稀硝酸中,反应恰好完全进行,收集到无色气体896 mL(已折算为标准状况)。(1)、该稀硝酸中所含硝酸的物质的量为 .(2)、8.64 g铜片中CuO的质量为 .(3)、该铜片中, .
(1)、仪器E的名称是。(2)、装置B中盛放的试剂是:装置C的作用是 .(3)、装置A中浓盐酸与二氧化锰反应的离子方程式是 .(4)、用简单实验验证D中的单质铜是否完全反应 .30. 现有一份部分被氧化的铜片(氧化产物为CuO),称取8.64 g该铜片,溶于280 mL 1.00 mol⋅L稀硝酸中,反应恰好完全进行,收集到无色气体896 mL(已折算为标准状况)。(1)、该稀硝酸中所含硝酸的物质的量为 .(2)、8.64 g铜片中CuO的质量为 .(3)、该铜片中, .