浙江省金华市十校2022-2023学年高一下学期期末调研考试化学试卷
试卷更新日期:2023-08-04 类型:期末考试
一、单选题
-
1. 下列物质属于盐的是( )A、Ca(OH)2 B、CuSO4 C、Na2O D、HNO32. 仪器名称为“容量瓶”的是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列物质的俗称与化学式对应不正确的是( )A、小苏打— B、明矾— C、磁性氧化铁— D、漂白精有效成分—4. 下列物理量单位不正确的是( )A、物质的量:mol B、摩尔质量: C、气体摩尔体积: D、阿伏加德罗常数:5. 冬奥会开幕式上,绚烂的烟火表演给各国运动健儿留下了深刻的印象,让北京奥运会开幕式更加辉煌、浪漫。其中,焰火与高中化学中“焰色试验”知识相关。下列说法中正确的是( )A、焰色试验是化学变化 B、可用稀硫酸清洗过的铂丝做焰色试验 C、焰色试验均应透过蓝色钴玻璃观察 D、利用焰色试验可区分NaCl与KCl6. 当光束通过下列分散系时,能观察到丁达尔效应的是( )A、黄山云雾 B、稀 C、乙醇溶液 D、7. 实现下列物质之间的转化,需要加入氧化剂才能实现的是( )A、Fe→FeCl2 B、SO3→H2SO4 C、ClO →Cl2 D、CO2→C8. 下列化学用语表示正确的是( )A、氢气的结构式为:
3. 下列物质的俗称与化学式对应不正确的是( )A、小苏打— B、明矾— C、磁性氧化铁— D、漂白精有效成分—4. 下列物理量单位不正确的是( )A、物质的量:mol B、摩尔质量: C、气体摩尔体积: D、阿伏加德罗常数:5. 冬奥会开幕式上,绚烂的烟火表演给各国运动健儿留下了深刻的印象,让北京奥运会开幕式更加辉煌、浪漫。其中,焰火与高中化学中“焰色试验”知识相关。下列说法中正确的是( )A、焰色试验是化学变化 B、可用稀硫酸清洗过的铂丝做焰色试验 C、焰色试验均应透过蓝色钴玻璃观察 D、利用焰色试验可区分NaCl与KCl6. 当光束通过下列分散系时,能观察到丁达尔效应的是( )A、黄山云雾 B、稀 C、乙醇溶液 D、7. 实现下列物质之间的转化,需要加入氧化剂才能实现的是( )A、Fe→FeCl2 B、SO3→H2SO4 C、ClO →Cl2 D、CO2→C8. 下列化学用语表示正确的是( )A、氢气的结构式为: B、镁原子的结构示意图:
B、镁原子的结构示意图: C、在水溶液中的电离方程式为:
D、用电子式表示的形成过程:
C、在水溶液中的电离方程式为:
D、用电子式表示的形成过程: 9. 下列物质中,只含有离子键的化合物是( )A、 B、 C、 D、10. 下列有关实验安全的叙述不正确的是( )A、实验室把钠保存在石蜡油或煤油中 B、当钠燃烧可以用泡沫灭火器来灭火 C、GHS标准符号示意
9. 下列物质中,只含有离子键的化合物是( )A、 B、 C、 D、10. 下列有关实验安全的叙述不正确的是( )A、实验室把钠保存在石蜡油或煤油中 B、当钠燃烧可以用泡沫灭火器来灭火 C、GHS标准符号示意 “爆炸类物质”
D、实验时不慎将酸沾到皮肤上,应立即用大量水冲洗,然后用3%~5% 溶液冲洗
11. 下列反应的离子方程式或方程式书写正确的是( )A、稀硫酸与溶液反应: B、钠与水反应的离子方程式: C、溶液中滴加少量稀盐酸: D、溶液中滴入少量溶液:12. 下列各组离子中能在水溶液中大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、13. 下列几种类推结论符合事实的是( )A、沸点HBr>HCl,则同族元素氢化物沸点HCl>HF B、氯水可以将氧化至 , 则碘水也可以将氧化至 C、与反应只生成和 , 则与反应也只生成和 D、为碱性氧化物能与酸反应;CaO也能与酸反应生成盐和水,则CaO为碱性氧化物14. 某学生以铁丝和为原料进行下列三个实验。下列选项正确的是( )
“爆炸类物质”
D、实验时不慎将酸沾到皮肤上,应立即用大量水冲洗,然后用3%~5% 溶液冲洗
11. 下列反应的离子方程式或方程式书写正确的是( )A、稀硫酸与溶液反应: B、钠与水反应的离子方程式: C、溶液中滴加少量稀盐酸: D、溶液中滴入少量溶液:12. 下列各组离子中能在水溶液中大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、13. 下列几种类推结论符合事实的是( )A、沸点HBr>HCl,则同族元素氢化物沸点HCl>HF B、氯水可以将氧化至 , 则碘水也可以将氧化至 C、与反应只生成和 , 则与反应也只生成和 D、为碱性氧化物能与酸反应;CaO也能与酸反应生成盐和水,则CaO为碱性氧化物14. 某学生以铁丝和为原料进行下列三个实验。下列选项正确的是( )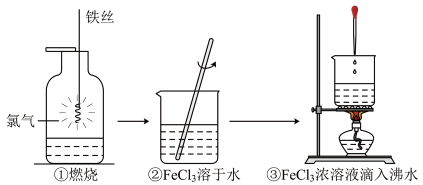 A、实验②中玻璃棒的作用是引流 B、实验①、③反应制得的物质均为纯净物 C、实验③化学方程式为: D、实验①中的反应既是氧化还原反应,又是四种基本反应类型中的化合反应15. 短周期元素X、Y、Z、W在元素周期表中的位置关系如图,若Y原子的最外层电子数是内层电子数的3倍,则下列说法正确的是( )
A、实验②中玻璃棒的作用是引流 B、实验①、③反应制得的物质均为纯净物 C、实验③化学方程式为: D、实验①中的反应既是氧化还原反应,又是四种基本反应类型中的化合反应15. 短周期元素X、Y、Z、W在元素周期表中的位置关系如图,若Y原子的最外层电子数是内层电子数的3倍,则下列说法正确的是( )X
Y
Z
W
A、原子半径:r(W)>r(Z)>r(Y)>r(X) B、四种元素的常见单质中,Z单质的熔、沸点最高 C、最高价氧化物对应水化物的酸性:Z>W>X D、W的简单阴离子的还原性强于Z的简单阴离子的还原性16. 下列说法不正确的是( )A、屠呦呦因发现抗疟疾青蒿素,而获得诺贝尔生理学或医学奖 B、英国科学家道尔顿提出原子学说,为近代化学的发展奠定了基础 C、俄国科学家门捷列夫发现了元素周期律,使得化学的研究有规律可循 D、戴维发现一种黄绿色气体,舍勒确定该气体为氯气17. 下列叙述中不正确的是( )A、铁与水蒸气发生反应,因此钢水注入模具前,模具先要进行干燥处理 B、在元素周期表中金属与非金属的分界线附近,可以找到制造农药的元素 C、在一定物质的量浓度溶液配制中,定容时俯视,导致所配制溶液浓度偏大 D、我们可以用半透膜来实现分离胶体18. 据报道、德国科学家实现了铷(Rb)原子气体超流体态与绝缘态的可逆转换,该成果将给量子计算机的研究带来重大突破。已知铷在元素周期表中位于第五周期ⅠA族。下列说法不正确的是( )A、铷的原子序数为37 B、铷放到水中会比钠跟水反应更剧烈 C、铷的氧化物暴露在空气中易与反应 D、铷氢氧化物是弱碱19. 下列说法不正确的是( )A、易分解是因为共价键作用力弱 B、离子键就是使阴、阳离子结合成化合物的静电引力 C、二氧化碳分子中碳原子和氧原子最外电子层都具有8电子的稳定结构 D、NaOH晶体既有离子键,又有极性共价键20. 下图为NaCl固体在水中溶解和电离的示意图。下列说法不正确的是( ) A、NaCl固体不导电,因为NaCl固体中无自由移动的阴阳离子 B、和在水中是以水合离子的形式存在 C、NaCl固体在水中溶解和电离的过程破坏了离子键 D、该过程通常表示为21. 用下列实验装置进行相应实验,装置正确且能达到相应实验目的的是( )
A、NaCl固体不导电,因为NaCl固体中无自由移动的阴阳离子 B、和在水中是以水合离子的形式存在 C、NaCl固体在水中溶解和电离的过程破坏了离子键 D、该过程通常表示为21. 用下列实验装置进行相应实验,装置正确且能达到相应实验目的的是( ) A、用甲装置测定的浓度 B、用乙装置配制100mL一定物质的量浓度的硫酸溶液 C、用丙装置均匀制取纯净的二氧化碳气体 D、用丁装置进行铁与水蒸气的反应,点燃肥皂泡检验氢气22. 为阿伏加德罗常数的值,下列说法不正确的是( )A、18g的中含有的电子是10 B、个氧分子与个氢分子的质量比为16∶1 C、32g硫在足量的氧气中完全燃烧,转移电子数为4 D、质量为3.0g的和混合物中含有中子数为1.623. 某溶液可能含有下列离子中的若干种: , 所含离子的物质的量浓度均相同。为了确定该溶液的组成,进行如下实验:
A、用甲装置测定的浓度 B、用乙装置配制100mL一定物质的量浓度的硫酸溶液 C、用丙装置均匀制取纯净的二氧化碳气体 D、用丁装置进行铁与水蒸气的反应,点燃肥皂泡检验氢气22. 为阿伏加德罗常数的值,下列说法不正确的是( )A、18g的中含有的电子是10 B、个氧分子与个氢分子的质量比为16∶1 C、32g硫在足量的氧气中完全燃烧,转移电子数为4 D、质量为3.0g的和混合物中含有中子数为1.623. 某溶液可能含有下列离子中的若干种: , 所含离子的物质的量浓度均相同。为了确定该溶液的组成,进行如下实验:①取100 mL上述溶液,加入过量溶液,反应后将沉淀过滤、洗涤、干燥,得白色沉淀;
②向沉淀中加入过量的盐酸,白色沉淀部分溶解,并有气体生成。
下列说法正确的是( )
A、气体可能是或 B、溶液中一定存在 C、溶液中可能存在和 , 一定不存在和 D、在第①步和第②步的滤液中分别加入硝酸酸化的硝酸银溶液,都能生成白色沉淀二、多选题
-
24. 下列说法不正确的是( )A、与考古中常用到的互称为同位素 B、金刚石、石墨和都是碳元素的同素异形体 C、钌(Ru)在室温下有独特磁性,其核素符号为 , 则其中子数为44 D、合金的性能可以通过所添加的合金元素的种类、含量和生成合金的条件等加以调节25. 电子工业常用溶液腐蚀覆铜板上的铜箔,制造印刷电路板。从腐蚀废液(主要含、、)中回收铜,并重新获得溶液,处理流程如下:

下列说法不正确的是( )
A、溶液腐蚀铜箔的原理为 B、反应1和反应2都发生了氧化还原反应 C、实验室中进行操作1时,用到的主要玻璃仪器有漏斗、烧杯和玻璃棒 D、滤渣a的主要成分是Cu和Fe,物质X可以选用酸性溶液三、填空题
-
26. 按要求完成下列填空:(1)、下列给定的物质中:①NaCl晶体;②;③镁条;④氨气;⑤液态的HCl。属于非电解质的是(填编号)。(2)、写出金属锂投入水中反应的化学方程式:。(3)、比较稳定性:(填“>”、“<”、“=”)。27. 如图为元素周期表的一部分,请参考元素①~⑩在表中的位置,用化学式回答问题:
族
周期
ⅠA
0
1
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
①
2
②
③
④
3
⑤
⑥
⑦
⑧
⑨
⑩
(1)、铝元素在周期表中的位置是。(2)、写出在该元素周期表中属于卤族元素的序号,并写出其离子的结构示意图。(3)、元素⑧、⑨、⑩的最高价含氧酸的酸性由弱到强的顺序为。(4)、⑤在空气中加热燃烧后产物,既含离子键又含非极性共价键的离子化合物,写出该产物的电子式为;写出⑥的最高价氧化物与⑤的最高价氧化物对应的水化物反应的离子方程式。(5)、已知X为第ⅡA族元素(前四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,写出Y的原子序数b=(用含a的代数式表示)。四、实验题
-
28. 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备和NaClO。已知:氯气和碱反应在室温下生成氯化物和次氯酸盐,温度升高时主要产物是氯化物和氯酸盐,氯气和碱的反应释放热量。
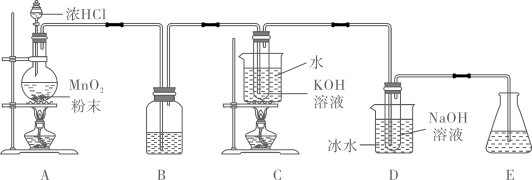
回答下列问题:
(1)、实验中盛放粉末的装置名称是。(2)、装置A中产生氯气的化学方程式是。(3)、装置D中发生反应的离子反应式是。(4)、装置D中冰水的作用是。(5)、在下列试剂中可选用加入装置E的最佳试剂是____(填标号)。A、KI溶液 B、饱和食盐水 C、溶液 D、浓(6)、探究KClO3、NaClO的氧化能力
操作:向1号和2号试管中,滴加中性KI溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力NaClO。(填“大于”或“小于”)
29. 固体化合物A含三种元素,为探究其组成实验如图: (1)、A的化学式为。(2)、D溶液暴露在空气中颜色逐渐变黄,写出该过程的离子方程式。(3)、设计一个实验方案验证溶液D中的金属阳离子。30. 某研究小组探究金属Na与反应。
(1)、A的化学式为。(2)、D溶液暴露在空气中颜色逐渐变黄,写出该过程的离子方程式。(3)、设计一个实验方案验证溶液D中的金属阳离子。30. 某研究小组探究金属Na与反应。 (1)、用如图所示装置及药品制取打开弹簧夹制取。为了得到干燥纯净的 , 产生的气流应依次通过盛有、的洗气瓶。收集满后关闭弹簧夹,可观察到的现象是。(2)、将一小块Na在燃烧匙中点燃,迅速伸入充满的集气瓶中。发现Na继续燃烧产生大量白烟,集气瓶底部有黑色固体产生瓶壁上有白色物质。取该白色物质溶于水滴加澄清石灰水,出现浑浊。据此写出Na与反应的化学方程式 , 该反应体现了钠的性。(3)、用如图所示装置进一步检验黑色固体与浓硫酸反应的产物装置②中无水硫酸铜的作用是 , 装置⑤中品红溶液的作用是。
(1)、用如图所示装置及药品制取打开弹簧夹制取。为了得到干燥纯净的 , 产生的气流应依次通过盛有、的洗气瓶。收集满后关闭弹簧夹,可观察到的现象是。(2)、将一小块Na在燃烧匙中点燃,迅速伸入充满的集气瓶中。发现Na继续燃烧产生大量白烟,集气瓶底部有黑色固体产生瓶壁上有白色物质。取该白色物质溶于水滴加澄清石灰水,出现浑浊。据此写出Na与反应的化学方程式 , 该反应体现了钠的性。(3)、用如图所示装置进一步检验黑色固体与浓硫酸反应的产物装置②中无水硫酸铜的作用是 , 装置⑤中品红溶液的作用是。
五、计算题
-
31. 将一定质量的Mg和Al混合物投入400mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。
 (1)、原混合物中Mg和Al的质量之比为。(2)、加入NaOH溶液的物质的量浓度为。(3)、稀硫酸的物质的量浓度为。
(1)、原混合物中Mg和Al的质量之比为。(2)、加入NaOH溶液的物质的量浓度为。(3)、稀硫酸的物质的量浓度为。