广东省四校2022-2023学年高二下学期期末联考化学试题
试卷更新日期:2023-08-04 类型:期末考试
一、单项选择题(本题共16小题,共44分,每题只有1项符合题意。第1~10小题,每小题2分;第11~16小题,每小题4分。)
-
1. 高分子材料在科学技术、生产生活等领域都发挥着重要作用。下列材料的主要成分不属于有机高分子的是( )A、聚乳酸吸管 B、医用聚乙烯防护服 C、石墨烯 D、一次性医用口罩2. 下列属于烃的衍生物的是( )A、甲烷 B、甲苯 C、乙烯 D、甘油3. 下列能发生加成和消去反应的是( )A、
 B、
B、 C、
D、
4. 关于反应 , 下列说法中,正确的是( )A、一定是自发反应 B、升高温度,平衡常数增大 C、增大压强,正反应速率增大 D、催化剂不参与该反应过程5. 某基态原子核外电子排布式为。下列说法错误的是( )A、原子核外有3个电子层 B、价电子数为4 C、处于第三周期VIA族 D、属于p区元素6. 下列有关微粒性质的排序中,错误的是( )A、元素的电负性: B、元素的第一电离能: C、离子半径: D、基态原子的未成对电子数:7. 下列物质的变化,仅破坏范德华力的是( )A、碘单质的升华 B、溶于水 C、将液态水加热变为水蒸气 D、受热8. 下列实验事实中,与氢键无关的是( )A、水结冰体积变大 B、的热稳定性比强 C、乙醇与水互溶 D、邻羟基苯甲醛的沸点低于对羟基苯甲醛9. 当下列物质以晶体形式存在时,所属晶体类型相同的是( )A、、 B、、 C、、 D、、10. 酶生物燃料电池依靠氧化还原酶将人体汗液中的生物燃料——乳酸()转化为丙酮酸(),有希望为可穿戴电子设备提供动力。该电池放电时,下列说法正确的是( )A、将电能转化为化学能 B、电子移动方向:正极→汗液→负极 C、正极上发生氧化反应 D、乳酸在负极上失去电子11. “奥司他韦”是一种治疗新冠病毒肺炎的药物,结构如图所示。下列说法正确的是( )
C、
D、
4. 关于反应 , 下列说法中,正确的是( )A、一定是自发反应 B、升高温度,平衡常数增大 C、增大压强,正反应速率增大 D、催化剂不参与该反应过程5. 某基态原子核外电子排布式为。下列说法错误的是( )A、原子核外有3个电子层 B、价电子数为4 C、处于第三周期VIA族 D、属于p区元素6. 下列有关微粒性质的排序中,错误的是( )A、元素的电负性: B、元素的第一电离能: C、离子半径: D、基态原子的未成对电子数:7. 下列物质的变化,仅破坏范德华力的是( )A、碘单质的升华 B、溶于水 C、将液态水加热变为水蒸气 D、受热8. 下列实验事实中,与氢键无关的是( )A、水结冰体积变大 B、的热稳定性比强 C、乙醇与水互溶 D、邻羟基苯甲醛的沸点低于对羟基苯甲醛9. 当下列物质以晶体形式存在时,所属晶体类型相同的是( )A、、 B、、 C、、 D、、10. 酶生物燃料电池依靠氧化还原酶将人体汗液中的生物燃料——乳酸()转化为丙酮酸(),有希望为可穿戴电子设备提供动力。该电池放电时,下列说法正确的是( )A、将电能转化为化学能 B、电子移动方向:正极→汗液→负极 C、正极上发生氧化反应 D、乳酸在负极上失去电子11. “奥司他韦”是一种治疗新冠病毒肺炎的药物,结构如图所示。下列说法正确的是( ) A、奥司他韦分子中存在手性碳原子 B、该分子中含氮官能团的名称为氨基 C、该分子中碳原子的杂化方式有、、
A、奥司他韦分子中存在手性碳原子 B、该分子中含氮官能团的名称为氨基 C、该分子中碳原子的杂化方式有、、D一定条件下,1mol该物质最多与1mol NaOH发生反应
12. 下列有关装置与操作的描述,正确的是( ) A、装置A中液面读数为11.8mL B、装置B可以准确测定中和热 C、使用装置C分离水与碘的溶液 D、使用装置D制备并收集乙酸乙酯13. 关于下列三种常见高分子材料的说法正确的是( )
A、装置A中液面读数为11.8mL B、装置B可以准确测定中和热 C、使用装置C分离水与碘的溶液 D、使用装置D制备并收集乙酸乙酯13. 关于下列三种常见高分子材料的说法正确的是( ) A、酚醛树脂、涤纶和顺丁橡胶都属于天然高分子材料 B、酚醛树脂的单体是苯酚和甲醇 C、涤纶是对苯二甲酸和乙二醇通过缩聚反应得到的 D、顺丁橡胶的单体与反-2-丁烯互为同分异构体14. 下列实验设计正确且能达到对应实验目的的是( )
A、酚醛树脂、涤纶和顺丁橡胶都属于天然高分子材料 B、酚醛树脂的单体是苯酚和甲醇 C、涤纶是对苯二甲酸和乙二醇通过缩聚反应得到的 D、顺丁橡胶的单体与反-2-丁烯互为同分异构体14. 下列实验设计正确且能达到对应实验目的的是( )选项
实验设计
实验目的
A
将醋酸与混合产生的气体直接通入苯酚钠溶液中
证明酸性:碳酸>苯酚
B
将铜丝灼烧后插入乙醇中,反复几次,取反应后的溶液滴入酸性高锰酸钾溶液中
检验乙醇被催化氧化生成的乙醛
C
将装有同浓度、同体积溶液的两试管分别置于冷水和热水中,再同时向两支试管中加入溶液,振荡
探究温度对化学反应速率的影响
D
向NaOH溶液中加3滴溶液,再加入3滴溶液
证明沉淀可以转化为沉淀
A、A B、B C、C D、D15. 已知反应Ⅰ:
 。标准状态下,由最稳定的单质合成1mol某物质的焓变叫做该物质的标准摩尔生成焓。气态环戊二烯(
。标准状态下,由最稳定的单质合成1mol某物质的焓变叫做该物质的标准摩尔生成焓。气态环戊二烯( )的标准摩尔生成焓为 , 则气态环戊烯(
)的标准摩尔生成焓为 , 则气态环戊烯( )的标准摩尔生成焓为( ) A、 B、 C、 D、16. 常温下,用的盐酸分别滴定20.00mL浓度均为的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是( )
)的标准摩尔生成焓为( ) A、 B、 C、 D、16. 常温下,用的盐酸分别滴定20.00mL浓度均为的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是( ) A、的NaX溶液中: B、三种一元弱酸的电离常数: C、当时,三种溶液中: D、分别滴加20.00mL盐酸后,再将三种溶液混合:
A、的NaX溶液中: B、三种一元弱酸的电离常数: C、当时,三种溶液中: D、分别滴加20.00mL盐酸后,再将三种溶液混合:二、非选择题:本题共4小题,共56分。
-
17. 电镀实验在生产生活中应用广泛。(1)、
Ⅰ.某实验小组设计了如图在纽扣上电镀铜的实验装置:
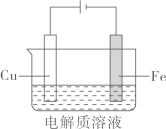
如图中,石墨是(填阴极或阳极),对应的电极方程式为:;如图装置电解一段时间后,溶液中(填微粒化学式)浓度下降,从而影响镀铜的速率和质量。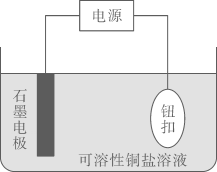 (2)、Ⅱ.实验小组利用如图装置进行铁上电镀铜的实验探究:
(2)、Ⅱ.实验小组利用如图装置进行铁上电镀铜的实验探究:装置示意图
序号
电解质溶液
实验现象
①
0.1mol/L+少量
阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验,铁电极表面有生成。
②
0.1mol/L+过量氨水
阴极表面未观察到气体,一段时间后阴极表面有致密红色固体,经检验,电解液中无Fe元素。
实验①中,无色气体产生的原因是或。
(3)、实验①中,气体减少,推测是由于溶液中减少,且。(4)、欲测定实验①溶液中的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线时,改用胶头滴管滴加蒸馏水至溶液的 , 用标准溶液滴定时应选用滴定管(填“酸式”或“碱式”)。(5)、为确定实验①电解质溶液中的准确浓度 , 实验操作为:准确量取含有的溶液于带塞锥形瓶中,调节溶液 , 加入过量的 , 用标准溶液滴定至终点,消耗溶液。上述过程中反应的离子方程式: , 。滴定选用的指示剂为 , 滴定终点观察到的现象为:当滴入最后半滴标准溶液时,锥形㼛中溶液。(用、、等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果(填“偏大”“偏小”或“无影响”)。(6)、实验②中,与过量氨水反应的离子方程式为 , 反应后的体系呈色。18. 氮化硼是一种性能优异的新型材料,主要有六方氮化硼和立方氮化硼两种异构体,前者的结构类似石墨,后者的结构类似金刚石。 (1)、基态硼原子的价电子排布式为 , 硼、碳、氮、氧的第一电离能由小到大的顺序为(以元素符号作答)。(2)、某工厂需要一批氮化硼作为耐磨刀具原料,应选择(填“六方”或“立方”)氮化硼,原因是。(3)、六方氮化硼中硼原子的杂化方式为杂化。立方氮化硼中距离N原子最近的B原子个数为。在高温高压下六方氮化硼转化为立方氮化硼属于(填“物理”或“化学”)变化。(4)、已知立方氮化硼晶胞边长为361.5pm,则立方氮化硼的密度是(列算式,设阿伏加德罗常数的数值为)。19. 元素铬在溶液中主要以(蓝紫色)、(绿色)、(橙红色)、(黄色)等形式存在,为难溶于水的灰蓝色固体,回答下列问题:(1)、在溶液中加入过量溶液,溶液由蓝紫色变为绿色,写出相应的离子方程式:。(2)、和在溶液中可相互转化:(反应A)。室温下,初始浓度为的溶液中随的变化如图所示(整个过程中溶液体积保持不变)。
(1)、基态硼原子的价电子排布式为 , 硼、碳、氮、氧的第一电离能由小到大的顺序为(以元素符号作答)。(2)、某工厂需要一批氮化硼作为耐磨刀具原料,应选择(填“六方”或“立方”)氮化硼,原因是。(3)、六方氮化硼中硼原子的杂化方式为杂化。立方氮化硼中距离N原子最近的B原子个数为。在高温高压下六方氮化硼转化为立方氮化硼属于(填“物理”或“化学”)变化。(4)、已知立方氮化硼晶胞边长为361.5pm,则立方氮化硼的密度是(列算式,设阿伏加德罗常数的数值为)。19. 元素铬在溶液中主要以(蓝紫色)、(绿色)、(橙红色)、(黄色)等形式存在,为难溶于水的灰蓝色固体,回答下列问题:(1)、在溶液中加入过量溶液,溶液由蓝紫色变为绿色,写出相应的离子方程式:。(2)、和在溶液中可相互转化:(反应A)。室温下,初始浓度为的溶液中随的变化如图所示(整个过程中溶液体积保持不变)。
①由图可知,溶液减小,的平衡转化率(填“增大”“减小”或“不变”)。根据A点数据,计算出反应A的平衡常数为。
②升高温度,溶液中的平衡转化率减小;则反应A的(填“>”或“<”)0。
③向酸性溶液中加水,有同学认为溶液中所有离子的浓度都减小,你是否同意并说明理由。
④向酸性溶液(橙色)中加入少量氢氧化钠固体(忽略溶液体积的变化),振荡后立即观察到溶液变为黄色,该结果不足以证明浓度的减小使得反应A的平衡逆向移动,理由是:。
(3)、在化学分析中采用为指示剂,以标准溶液滴定溶液中的 , 利用与生成砖红色沉淀,指示到达滴定终点。当溶液中恰好沉淀完全(浓度等于)时,溶液中为。(已知的分别为和)(4)、向酸性溶液中加入乙醇(乙醇被氧化为乙酸),溶液变为蓝紫色,反应的离子方程式为。20. 一种高效的抗心律失常药物普罗帕酮(Ⅶ)的合成路线如下: (1)、化合物Ⅰ的分子式为 , 其中的含氧官能团有(写名称)(2)、芳香族化合物Ⅱ能发生银镜反应,其名称为。(3)、反应①②③中属于还原反应的是(填编号,下同),属于取代反应的是。(4)、反应④是理论上原子利用率为100%的反应,则试剂X的结构简式为。(5)、化合物Ⅰ的芳香族同分异构体中,能与反应产生气泡的有种,其中核磁共振氢谱显示有五组峰的结构简式为。(6)、参考上述信息,写出以环己烷和苯甲醛为有机原料制备化合物Ⅷ的合成路线。
(1)、化合物Ⅰ的分子式为 , 其中的含氧官能团有(写名称)(2)、芳香族化合物Ⅱ能发生银镜反应,其名称为。(3)、反应①②③中属于还原反应的是(填编号,下同),属于取代反应的是。(4)、反应④是理论上原子利用率为100%的反应,则试剂X的结构简式为。(5)、化合物Ⅰ的芳香族同分异构体中,能与反应产生气泡的有种,其中核磁共振氢谱显示有五组峰的结构简式为。(6)、参考上述信息,写出以环己烷和苯甲醛为有机原料制备化合物Ⅷ的合成路线。