吉林省两地六县重点中学2022-2023学年高二下学期期末联考化学试题
试卷更新日期:2023-08-04 类型:期末考试
一、选择题:本题共17小题,每小题3分,共51分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 生活中的有机物非常重要,下列说法正确的是( )A、煮沸后豆浆中的蛋白质大部分水解成了氨基酸 B、淀粉、纤维素可转化为葡萄糖,两者互为同分异构体 C、油脂不属于天然高分子化合物 D、仅用氢氧化钠溶液就能区分乙醇和乙醛2. 化学用语是化学科目中的基础性语言,下列化学用语的使用正确的是( )A、丙炔的结构简式: B、葡萄糖的某种环状结构:
 C、Cr位于元素周期表的ds区
D、分子的球棍模型:
C、Cr位于元素周期表的ds区
D、分子的球棍模型: 3. 几种有机物的结构如图,下列推断正确的是( )
3. 几种有机物的结构如图,下列推断正确的是( ) A、它们的一氯代物均只有1种 B、甲的二氯代物有4种 C、甲和乙互为同系物 D、它们的每个碳原子都形成3个非极性键4. 下列合成高分子化合物的反应及反应类型均正确的是( )A、有机玻璃{
A、它们的一氯代物均只有1种 B、甲的二氯代物有4种 C、甲和乙互为同系物 D、它们的每个碳原子都形成3个非极性键4. 下列合成高分子化合物的反应及反应类型均正确的是( )A、有机玻璃{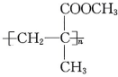 }由甲基丙烯酸甲酯发生缩聚反应制得
B、合成材料
}由甲基丙烯酸甲酯发生缩聚反应制得
B、合成材料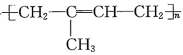 由丙烯和乙烯发生加聚反应制得
C、酚醛树脂{
由丙烯和乙烯发生加聚反应制得
C、酚醛树脂{ }由苯酚和甲醛发生缩聚反应制得
D、纤维
}由苯酚和甲醛发生缩聚反应制得
D、纤维 由己胺和己酸发生缩聚反应制得
5. 下列分子或离子中心原子的杂化方式和空间结构均判断错误的是( )A、HCN:sp、直线形 B、:、V形 C、:sp、平面形 D、:、三角锥形6. 下列有关有机化合物的研究方法、结构特点及性质的说法正确的是( )A、利用红外光谱可以确定有机物的相对分子质量 B、向蛋白质溶液中加入硫酸铵溶液,蛋白质的性质和生理功能会发生改变 C、研究有机物的基本步骤:分离、提纯→确定实验式→确定分子式→确定分子结构 D、实验室通常利用电石和水制备乙炔,并用氯化钠溶液除去乙炔中混有的等杂质气体7. 下列关于核外电子排布及运动状态的说法正确的是( )A、电子云图中的小点越密,表示电子在原子核外某处单位体积内出现的概率越大 B、基态N原子的核外电子排布式违反了能量最低原理 C、基态的核外电子存在25种运动状态 D、在原子中第n电子层含有的原子轨道数为8. 甘氨酸(结构如图)常作食品的调味剂,还可预防氧化、延缓衰老等。甘氨酸与酸反应生成阳离子(用表示)。n mol甘氨酸聚合成多肽,生成m mol水分子。调节甘氨酸溶液的pH,当净电荷等于0时称为等电点,此时,。下列叙述错误的是( )
由己胺和己酸发生缩聚反应制得
5. 下列分子或离子中心原子的杂化方式和空间结构均判断错误的是( )A、HCN:sp、直线形 B、:、V形 C、:sp、平面形 D、:、三角锥形6. 下列有关有机化合物的研究方法、结构特点及性质的说法正确的是( )A、利用红外光谱可以确定有机物的相对分子质量 B、向蛋白质溶液中加入硫酸铵溶液,蛋白质的性质和生理功能会发生改变 C、研究有机物的基本步骤:分离、提纯→确定实验式→确定分子式→确定分子结构 D、实验室通常利用电石和水制备乙炔,并用氯化钠溶液除去乙炔中混有的等杂质气体7. 下列关于核外电子排布及运动状态的说法正确的是( )A、电子云图中的小点越密,表示电子在原子核外某处单位体积内出现的概率越大 B、基态N原子的核外电子排布式违反了能量最低原理 C、基态的核外电子存在25种运动状态 D、在原子中第n电子层含有的原子轨道数为8. 甘氨酸(结构如图)常作食品的调味剂,还可预防氧化、延缓衰老等。甘氨酸与酸反应生成阳离子(用表示)。n mol甘氨酸聚合成多肽,生成m mol水分子。调节甘氨酸溶液的pH,当净电荷等于0时称为等电点,此时,。下列叙述错误的是( ) A、甘氨酸是蛋白质水解的最终产物之一 B、甘氨酸是两性化合物 C、甘氨酸溶液调pH后,在等电点时显中性 D、当时合成的肽为肽链9. 元素X、Y、Z在周期表中的相对位置如图。已知X元素原子的价层电子排布式为 , 则下列说法错误的是( )
A、甘氨酸是蛋白质水解的最终产物之一 B、甘氨酸是两性化合物 C、甘氨酸溶液调pH后,在等电点时显中性 D、当时合成的肽为肽链9. 元素X、Y、Z在周期表中的相对位置如图。已知X元素原子的价层电子排布式为 , 则下列说法错误的是( ) A、Y元素原子核外d能级无电子填充 B、电负性:X>Y>Z C、元素的最高正价:X>Y>Z D、基态Z原子的核外电子占据的最高能级的电子云轮廓图的形状为哑铃形10. 下列操作不能达到目的的是( )
A、Y元素原子核外d能级无电子填充 B、电负性:X>Y>Z C、元素的最高正价:X>Y>Z D、基态Z原子的核外电子占据的最高能级的电子云轮廓图的形状为哑铃形10. 下列操作不能达到目的的是( )操作
目的
A
对二氯甲烷和四氯化碳的混合物进行蒸馏
分离两种有机物
B
利用分液操作分离苯和硝基苯
分离两种有机物
C
在医用酒精中加入生石灰,蒸馏
制备无水乙醇
D
在水、乙醇中分别加入一块大小和形状均相同的钠块
探究氧氢键极性强弱
A、A B、B C、C D、D11. 氨气及铵盐等都是重要的化工原料。从“结构化学”的角度分析,下列说法正确的是( )A、中N、H间通过头碰头形成键 B、分子中含极性共价键,为极性分子,可推出也为极性分子 C、为离子化合物,离子键具有方向性和饱和性 D、配位化合物的配体为、Cl12. 我国科学家开发了一种新型手性Ru(Ⅱ)—Pt(Ⅱ)双核配合物()作为G-quadruplexDNA稳定剂和端粒酶抑制剂。手性Ru(Ⅱ)-Pt(Ⅱ)双核配合物的化学结构△/A-RuPt和相关的单一核配合物(Pt和)的结构如图所示。已知:在等价轨道上的电子排布采取全充满和半充满时,能量会较低,体系有更大的稳定性。下列说法正确的是( )
已知:Ru(Ⅱ)表示+2价Ru,Pt(Ⅱ)的配位数为4。
A、与位于同一周期,基态的价层电子排布式为 B、单一核配合物Pt中的配位原子只有N原子 C、中Ru原子与Pt原子的配位数相同 D、中Ru提供空轨道形成配位键13. 科学家使用微水滴一步形成具有苯乙酸核心的药物——3,4-二羟基苯乙酸(多巴胺代谢物神经递质)(药物丙)。微水滴反应原理如图所示。下列叙述正确的是( ) A、甲、乙、丙三种物质遇溶液均发生显色反应 B、苯环上二溴代物的数目:甲大于乙 C、1 mol药物丙能与1 mol 反应 D、1 mol药物丙最多能与2 mol 发生取代反应14. 可用
A、甲、乙、丙三种物质遇溶液均发生显色反应 B、苯环上二溴代物的数目:甲大于乙 C、1 mol药物丙能与1 mol 反应 D、1 mol药物丙最多能与2 mol 发生取代反应14. 可用 表示,且能被酸性溶液氧化生成
表示,且能被酸性溶液氧化生成 的有机物共有(不考虑立体异构)( ) A、6种 B、8种 C、10种 D、12种15. 在无机氟化物制备中有广泛的应用,其晶体属于四方晶系,晶胞参数如图所示,其中O点原子和①号原子的分数坐标依次为、。已知:Xe-F键长为r pm。下列说法正确的是( )
的有机物共有(不考虑立体异构)( ) A、6种 B、8种 C、10种 D、12种15. 在无机氟化物制备中有广泛的应用,其晶体属于四方晶系,晶胞参数如图所示,其中O点原子和①号原子的分数坐标依次为、。已知:Xe-F键长为r pm。下列说法正确的是( ) A、中心原子上的孤电子对数为2 B、④号原子的分数坐标为 C、沿x、y、z任意一个方向投影,位于面中心的都只有Xe原子 D、晶胞中②③号原子间的距离 pm16. 某有机物M对的相对密度为30。M分子中各元素的质量分数:碳40.0%,氢6.6%,氧53.4%。该有机物能与钠反应,又能与银氨溶液共热产生银镜。M的结构简式可能是( )A、 B、 C、 D、17. 团簇是一个穴醚无机类似物,通过与反应,测定取代反应的平衡常数 , 的骨架结构在交换过程中没有被破坏,反应示意图和所测数据如图,表示平衡时铯离子浓度和铷离子浓度之比,其他类似。下列说法错误的是( )
A、中心原子上的孤电子对数为2 B、④号原子的分数坐标为 C、沿x、y、z任意一个方向投影,位于面中心的都只有Xe原子 D、晶胞中②③号原子间的距离 pm16. 某有机物M对的相对密度为30。M分子中各元素的质量分数:碳40.0%,氢6.6%,氧53.4%。该有机物能与钠反应,又能与银氨溶液共热产生银镜。M的结构简式可能是( )A、 B、 C、 D、17. 团簇是一个穴醚无机类似物,通过与反应,测定取代反应的平衡常数 , 的骨架结构在交换过程中没有被破坏,反应示意图和所测数据如图,表示平衡时铯离子浓度和铷离子浓度之比,其他类似。下列说法错误的是( ) A、 B、团簇中 C、增大可使平衡时增大 D、团簇对于具有比大的亲和力
A、 B、团簇中 C、增大可使平衡时增大 D、团簇对于具有比大的亲和力二、非选择题:本题共4小题,共49分。
-
18. 根据所学知识,回答下列问题:(1)、键的极性对物质化学性质有影响,则①②③④ , 4种物质酸性由强到弱的顺序是(用序号表示)。(2)、一种含镓的药物合成方法如图所示:

①1 mol化合物Ⅰ中含有的σ键的物质的量为mol。
②化合物Ⅱ中Ga的配位数为 , 。
(3)、对羟基苯甲醛( )的沸点比邻羟基苯甲醛(
)的沸点比邻羟基苯甲醛( )的沸点高,其原因是 (4)、甲胺分子常温常压下是一种无色有强刺激性气味的气体。甲胺极易溶于水除因为它们都是极性分子外,还因为。(5)、乙二胺()能与等金属离子形成稳定环状离子,其原因是。(6)、具有的醛或酮,在酸或碱的催化作用下,与另一分子醛或酮发生缩合反应,生成一羟基醛或β一羟基酮。以乙醛为例,其过程可表示如下:
)的沸点高,其原因是 (4)、甲胺分子常温常压下是一种无色有强刺激性气味的气体。甲胺极易溶于水除因为它们都是极性分子外,还因为。(5)、乙二胺()能与等金属离子形成稳定环状离子,其原因是。(6)、具有的醛或酮,在酸或碱的催化作用下,与另一分子醛或酮发生缩合反应,生成一羟基醛或β一羟基酮。以乙醛为例,其过程可表示如下:
请从元素电负性的角度解释第一步加成反应发生的原理:。
19. 第三周期几种氧化物(不包括过氧化物和超氧化物)的离子键成分的百分数如图所示。回答下列问题: (1)、离子键成分的百分数最高的是(填化学式)。(2)、MgO的熔点(填“高于”或“低于”) , 原因是。(3)、根据图示推知,第三周期主族元素最高价氧化物中离子键成分的百分数最低的是
(1)、离子键成分的百分数最高的是(填化学式)。(2)、MgO的熔点(填“高于”或“低于”) , 原因是。(3)、根据图示推知,第三周期主族元素最高价氧化物中离子键成分的百分数最低的是(填化学式)。下列化合物中离子键成分的百分数最高的是(填标号)。
A.CsF B.LiCl C.CaO D.AlBr₃
(4)、NaCl晶胞结构如图所示,设晶胞的边长为a pm,为阿伏加德罗常数的值。
①与最近且等距离的数为。
②阳离子填充在阴离子构成的(填标号)空隙中。
A.正八面体 B.正四边形 C.正四面体 D.正三角锥形
③该晶胞的密度为g·cm。
20. 1,2-二溴乙烷是一种重要的化工原料,常用于有机合成、医药中间体的合成等。已知其沸点为131℃,熔点为9℃。实验室中用乙烯溴化法制备1,2-二溴乙烷的装置如图,其中加热和夹持装置已略去。 (1)、装置A中的仪器a名称为 , 反应若要安全、平稳进行,须向装置A中添加物质;装置B中玻璃管b的作用是。(2)、为提高装置中1,2-二溴乙烷的产率,装置A中应迅速升温至℃,当温度为140℃时乙醇可能发生的副反应的化学方程式为。(3)、实验过程中,发现装置A中溶液逐渐变黑,同时产生一种有刺激性气味的气体,试分析原因:(用文字说明)。(4)、从装置D的试管中分离提纯1,2—二溴乙烷需要经过以下步骤:①(填标号,下同)、②洗涤、③。
(1)、装置A中的仪器a名称为 , 反应若要安全、平稳进行,须向装置A中添加物质;装置B中玻璃管b的作用是。(2)、为提高装置中1,2-二溴乙烷的产率,装置A中应迅速升温至℃,当温度为140℃时乙醇可能发生的副反应的化学方程式为。(3)、实验过程中,发现装置A中溶液逐渐变黑,同时产生一种有刺激性气味的气体,试分析原因:(用文字说明)。(4)、从装置D的试管中分离提纯1,2—二溴乙烷需要经过以下步骤:①(填标号,下同)、②洗涤、③。ⅰ.过滤 ⅱ.蒸馏 ⅲ.分液
分离提纯的第①步中1,2一二溴乙烷从(填“上口倒出”或“下口放出”),第③步收集温度为℃的馏分。
21. K是合成抗胆碱药物奥昔布宁的中间体。以芳香族化合物为起始原料合成K的路线如图:
回答下列问题:
(1)、B→C的反应试剂和条件是 , 试剂E是(填结构简式)。(2)、K中官能团的名称为。(3)、H→I的反应类型是。(4)、L是D的同分异构体,同时具备下列条件的L的结构有种。(不考虑立体异构)①属于芳香族化合物②1 mol L与足量银氨溶液反应,最多生成4 mol Ag
其中,在核磁共振氢谱上有4组峰且峰的面积比为1∶1∶2∶2的结构简式为(写一种)。
(5)、以甲苯、丙酮为原料合成 设计合成路线(有机溶剂和无机试剂任选)。
设计合成路线(有机溶剂和无机试剂任选)。