浙江省宁波市九校2022-2023学年高二下学期期末联考化学试题
试卷更新日期:2023-08-04 类型:期末考试
一、选择题(本大题共16小题,每小题3分,共48分.每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
-
1. 下列物质中,含有极性共价键的离子晶体是( )A、 B、 C、 D、2. 下列关于氮及其化合物的说法不正确的是( )A、能够与发生化合反应 B、与能够相互转化 C、能够将还原为 D、浓见光分解产生和3. 下列化学用语表示正确的是( )A、中子数为10的氧原子: B、的空间结构:(直线型) C、二甲基甲酰胺的结构简式:
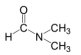 D、的电子式:
4. 物质的性质决定用途,下列两者对应关系不正确的是( )A、氧化性强,可用作纸张的漂白剂 B、铁粉有还原性,可用作食品的抗氧化剂 C、熔点高,可用作耐高温材料 D、硬度大,可用作砂纸和砂轮的磨料5. 下列关于常见物质的制备说法正确的是( )A、氯气通入冷的石灰乳中制取漂白液 B、电解氯化钠溶液可以制备金属钠 C、工业上用水吸收三氧化硫制备硫酸 D、将粗硅转化为三氯硅烷,再经氢气还原可得到高纯硅6. 关于反应(末配平),下列说法不正确的是( )A、与反应的物质的量之比为 B、氧化性: C、当有参与反应时,转移的电子数为 D、产物既能杀菌消毒又能净水7. 下列反应的离子方程式正确的是( )A、与稀硝酸反应,当时: B、苯酚钠溶液中通入少量二氧化碳气体: C、溶液中滴加溶液: D、溶液与稀溶液混合:8. 下列说法不正确的是( )A、DNA分子双螺旋结构中,两条链上的碱基互补配对形成氢键 B、蔗糖和麦芽糖都能被银氨溶液或新制氢氧化铜悬浊液氧化,都属于还原糖 C、油脂的氢化是液态油通过催化加氢转变成半固态脂肪的过程 D、蛋白质溶液中加入浓硝酸会有白色沉淀产生,加热后沉淀变黄色9. 已知元素周期表中前四周期的元素M、W、X、Y、Z,它们的原子序数依次增大.M与W可以形成原子个数比为的10电子分子,的最外层电子数为最内层的一半,的最高能层有两对成对电子,Z位于元素周期表第ⅥB族.下列说法正确的是( )A、的价层电子排布式: B、简单离子半径: C、最简单氢化物的稳定性: D、与形成的化合物和均为极性分子10. 中药透骨草中一种抗氧化活性成分的结构如下图所示,下列说法正确的是( )
D、的电子式:
4. 物质的性质决定用途,下列两者对应关系不正确的是( )A、氧化性强,可用作纸张的漂白剂 B、铁粉有还原性,可用作食品的抗氧化剂 C、熔点高,可用作耐高温材料 D、硬度大,可用作砂纸和砂轮的磨料5. 下列关于常见物质的制备说法正确的是( )A、氯气通入冷的石灰乳中制取漂白液 B、电解氯化钠溶液可以制备金属钠 C、工业上用水吸收三氧化硫制备硫酸 D、将粗硅转化为三氯硅烷,再经氢气还原可得到高纯硅6. 关于反应(末配平),下列说法不正确的是( )A、与反应的物质的量之比为 B、氧化性: C、当有参与反应时,转移的电子数为 D、产物既能杀菌消毒又能净水7. 下列反应的离子方程式正确的是( )A、与稀硝酸反应,当时: B、苯酚钠溶液中通入少量二氧化碳气体: C、溶液中滴加溶液: D、溶液与稀溶液混合:8. 下列说法不正确的是( )A、DNA分子双螺旋结构中,两条链上的碱基互补配对形成氢键 B、蔗糖和麦芽糖都能被银氨溶液或新制氢氧化铜悬浊液氧化,都属于还原糖 C、油脂的氢化是液态油通过催化加氢转变成半固态脂肪的过程 D、蛋白质溶液中加入浓硝酸会有白色沉淀产生,加热后沉淀变黄色9. 已知元素周期表中前四周期的元素M、W、X、Y、Z,它们的原子序数依次增大.M与W可以形成原子个数比为的10电子分子,的最外层电子数为最内层的一半,的最高能层有两对成对电子,Z位于元素周期表第ⅥB族.下列说法正确的是( )A、的价层电子排布式: B、简单离子半径: C、最简单氢化物的稳定性: D、与形成的化合物和均为极性分子10. 中药透骨草中一种抗氧化活性成分的结构如下图所示,下列说法正确的是( )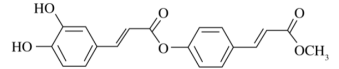 A、该有机物的分子式为 B、该有机物可以发生氧化、取代、加成和消去反应 C、该有机物与足量溶液反应,最多可消耗 D、该有机物分子中最多有9个碳原子共面11. 已知;常温下,用溶液分别滴定浓度均为的溶液和溶液,所得滴定曲线如下图所示,用代表或 , 用代表或 , 下列说法正确的是( )
A、该有机物的分子式为 B、该有机物可以发生氧化、取代、加成和消去反应 C、该有机物与足量溶液反应,最多可消耗 D、该有机物分子中最多有9个碳原子共面11. 已知;常温下,用溶液分别滴定浓度均为的溶液和溶液,所得滴定曲线如下图所示,用代表或 , 用代表或 , 下列说法正确的是( )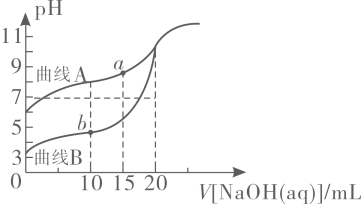 A、曲线表示溶液滴定溶液的滴定曲线 B、点存在 C、点存在 D、若两份溶液滴定都采用甲基橙作为指示剂,则滴定终点消耗氢氧化钠溶液的体积均偏大12. 胆矾的结构如图所示,下列说法正确的是( )
A、曲线表示溶液滴定溶液的滴定曲线 B、点存在 C、点存在 D、若两份溶液滴定都采用甲基橙作为指示剂,则滴定终点消耗氢氧化钠溶液的体积均偏大12. 胆矾的结构如图所示,下列说法正确的是( )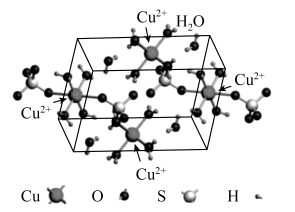 A、胆矾的化学式可以表示为 B、该结构水分子中的氢原子参与形成配位键 C、该结构中所有氧原子都杂化,且采取杂化 D、配位后形成的空间结构是正四面体13. 我国科研人员研究发现合成氨的反应历程有多种,其中一种反应历程如下图所示(吸附在催化剂表面的物质用*表示).下列说法正确的是( )
A、胆矾的化学式可以表示为 B、该结构水分子中的氢原子参与形成配位键 C、该结构中所有氧原子都杂化,且采取杂化 D、配位后形成的空间结构是正四面体13. 我国科研人员研究发现合成氨的反应历程有多种,其中一种反应历程如下图所示(吸附在催化剂表面的物质用*表示).下列说法正确的是( )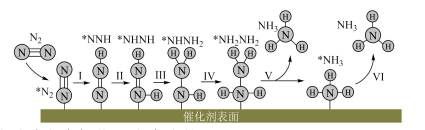 A、生成是通过多步氧化反应生成的 B、过程Ⅰ和过程Ⅲ的能量变化相同 C、对于 , 适当提高分压,可加快反应速率,提高平衡转化率 D、若有大量氨气分子吸附在催化剂表面,将降低化学反应速率14. 如下图所示,装置甲是微生物降解废水中尿素的装置,利用装置甲可以实现装置乙中铁上镀铜.下列有关说法正确的是( )
A、生成是通过多步氧化反应生成的 B、过程Ⅰ和过程Ⅲ的能量变化相同 C、对于 , 适当提高分压,可加快反应速率,提高平衡转化率 D、若有大量氨气分子吸附在催化剂表面,将降低化学反应速率14. 如下图所示,装置甲是微生物降解废水中尿素的装置,利用装置甲可以实现装置乙中铁上镀铜.下列有关说法正确的是( )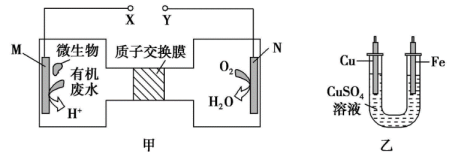 A、甲装置中X电极应与乙装置中铜电极相接 B、乙装置电镀过程中,溶液颜色越来越浅 C、甲装置中电极的反应式为 D、当甲装置中电极消耗气体时,则乙装置中铁电极质量增加15. 难溶盐可溶于盐酸,常温下,用气体调节浊液的 , 测得体系中或与的关系如图所示.下列说法不正确的是( )
A、甲装置中X电极应与乙装置中铜电极相接 B、乙装置电镀过程中,溶液颜色越来越浅 C、甲装置中电极的反应式为 D、当甲装置中电极消耗气体时,则乙装置中铁电极质量增加15. 难溶盐可溶于盐酸,常温下,用气体调节浊液的 , 测得体系中或与的关系如图所示.下列说法不正确的是( )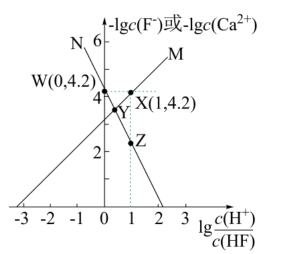 A、曲线代表随的变化趋势 B、点溶液中存在 C、难溶盐的溶度积常数 D、其他条件不变的情况下,无论增大浓度或减小浓度,的均不变16. 下列方案设计、现象和结论都正确的是( )
A、曲线代表随的变化趋势 B、点溶液中存在 C、难溶盐的溶度积常数 D、其他条件不变的情况下,无论增大浓度或减小浓度,的均不变16. 下列方案设计、现象和结论都正确的是( )选项
实验方案
现象
结论
A
向含酚酞的溶液中加入少量的固体
溶液的红色变浅
溶液中存在水解平衡
B
向固体中分别滴加盐酸和氨水
固体均溶解
为两性氢氧化物
C
向可能含有少量苯酚的苯中加入过量的浓溴水
未出现白色沉淀
苯中不含苯酚
D
向溴乙烷中加入过量氢氧化钠溶液,振荡后加热,静置,取上层水溶液加足量硝酸银溶液
出现淡黄色沉淀
溴乙烷水解后有产生
A、A B、B C、C D、D二、非选择题(本大题共5小题,共52分,所有答案均填在答题纸上.)
-
17. 铁和碳能形成多种物质,在日常生产、生活中有着广泛的应用.回答下列问题:(1)、①基态原子的价层电子排布图为 .
②乳酸亚铁口服液是缺铁人群的补铁保健品,临床建议服用维生素促进“亚铁”的吸收,避免转化成 , 从结构角度分析,易被氧化成的原因是 .
③的熔点显著低于的熔点 , 可能的原因是 .
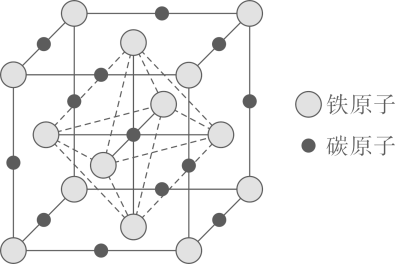 (2)、下列有关碳的说法正确的是____.A、第一电离能由小到大的顺序是: B、碳的两种同素异形体金刚石和石墨都是共价晶体 C、碳碳双键中键比键轨道重叠程度大,形成的共价键更稳定 D、第ⅣA族的元素形成的化合物键角由大到小的顺序为:(3)、铁素体是碳溶解在中的间隙固溶体,其晶胞如图所示,该物质的化学式为 , 若该晶体的密度为 , 则该晶体中最近的两个碳原子的核间距为列出计算式即可).18. 化合物由四种元素组成,是一种微溶于水的固体,可按如下流程进行实验:
(2)、下列有关碳的说法正确的是____.A、第一电离能由小到大的顺序是: B、碳的两种同素异形体金刚石和石墨都是共价晶体 C、碳碳双键中键比键轨道重叠程度大,形成的共价键更稳定 D、第ⅣA族的元素形成的化合物键角由大到小的顺序为:(3)、铁素体是碳溶解在中的间隙固溶体,其晶胞如图所示,该物质的化学式为 , 若该晶体的密度为 , 则该晶体中最近的两个碳原子的核间距为列出计算式即可).18. 化合物由四种元素组成,是一种微溶于水的固体,可按如下流程进行实验: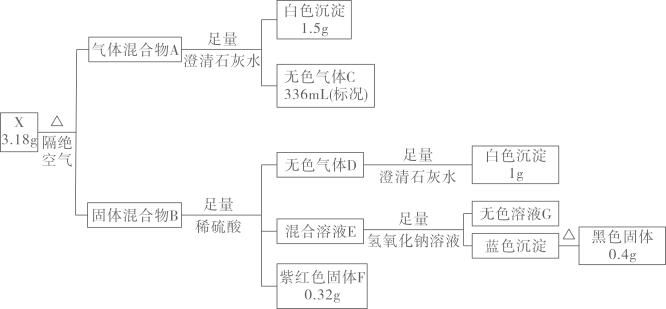
已知:气体混合物A中物质的组成元素相同;固体混合物B只含两种物质;无色溶液G的焰色为紫色(透过蓝色钴玻璃).
请回答:
(1)、气体混合物A是;X的组成元素是 .(2)、写出X受热分解的化学反应方程式 .(3)、写出固体混合物B与足量稀硫酸发生反应的离子方程式 .(4)、设计实验,用化学方法检验无色溶液G中的阴离子 .19. 乙烯的产量是衡量一个国家石油化工发展水平的重要标志,工业上有多种方法制备乙烯.回答下列问题:Ⅰ.以乙烷为原料制备乙烯
已知:①
(1)、写出反应④分解制备的热化学方程式 .(2)、某温度下,只发生反应④,向的恒容密闭容器中通入 , 初始压强为 , 测得时该反应达到平衡状态,此时的体积分数为 , 反应从开始到平衡,用表示的该反应的平均反应速率;该温度下反应的压强平衡常数(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).(3)、Ⅱ.以二氧化碳为原料制备乙烯已知和在铁系催化剂作用下发生化学反应⑤ , 会有副反应②发生.在三个容积均为的密闭容器中以不同的氢碳比充入和 , 在一定条件下的平衡转化率与温度的关系如下图1所示.

下列关于反应⑤的说法不正确的是____.
A、该反应的正反应活化能>逆反应活化能 B、图1中,氢碳比:ⅰ>ⅱ C、图1中,当氢碳比为2.0时,Q点:v(正)<v(逆) D、图1中,当反应处于点状态时,形成碳碳双键的同时断裂碳氧双键(4)、在密闭容器中通入和平衡转化率随温度和压强的变化如上图2所示.温度大于 , 随着压强的增大,的平衡转化率减小,解释其原因 .(5)、Ⅲ.以碘甲烷为原料制备乙烯已知反应⑥;⑦;⑧ . 维持温度为 , 压强为 , 起始时投入 , 达到平衡时,测得平衡体系中 .
平衡时的转化率为 .
(6)、已知在条件下,存在等式(为常数,为平衡时的总压强,为平衡时的物质的量分数).保持其它条件不变,请在图3中画出随压强变化的图像.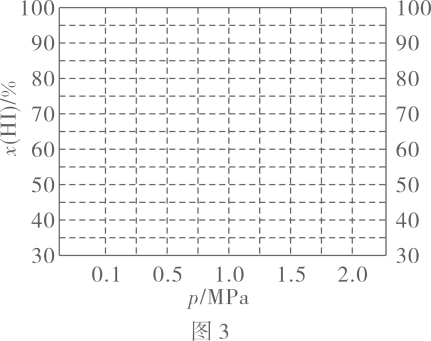 20. 叠氮化钠是汽车安全气囊最理想的气体发生剂原料.下图是工业水合肼法制叠氮化钠的工艺流程:
20. 叠氮化钠是汽车安全气囊最理想的气体发生剂原料.下图是工业水合肼法制叠氮化钠的工艺流程: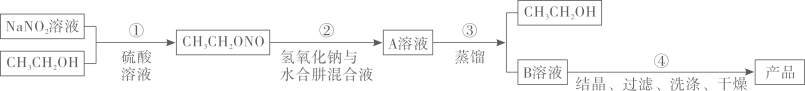
已知:①受热易分解;
②有关物质的物理性质如下表:
沸点/
溶解性
78.3
与水互溶
水合肼
113.5
与水、醇互溶,不溶于乙醚和氯仿
亚硝酸乙酯
17
难溶于水,可溶于乙醇、乙醚
300
易溶于水,难溶于乙醇
回答下列问题:
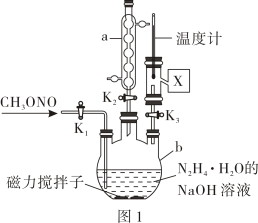 (1)、步骤②制备的装置如右图1所示,图1中仪器的名称为 , 仪器的作用是 .(2)、写出步骤②中生成的化学反应方程式 .(3)、下列说法不正确的是____.A、反应①需控制适宜温度,温度过高和过低都不利于该反应进行 B、步骤②反应时,应先打开 , 关闭 , 充分反应后,关闭 , 再打开出产品 C、图1中处接直型冷凝管、牛角管和锥形瓶进行步骤③ D、步骤④过滤得到晶体后,可用蒸馏水洗涤晶体(4)、已知:与反应灵敏,可以生成红色配合物,该红色配合物的吸光度与在一定浓度范围内的关系如图2所示,可利用该“—吸光度”曲线确定样品溶液中的 .
(1)、步骤②制备的装置如右图1所示,图1中仪器的名称为 , 仪器的作用是 .(2)、写出步骤②中生成的化学反应方程式 .(3)、下列说法不正确的是____.A、反应①需控制适宜温度,温度过高和过低都不利于该反应进行 B、步骤②反应时,应先打开 , 关闭 , 充分反应后,关闭 , 再打开出产品 C、图1中处接直型冷凝管、牛角管和锥形瓶进行步骤③ D、步骤④过滤得到晶体后,可用蒸馏水洗涤晶体(4)、已知:与反应灵敏,可以生成红色配合物,该红色配合物的吸光度与在一定浓度范围内的关系如图2所示,可利用该“—吸光度”曲线确定样品溶液中的 .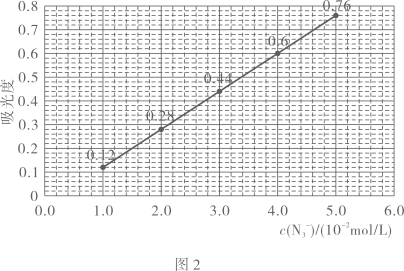
确定样品溶液中的实验步骤如下:从下列选项中选择合理的仪器和操作,补全如下步骤[横线上填写一件最关键仪器,横线内填写一种操作,均用字母表示]
ⅰ.配制待测溶液
打开 , 加入适量蒸馏水,盖紧玻璃塞,倒立后正立→→用称取样品置于烧杯中,加入适量蒸馏水充分溶解→→将溶液转移到中→→→→
仪器:a.容量瓶;b.容量瓶;c.量筒;d.分析天平;e.托盘天平.
操作:f.轻轻摇动,使溶液混合均匀
g.用少量蒸馏水洗涤烧杯内壁和玻璃棒23次,并转移洗涤液
h.加水后定容
i.将玻璃塞旋转 , 倒立后正立
j.盖好玻璃塞,反复上下颠倒,摇匀
k.待冷却至室温
ⅱ.测定待测溶液与形成的红色配合物的吸光度
取待测溶液,加入足量的溶液,摇匀后测得吸光度为0.6.
(5)、样品的质量分数为(用百分数表示,答案精确到小数点后1位).21. 氟伐他汀钠(L)是第一个全化学合成的降胆固醇药物,是一种优良的降血脂药,其合成路线如下: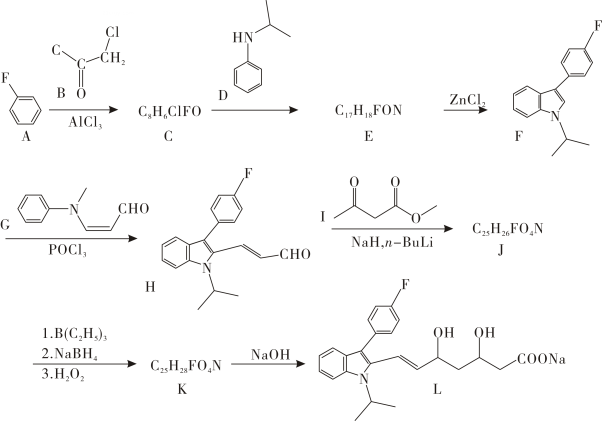
已知:①
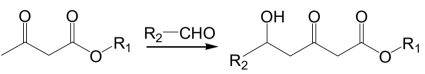
②
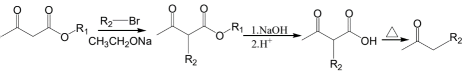
请回答:
(1)、化合物A的官能团名称是 .(2)、化合物J的结构简式是 .(3)、下列说不正确的是____.A、先加成后消去 B、有机物的一氯取代物有8种 C、有机物能与和反应 D、化合物存在手性碳原子(4)、写出的化学方程式 .(5)、设计以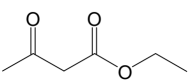 和1,丁二烯为原料,合成
和1,丁二烯为原料,合成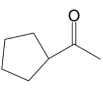 的路线(用流程图表示,无机试剂任选) . (6)、和发生加成反应后的产物为 , 写出4种同时符合下列条件的化合物的同分异构体的结构简式 . ①分子中含有两个环,其中一个是苯环;②谱和谱检测表明:分子中共有4种不同化学环境的氢原子,且含键.
的路线(用流程图表示,无机试剂任选) . (6)、和发生加成反应后的产物为 , 写出4种同时符合下列条件的化合物的同分异构体的结构简式 . ①分子中含有两个环,其中一个是苯环;②谱和谱检测表明:分子中共有4种不同化学环境的氢原子,且含键.