吉林省长春市长春田中实高2022-2023学年高一下学期期末考试化学试题
试卷更新日期:2023-08-03 类型:期末考试
一、单选题(共50分1-10题每题2分11-20题每题3分)
-
1. 人类社会的发展与化学的发展密切相关。下列说法正确的是( )A、青铜和黄铜是铜的两种同素异形体 B、纳米银与硝酸是可折叠柔性屏中的灵魂材料,二者不会发生化学反应 C、《本草经集注》记载“以火烧之,紫青烟起,乃真硝石也”,是古人利用焰色试验鉴别物质 D、利用纳米铁粉对重金属离子的物理吸附作用除去水中Pb2+、Cu2+、Hg2+等重金属离子2. 下列说法中正确的有( )
①石灰石是制造玻璃和水泥的主要原料之一,水泥和陶瓷的生产原料中都有黏土
②浓硫酸使胆矾变白,体现了浓硫酸的吸水性
③粗盐中的、、可以依次加入NaOH溶液、溶液、溶液后过滤,在滤液中加适量的盐酸可得到纯净的氯化钠溶液
④“雷雨发庄稼”的过程中氮元素呈现了4种不同的化合价
⑤使品红褪色和使氯水褪色的原理相同
⑥的燃烧热 kJ/mol,则 kJ/mol
⑦正常雨水的pH约为5.6,是因为溶有气体
A、1项 B、2项 C、3项 D、4项3. 下列叙述正确的是( )A、500 ℃,30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1 B、已知C(石墨,s)=C(金刚石,s) ΔH>0,则石墨比金刚石稳定 C、含20.0 g的NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)ΔH=-57.4 kJ·mol-1 D、已知2C(s)+2O2(g)=2CO2(g) ΔH1 ; 2C(s)+O2(g)=2CO(g) ΔH2 , 则ΔH1>ΔH24. 下列有关实验装置或原理能达到目的的是 ( ) A、用图甲装置制取沉淀 B、用图乙装置分离层和水层 C、用图丙装置制取乙酸乙酯 D、用图丁装置验证酸性:乙酸>碳酸>苯酚5. 氮及其化合物在生产生活中具有广泛应用。氮气经过一系列的变化可以合成氨、氮的氧化物、硝酸等重要的化工原料;NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4 , 减少环境污染。对于反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)∆H<0,下列有关说法不正确的是( )A、升高温度,该反应的平衡常数增大 B、催化剂降低了正、逆反应的活化能 C、1molN-H断裂同时有1molO-H断裂,说明达该条件下的平衡状态 D、其它条件不变,加入高效的催化剂能提高单位体积内的活化分子百分数6. 下列说法正确的是( )A、反应在低温下能自发进行,说明该反应的 B、的热值(单位质量的燃料完全燃烧时所放出的热量,叫做燃料的热值)为 , 则氢气燃烧的热化学方程式可表示为: C、能自发进行的反应一定能迅速发生 D、增大反应物浓度,可增大活化分子百分数,从而增加有效碰撞的次数7. 某课外活动小组设计了以下四种方案除去乙烷中混有的少量乙烯,并得到纯净干燥的乙烷,合理的是( )
A、用图甲装置制取沉淀 B、用图乙装置分离层和水层 C、用图丙装置制取乙酸乙酯 D、用图丁装置验证酸性:乙酸>碳酸>苯酚5. 氮及其化合物在生产生活中具有广泛应用。氮气经过一系列的变化可以合成氨、氮的氧化物、硝酸等重要的化工原料;NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4 , 减少环境污染。对于反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)∆H<0,下列有关说法不正确的是( )A、升高温度,该反应的平衡常数增大 B、催化剂降低了正、逆反应的活化能 C、1molN-H断裂同时有1molO-H断裂,说明达该条件下的平衡状态 D、其它条件不变,加入高效的催化剂能提高单位体积内的活化分子百分数6. 下列说法正确的是( )A、反应在低温下能自发进行,说明该反应的 B、的热值(单位质量的燃料完全燃烧时所放出的热量,叫做燃料的热值)为 , 则氢气燃烧的热化学方程式可表示为: C、能自发进行的反应一定能迅速发生 D、增大反应物浓度,可增大活化分子百分数,从而增加有效碰撞的次数7. 某课外活动小组设计了以下四种方案除去乙烷中混有的少量乙烯,并得到纯净干燥的乙烷,合理的是( )


 A、①② B、②④ C、②③ D、③④8. 化学与生活、科技密切相关,以下说法正确的是( )A、氯化铝的熔点低,可用于工业电解冶炼铝 B、高铁酸钾与明矾用于水处理的原理相同 C、水玻璃中的水难挥发,可作木材阻燃剂 D、“白色石油”锂在电化学中应用广基于其比能量高9. 实验室用以下装置(夹持和水浴加热装置略)制备乙酸异戊酯(沸点142℃),实验中利用环己烷-水的共沸体系(沸点69℃)带出水分。已知体系中沸点最低的有机物是环己烷(沸点81℃),其反应原理:
A、①② B、②④ C、②③ D、③④8. 化学与生活、科技密切相关,以下说法正确的是( )A、氯化铝的熔点低,可用于工业电解冶炼铝 B、高铁酸钾与明矾用于水处理的原理相同 C、水玻璃中的水难挥发,可作木材阻燃剂 D、“白色石油”锂在电化学中应用广基于其比能量高9. 实验室用以下装置(夹持和水浴加热装置略)制备乙酸异戊酯(沸点142℃),实验中利用环己烷-水的共沸体系(沸点69℃)带出水分。已知体系中沸点最低的有机物是环己烷(沸点81℃),其反应原理: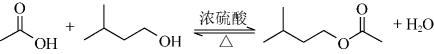
下列说法错误的是
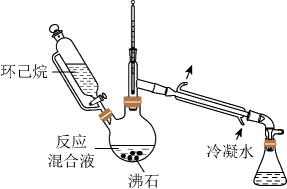 A、以共沸体系带水促使反应正向进行 B、反应时水浴温度需严格控制在69℃ C、接收瓶中会出现分层现象 D、根据带出水的体积可估算反应进度10. 下列说法不正确的是( )A、鸡蛋白溶液中,加入醋铅溶液有沉淀析出,加入水后沉淀不溶解 B、用银氨溶液可以鉴别葡萄糖和乙酸溶液 C、可用饱和碳酸钠溶液鉴别乙酸、乙醇、苯及氢氧化钡溶液 D、取少量淀粉溶液,加入一定量稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜并加热,观察现象,判断淀粉水解的产物中是否含有葡萄糖11. 化学电源在日常生活和高科技领域中都有广泛应用,下列说法不正确的是
A、以共沸体系带水促使反应正向进行 B、反应时水浴温度需严格控制在69℃ C、接收瓶中会出现分层现象 D、根据带出水的体积可估算反应进度10. 下列说法不正确的是( )A、鸡蛋白溶液中,加入醋铅溶液有沉淀析出,加入水后沉淀不溶解 B、用银氨溶液可以鉴别葡萄糖和乙酸溶液 C、可用饱和碳酸钠溶液鉴别乙酸、乙醇、苯及氢氧化钡溶液 D、取少量淀粉溶液,加入一定量稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜并加热,观察现象,判断淀粉水解的产物中是否含有葡萄糖11. 化学电源在日常生活和高科技领域中都有广泛应用,下列说法不正确的是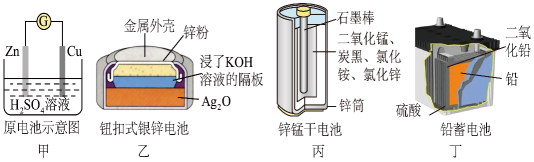 A、乙:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH- B、甲:溶液中Zn2+向Cu电极方向移动,电子由锌经电解质溶液流向铜电极 C、丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降 D、丙:锌筒作负极,发生氧化反应,锌筒会变薄12. 一种新型中温全瓷铁-空气电池,其结构如图所示。下列有关该电池放电时的说法错误的是( )
A、乙:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH- B、甲:溶液中Zn2+向Cu电极方向移动,电子由锌经电解质溶液流向铜电极 C、丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降 D、丙:锌筒作负极,发生氧化反应,锌筒会变薄12. 一种新型中温全瓷铁-空气电池,其结构如图所示。下列有关该电池放电时的说法错误的是( ) A、a电极上发生还原反应 B、负极的电极反应式为 C、铁表面发生的反应为 D、若标准状况下33.6L空气参与反应,电路中理论上有6mol电子转移13. 在一定温度下,将和放入容积为的某密闭容器中发生反应:。后达到平衡,测得容器内C的浓度为 , 则下列叙述不正确的是( )A、在内该反应用D的浓度变化表示的反应速率为 B、平衡时A的转化率为25% C、平衡时B的体积分数约为50% D、初始时的压强与平衡时的压强之比为14. 如图为某烃的键线式结构,下列说法错误的是( )
A、a电极上发生还原反应 B、负极的电极反应式为 C、铁表面发生的反应为 D、若标准状况下33.6L空气参与反应,电路中理论上有6mol电子转移13. 在一定温度下,将和放入容积为的某密闭容器中发生反应:。后达到平衡,测得容器内C的浓度为 , 则下列叙述不正确的是( )A、在内该反应用D的浓度变化表示的反应速率为 B、平衡时A的转化率为25% C、平衡时B的体积分数约为50% D、初始时的压强与平衡时的压强之比为14. 如图为某烃的键线式结构,下列说法错误的是( ) A、该烃与环己二烯相差5个“CH2”基团 B、一定条件下,能发生加聚反应 C、苯环上只有一个取代基的同分异构体共有8种 D、该烃和Br2按物质的量之比1:1加成时,所得产物共有5种15. 按图装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是( )
A、该烃与环己二烯相差5个“CH2”基团 B、一定条件下,能发生加聚反应 C、苯环上只有一个取代基的同分异构体共有8种 D、该烃和Br2按物质的量之比1:1加成时,所得产物共有5种15. 按图装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是( )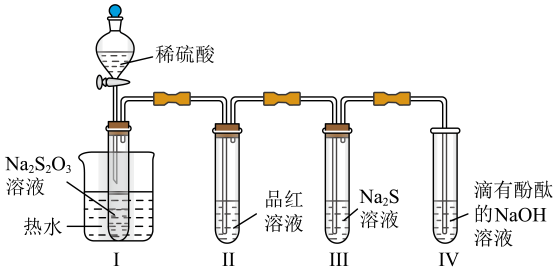 A、Ⅰ中试管内的反应,体现的氧化性 B、Ⅱ中品红溶液褪色,体现的还原性 C、在Ⅰ和Ⅲ的试管中,都出现了浑浊现象 D、撤掉水浴,重做实验,Ⅳ中红色更快褪去16. 下列实验操作和现象得出的结论正确的是( )
A、Ⅰ中试管内的反应,体现的氧化性 B、Ⅱ中品红溶液褪色,体现的还原性 C、在Ⅰ和Ⅲ的试管中,都出现了浑浊现象 D、撤掉水浴,重做实验,Ⅳ中红色更快褪去16. 下列实验操作和现象得出的结论正确的是( )实验操作和现象
实验结论
A
将SO2通入盛有2mL氯水的试管中,氯水的黄绿色褪色
SO2具有氧化性
B
常温下,将铁片、铜片分别插入浓硝酸中,铁片无明显现象,铜片剧烈反应
金属活动性:Cu>Fe
C
取少量无色溶液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体,试纸变蓝色
无色溶液中含有NH
D
取少量无色溶液加入试管中。滴加BaCl2溶液出现白色沉淀,加入稀硝酸,沉淀不溶解
无色溶液中一定含有SO
A、A B、B C、C D、D17. 下图所示为海水综合利用的部分流程,下列有关说法错误的是( ) A、实验室进行①的操作需要用到坩埚、玻璃棒、酒精灯 B、②是一个将电能转化为化学能的过程 C、③④⑤涉及的反应均为氧化还原反应 D、④中反应的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-18. A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。
A、实验室进行①的操作需要用到坩埚、玻璃棒、酒精灯 B、②是一个将电能转化为化学能的过程 C、③④⑤涉及的反应均为氧化还原反应 D、④中反应的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-18. A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。
则下列说法正确的是( )
A、X与A反应的化学方程式是:Al2O3+ 2Fe Fe2O3+ 2Al B、检验D溶液中的金属阳离子的反应:Fe3++3SCN—=Fe(SCN)3↓ C、单质Y在一定条件下能与水发生置换反应 D、由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物19. 番木鳖酸具有一定的抗炎、抗菌活性,结构简式如图。下列说法错误的是( ) A、1mol该物质最多可与2molH2发生加成反应 B、该物质可被酸性KMnO4溶液氧化 C、1mol该物质与足量饱和NaHCO3溶液反应,可放出22.4L(标准状况)CO2 D、一定量的该物质分别与足量Na、NaOH反应,消耗二者物质的量之比为6:120. 向一恒容密闭容器中加入和一定量的 , 发生反应:。的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法错误的是
A、1mol该物质最多可与2molH2发生加成反应 B、该物质可被酸性KMnO4溶液氧化 C、1mol该物质与足量饱和NaHCO3溶液反应,可放出22.4L(标准状况)CO2 D、一定量的该物质分别与足量Na、NaOH反应,消耗二者物质的量之比为6:120. 向一恒容密闭容器中加入和一定量的 , 发生反应:。的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法错误的是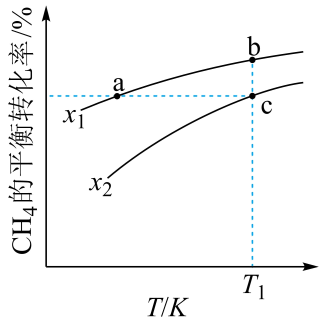 A、 B、反应速率: C、点a、b、c对应的平衡常数: D、反应温度为 , 当容器内压强不变时,反应达到平衡状态
A、 B、反应速率: C、点a、b、c对应的平衡常数: D、反应温度为 , 当容器内压强不变时,反应达到平衡状态二、非选择题(共50分)
-
21. I.以黄铁矿(主要成分为FeS2)为原料制备绿矾晶体(FeSO4•7H2O)的工艺流程如图:

回答下列问题:
(1)、焙烧时黄铁矿要粉碎,其目的是。(2)、SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式。(3)、从还原得到的溶液中获得硫酸亚铁晶体(FeSO4•7H2O)的操作: 蒸发浓缩、、过滤、洗涤、干燥。(4)、II.作为推行“低碳经济”的重要科技进步,太阳能光伏发电成为重要的新型能源。太阳能光伏发电最关键的材料是高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅(Si)的主要方法,生产流程示意如图:
石英砂的主要成分是SiO2 , SiO2是(酸性氧化物或碱性氧化物)。
(5)、“精馏”也是蒸馏的一种形式,通过蒸馏可把液体混合物分离开,原理是利用混合物各成分的(填“熔点”或“沸点”)不同。(6)、整个制备过程必须达到无水无氧,在H2还原SiHCl3过程中若混入O2 , 除了生成SiO2外,还可能引起的后果是。(7)、为达到绿色化学和资源综合利用的目的,在生产过程中物质A需要循环使用,A的化学式是。22. 按要求回答下列问题:(1)、煤燃烧排放的烟气含有和 , 形成酸雨,污染大气,采用碱性溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有和NO的烟气,写出溶液脱硝(主要转化为)过程中主要反应的离子方程式:。(2)、一种熔融碳酸盐燃料电池原理示意如图:电池工作时,外电路上电流的方向应从电极(“填A或B”)流向用电器。内电路中,向电极(“填A或B”)移动,电极A上CO参与的电极反应为。 (3)、某烃的结构简式为
(3)、某烃的结构简式为 ,该分子中可能共面的碳原子数最多有个,一定在同一个平面上的原子至少有个。 (4)、常温下,某气态烃与氧气混合装入密闭容器中,点燃爆炸后回到原温度,此时容器内气体的压强为反应前的一半,经氢氧化钠溶液吸收后,容器内几乎成真空,此烃可能是(写出结构简式)。23. 以天然气(CH4)为原料合成甲醇(CH3OH)。有关热化学方程式如下:
,该分子中可能共面的碳原子数最多有个,一定在同一个平面上的原子至少有个。 (4)、常温下,某气态烃与氧气混合装入密闭容器中,点燃爆炸后回到原温度,此时容器内气体的压强为反应前的一半,经氢氧化钠溶液吸收后,容器内几乎成真空,此烃可能是(写出结构简式)。23. 以天然气(CH4)为原料合成甲醇(CH3OH)。有关热化学方程式如下:①2CH4(g)+O2(g)= 2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②
③
(1)、ΔH2=kJ·mol-1。 反应①自发进行的条件是(填序号)。a 高温 b 低温 c 任何环境都自发 d 任何环境都不自发
(2)、若在一定温度下的恒压容器中只投入1 mol CO和1 mol H2只发生反应②,下列量不再变化时可以判断反应达到平衡的是。a 压强 b 密度 c 混合气的平均摩尔质量 d CO的体积分数
(3)、在体积可变的密闭容器中投入1 mol CO和2 mol H2 , 在不同条件下发生反应:。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。
①M点时,H2的转化率为;压强:p1p2 (填“>”、“<”或“=”)。
②反应速率:N点ʋ正 (CO)M点ʋ逆 (CO)(填“>”、“<”或“=”)。
(4)、③温度为506 ℃时,若压强为p1、在密闭容器中进行上述反应(起始投料不变),平衡时容器体积为1L,则平衡常数K=(用分数表示)。在不同温度下上述反应的平衡常数的对数(lg K)如图2所示,则B、C、D三点中能正确表示该反应的lg K与T的关系的点为(填字母)。④在2 L恒容密闭容器中充入a(a>0) mol H2、2 mol CO和6 mol CH3OH(g),在506 ℃下进行上述反应。为了使该反应逆向进行,a的范围为。