吉林省长春市朝阳区2022-2023学年高二下学期期末考试化学试题
试卷更新日期:2023-08-02 类型:期末考试
一、选择题:本题共20小题,1~15小题,每小题2分,16~20小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 化学与生活、社会发展息息相关,下列说法错误的是( )A、“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 B、“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 C、“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 D、古剑“湛泸”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金2. 化学与生活、科技及环境密切相关。下列说法正确的是( )A、2020年3月9日,发射了北斗系统第五十四颗导航卫星,其计算机的芯片材料是一种有机高分子材料 B、白葡萄酒含维生素C等多种维生素,通常添加微量SO2的目的是防止营养成分被
氧化
C、酒精与84消毒液混合,可增强杀灭新型冠状病毒效果 D、聚合硫酸铁 , 是新型絮凝剂,可用来杀灭水中病菌3. 下列关于2-环己基丙烯( )和2-苯基丙烯(
)和2-苯基丙烯( )的说法中正确的是( ) A、二者均为芳香烃 B、2-环己基丙烯的一氯代产物有7种(不含立体异构体) C、二者均可发生加聚反应和氧化反应 D、2-苯基丙烯分子中所有碳原子一定共平面4. 脱落酸有催熟作用,其结构简式如图所示.下列关于脱落酸的说法中正确的是( )
)的说法中正确的是( ) A、二者均为芳香烃 B、2-环己基丙烯的一氯代产物有7种(不含立体异构体) C、二者均可发生加聚反应和氧化反应 D、2-苯基丙烯分子中所有碳原子一定共平面4. 脱落酸有催熟作用,其结构简式如图所示.下列关于脱落酸的说法中正确的是( ) A、脱落酸能与 发生反应 B、分子中含有两个手性碳原子 C、该分子中含有三种官能团 D、该物质遇溶液会发生显色反应5. 下列除去杂质的方法中,正确的是( )
A、脱落酸能与 发生反应 B、分子中含有两个手性碳原子 C、该分子中含有三种官能团 D、该物质遇溶液会发生显色反应5. 下列除去杂质的方法中,正确的是( )选项
物质(括号内为杂质)
去除杂质的试剂和方法
A
苯(苯酚)
加入过量的浓溴水,过滤
B
乙酸乙酯(乙酸)
NaOH 溶液,分液
C
CO2(SO2)
饱和NaHCO3溶液,洗气
D
HNO3溶液(H2SO4)
加适量 BaCl2溶液,过滤
A、A B、B C、C D、D6. M是合成某具有药理作用的有机物的中间体,其结构如图所示,下列有关M的说法正确的是( ) A、分子中无手性碳原子 B、分子中含有4种官能团 C、1molM最多能与4molH2发生加成反应. D、分子中所有碳原子可能共面7. 2020年12月4日,国家航天局公布的嫦娥五号探测器在月球表面进行国旗展示的照片,这面五星红旗是以芳纶纤维(PPTA,结构如图所示)为原料制得。下列说法正确的是( )
A、分子中无手性碳原子 B、分子中含有4种官能团 C、1molM最多能与4molH2发生加成反应. D、分子中所有碳原子可能共面7. 2020年12月4日,国家航天局公布的嫦娥五号探测器在月球表面进行国旗展示的照片,这面五星红旗是以芳纶纤维(PPTA,结构如图所示)为原料制得。下列说法正确的是( )
 A、PPTA的结构简式可用
A、PPTA的结构简式可用 表示
B、PPTA可由对苯甲酸与对苯二胺加聚反应制得
C、PPTA中存在酰胺基和氢键,易溶于水
D、一定条件下,1mol对苯二甲酸最多可与5molH2发生加成反应
8. 有机物M具有一定的抗炎、抗菌活性,其结构简式如图。下列说法正确的是( )
表示
B、PPTA可由对苯甲酸与对苯二胺加聚反应制得
C、PPTA中存在酰胺基和氢键,易溶于水
D、一定条件下,1mol对苯二甲酸最多可与5molH2发生加成反应
8. 有机物M具有一定的抗炎、抗菌活性,其结构简式如图。下列说法正确的是( ) A、该有机物可以发生取代反应、加成反应和消去反应 B、该有机物含有羧基、醛基、羟基和碳碳双键4种官能团 C、1mol该有机物分别与足量Na、NaOH反应,消耗二者物质的量之比为6:5 D、该有机物不能使溴的四氯化碳溶液褪色,但能使酸性KMnO4溶液褪色9. 摩尔日(Mole Day)是一个流传于化学家之间的节日,通常在10月23日的上午6:02到下午6:02之间庆祝,被记为6:02 10/23,恰似阿伏加德罗常数。设为阿伏加德罗常数的值,下列说法正确的是A、0.1mol肼含有的孤电子对数为 B、固体中含有个阳离子 C、电解饱和食盐水时,若阴阳两极产生气体的总体积为44.8L,则转移电子数为 D、与足量充分反应,生成个分子10. 电石渣[主要成分为Ca(OH)2]是氯碱工业中的废料,某同学在实验室以电石渣为原料制取KClO3的工艺流程如图所示:
A、该有机物可以发生取代反应、加成反应和消去反应 B、该有机物含有羧基、醛基、羟基和碳碳双键4种官能团 C、1mol该有机物分别与足量Na、NaOH反应,消耗二者物质的量之比为6:5 D、该有机物不能使溴的四氯化碳溶液褪色,但能使酸性KMnO4溶液褪色9. 摩尔日(Mole Day)是一个流传于化学家之间的节日,通常在10月23日的上午6:02到下午6:02之间庆祝,被记为6:02 10/23,恰似阿伏加德罗常数。设为阿伏加德罗常数的值,下列说法正确的是A、0.1mol肼含有的孤电子对数为 B、固体中含有个阳离子 C、电解饱和食盐水时,若阴阳两极产生气体的总体积为44.8L,则转移电子数为 D、与足量充分反应,生成个分子10. 电石渣[主要成分为Ca(OH)2]是氯碱工业中的废料,某同学在实验室以电石渣为原料制取KClO3的工艺流程如图所示:
已知:Ca(ClO3)2易溶于水。
下述叙述中正确的是( )
A、上述流程中所用Cl2是用MnO2与浓盐酸反应制得,体现了盐酸的酸性和氧化性 B、工业生产电石(CaC2)的反应为CaO+3CCaC2+CO↑,该反应中氧化剂与还原剂的物质的量之比为1∶2 C、“转化”发生反应的离子方程式为Ca2++ClO+K++CO=CaCO3↓+KClO3 D、操作I为过滤11. 金属汞用途广泛,其熔点,沸点分别约为。目前,工业上制汞的流程如图所示。下列分析中错误的是( ) A、辰砂与氧化钙加热反应时,既是氧化剂又是还原剂 B、辰砂与氧化钙加热反应时,为氧化产物 C、洗涤粗汞可用5%的盐酸代替5%的硝酸 D、吸入汞蒸气会引起中毒,因此在生产过程中要增加保护措施12. 能正确表示下列反应的离子方程式的是( )A、硫酸铝溶液和小苏打溶液反应Al3++3HCO=3CO2↑+Al(OH)3↓ B、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO C、向CuS沉淀中加入稀硫酸:CuS+2H+=Cu2++H2S↑ D、双氧水中加入稀硫酸和KI溶液: H2O2+2I-=I2+H2O13. 室温下,下列各组离子在指定溶液中可能大量共存的是( )A、饱和氯水中Cl-、Na+、SO、NO B、水电离的氢离子浓度为1.0×10-13mol/L 溶液中:CO、K+、SO、Br- C、pH=12的溶液中NO、 I-、Na+、Al3+ D、Na2S溶液中SO、K+、Cl-、Cu2+14. 微粒观和变化观是化学基本观念的重要组成部分。常温下,下列溶液中的微粒能大量共存的是( )A、加入铝粉产生气泡的溶液:K+、、Na+、 B、用硫酸酸化的高锰酸钾溶液:Pb2+、HS-、Mg2+、I- C、使石蕊试液变红的溶液:Al3+、、Fe2+、Br- D、0.1mol·L-1的FeCl2溶液:Ba2+、、ClO-、15. 以废弃锌锰干电池(主要成分是Zn和 , 还含有少量炭黑)为原料制取、溶液,进而得到复合微肥的流程如下:
A、辰砂与氧化钙加热反应时,既是氧化剂又是还原剂 B、辰砂与氧化钙加热反应时,为氧化产物 C、洗涤粗汞可用5%的盐酸代替5%的硝酸 D、吸入汞蒸气会引起中毒,因此在生产过程中要增加保护措施12. 能正确表示下列反应的离子方程式的是( )A、硫酸铝溶液和小苏打溶液反应Al3++3HCO=3CO2↑+Al(OH)3↓ B、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO C、向CuS沉淀中加入稀硫酸:CuS+2H+=Cu2++H2S↑ D、双氧水中加入稀硫酸和KI溶液: H2O2+2I-=I2+H2O13. 室温下,下列各组离子在指定溶液中可能大量共存的是( )A、饱和氯水中Cl-、Na+、SO、NO B、水电离的氢离子浓度为1.0×10-13mol/L 溶液中:CO、K+、SO、Br- C、pH=12的溶液中NO、 I-、Na+、Al3+ D、Na2S溶液中SO、K+、Cl-、Cu2+14. 微粒观和变化观是化学基本观念的重要组成部分。常温下,下列溶液中的微粒能大量共存的是( )A、加入铝粉产生气泡的溶液:K+、、Na+、 B、用硫酸酸化的高锰酸钾溶液:Pb2+、HS-、Mg2+、I- C、使石蕊试液变红的溶液:Al3+、、Fe2+、Br- D、0.1mol·L-1的FeCl2溶液:Ba2+、、ClO-、15. 以废弃锌锰干电池(主要成分是Zn和 , 还含有少量炭黑)为原料制取、溶液,进而得到复合微肥的流程如下:
下列说法正确的是( )
A、浸取时,与FeS(不溶于水)反应的离子方程式: B、浸取液中主要存在离子有:、、、、、 C、过滤II所得的滤渣为 D、过滤所得、溶液中:16. NaH与水发生反应:。现将0.01molNaH与适量的水完全反应,得到100mL溶液。设NA为阿伏加德罗常数的值。下列说法不正确的是( )A、该反应中NaH失去电子的数目为0.02NA B、0.01molNaH固体中,质子数为0.12NA C、所得溶液中浓度为 D、该反应中产生的体积约为0.224L(标准状况)17. F、K和Ni三种元素组成的一种化合物的晶胞如图所示。下列说法错误的是( ) A、Ni位于元素周期表d区 B、该物质的化学式为K2NiF4 C、Ni的配位数为6 D、该晶体属于分子晶体18. 立方砷化硼(BAs)有潜力成为比硅更优良的半导体材料,BAs的晶胞结构如图所示:
A、Ni位于元素周期表d区 B、该物质的化学式为K2NiF4 C、Ni的配位数为6 D、该晶体属于分子晶体18. 立方砷化硼(BAs)有潜力成为比硅更优良的半导体材料,BAs的晶胞结构如图所示:
若晶胞参数为apm,下列有关说法错误的是( )
A、该晶胞中所含As的个数与As的配位数相等 B、基态B原子核外电子的空间运动状态有3种 C、晶胞中As原子与B原子的最近距离为 D、晶胞在xy面上的投影图为 19. 化学烫发巧妙利用了头发中蛋白质发生化学反应实现对头发的“定型”,其变化过程示意图如下。下列说法不正确的是
19. 化学烫发巧妙利用了头发中蛋白质发生化学反应实现对头发的“定型”,其变化过程示意图如下。下列说法不正确的是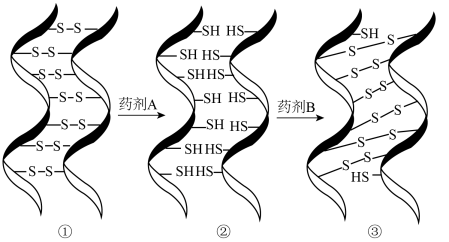 A、药剂A具有还原性 B、①→②过程若有键断裂,则转移电子 C、②→③过程若药剂B是 , 其还原产物为 D、化学烫发通过改变头发中某些蛋白质中键位置来实现头发的定型20. 铼的配合物( ReO3CH3 , 用MTO表示)可催化醛烯烃基化,反应过程如图所示。
A、药剂A具有还原性 B、①→②过程若有键断裂,则转移电子 C、②→③过程若药剂B是 , 其还原产物为 D、化学烫发通过改变头发中某些蛋白质中键位置来实现头发的定型20. 铼的配合物( ReO3CH3 , 用MTO表示)可催化醛烯烃基化,反应过程如图所示。
下列叙述错误的是( )
A、ReO2(CH3)=CR1R2是反应的中间体 B、醛烯烃基化反应为N2 =CR1R2 + R3CHO + P(C6H5)3R3CH=CR1R2+N2↑+O=P (C6H5)3
C、有机物N2=CR1R2中的N原子最外层满足8电子结构,则N与N原子之间是单键 D、存在反应: +3P(C6H5)3→O=P(C6H5)3+
+3P(C6H5)3→O=P(C6H5)3+
二、综合题:本题共4小题,共54分。
-
21. 写出下列反应的离子方程式。(1)、钛铁矿(主要成分为 , 为价)加盐酸“酸浸”后钛主要以的形式存在,写出相应反应的离子方程式:。(2)、用碘滴定法测定葡萄酒中焦亚硫酸钠残留量时,写出滴定反应的离子方程式:。(3)、草酸( , 弱酸)及其化合物在工业中有重要作用。草酸具有较强的还原性,与氧化剂作用易被氧化成二氧化碳和水,故实验室可利用草酸测定次氯酸钠溶液的浓度。实验步骤如下:取草酸溶液于锥形瓶中,用次氯酸钠溶液滴定,至终点时消耗次氯酸钠溶液为。
①次氯酸钠与草酸反应的离子方程式为。
②次氯酸钠溶液物质的量浓度为。
(4)、根据“机理图”书写方程式。①酸性环境中脱硫过程示意图如图:
 过程ⅰ反应的离子方程式为。
过程ⅰ反应的离子方程式为。 ②酸性环境中,纳米去除分两步,将步骤ⅱ补充完整:。
②酸性环境中,纳米去除分两步,将步骤ⅱ补充完整:。ⅰ、;
ⅱ、。
③氧化可除去氨氮,反应机理如图所示(其中和NaCl略去):氧化的总反应的化学方程式为。
 22. 蜂胶是一种天然抗癌药,主要活性成分为咖啡酸苯乙酯(I)。合成化合物I 的路线如下:
22. 蜂胶是一种天然抗癌药,主要活性成分为咖啡酸苯乙酯(I)。合成化合物I 的路线如下: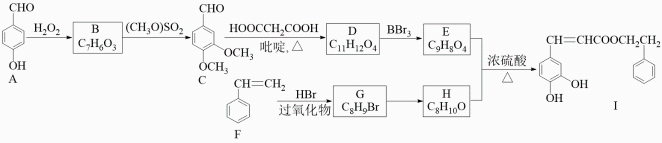
已知:①

②RCHO+HOOCCH2COOH RCH=CHCOOH
③当羟基与双键碳原子相连时,易发生转化:RCH=CHOHRCH2CHO。
请回答下列问题:
(1)、化合物A 的名称是;化合物B 中官能团的名称为。(2)、写出化合物C 与新制Cu(OH)2悬浊液反应的化学方程式。(3)、F→G 的反应类型是;写出 G→H 反应的化学方程式。(4)、化合物 W 与 E 互为同分异构体,两者所含官能团种类和数目完全相同,且苯环上只有 3 个取代基, 则 W 可能的结构有种(不考虑顺反异构),其中核磁共振氢谱显示有 5 种不同化学环境的氢,峰面积比为 2:2:2:1:1,写出符合要求的 W 的结构简式。23. 2-甲基-2-丁醇是一种重要的有机化合物,可用于合成香料、农药等。某化学兴趣小组欲利用格氏试剂法制备2-甲基-2-丁醇。实验原理及具体操作步骤如下:
Ⅰ.乙基溴化镁的制备
如图安装好装置(夹持仪器未画出),在三颈烧瓶中加入1.7g镁屑及一小粒碘。在恒压滴液漏斗中加入5.0mL溴乙烷和15mL无水乙醚,混匀。开动搅拌,慢慢滴加混合液,维持反应液呈微沸状态。滴加完毕后,用温热回流搅拌30min,使镁屑几乎作用完全。
Ⅱ.与丙酮的加成反应
将三颈烧瓶置于冰水浴中,在搅拌下从恒压漏斗中缓慢滴入5mL丙酮及5mL无水乙醚混合液,滴加完毕后,在室温下搅拌15min,瓶中有灰白色粘稠状固体析出。
Ⅲ.加成物的水解和产物的提取
将三颈烧瓶在冰水冷却和搅拌下,从恒压漏斗中滴入30mL20%硫酸溶液。滴加完毕后,分离出醚层,水层用无水乙醚萃取2次,合并醚层,用5%碳酸钠溶液洗涤,再用无水碳酸钾干燥。搭建蒸馏装置,热水浴蒸去乙醚后,收集95~105℃馏分。称重,计算产率。
已知:①RMgBr化学性质活泼,易与、R′X等发生反应生成RH、R-R′;
②各物质的沸点见下表:
物质
无水乙醚
溴乙烷
丙酮
2-甲基-2-丁醇
沸点(℃)
34.6
38.4
56.5
102.5
③乙醚遇明火易燃烧

回答下列问题:(1)、仪器a的名称是。(2)、干燥管中无水氯化钙的作用是。(3)、微热或加入小颗粒碘单质可引发与镁屑的反应,其中碘的作用可能是;不宜使用长时间放置的镁屑进行实验,其原因是。(4)、滴加丙酮及稀硫酸时采用冰水冷却的目的是。(5)、蒸去乙醚时采用热水浴的原因是。(6)、起始加入三颈烧瓶中溴乙烷的体积为5mL,密度为1.28g/mL,最终所得产品的质量为2.69g,则2-甲基-2-丁醇的产率为(结果保留2位有效数字)。24. 一种用硫铜矿(主要含CuS、及少量FeO、等)为原料制备CuCl的工艺流程如下:
已知:①CuCl是难溶于水和醇的白色固体,在热水中迅速水解生成;
②CuCl在潮湿的空气中易被氧化,生成的碱式盐为;
③已知、、开始生成沉淀和沉淀完全时的pH如下表:
金属离子
开始沉淀pH
4.7
8.1
1.2
完全沉淀pH
6.7
9.6
3.2
回答下列问题:
(1)、“酸浸”时,富氧空气的作用。(2)、“酸浸”时,CuS反应的化学方程式为。(3)、用氨水调pH时,应将溶液的范围调整为。(4)、“合成”时,生成CuCl发生反应的离子方程式为。(5)、准确称取所制备的氯化亚铜样品m g,将其置于过量的溶液中,待样品完全溶解后,加入适量稀硫酸,用x mol⋅L的溶液滴定到终点,发生反应为 , 消耗溶液V mL,样品中CuCl的质量分数为(杂质不参与反应,列出计算式即可)。(6)、如图是氯化亚铜的晶胞结构,已知晶胞的棱长为a nm。
①图中原子的坐标参数:A为 , B为 , 则C的坐标参数为。
②与最短的距离是nm。