高考二轮复习知识点:制备实验方案的设计8
试卷更新日期:2023-08-02 类型:二轮复习
一、选择题
-
1. 实验室利用下图所示装置制备。已知:的沸点 , 易水解;在常压下沸点约(同时分解),易水解,可与氢氟酸反应制备。下列说法错误的是( )
 A、仪器Ⅰ中的a为冷凝水的进水口 B、仪器Ⅱ的主要作用是吸收和空气中的水蒸气 C、制备完成后,可减压蒸馏分离出 D、用制备时,可在玻璃仪器中进行2. 利用氧化制备的装置如图所示(夹持装置略):
A、仪器Ⅰ中的a为冷凝水的进水口 B、仪器Ⅱ的主要作用是吸收和空气中的水蒸气 C、制备完成后,可减压蒸馏分离出 D、用制备时,可在玻璃仪器中进行2. 利用氧化制备的装置如图所示(夹持装置略):
已知:锰酸钾浓强碱溶液中可稳定存在,碱性减弱时易发生反应:下列说法错误的是( )
A、装置D中的试剂为氢氧化钠等碱性溶液 B、若去掉装置B,可能会导致产率降低 C、B和D装置名称不一样,即使在没装试剂之前,二者位置也不能互换 D、装置A中发生反应的离子方程式为:3. 用下列装置进行相应的实验,不能达到实验目的的是( )A
B
C
D
用此装置制备无水MgCl2
检验溴乙烷消去产物中的乙烯
观察气泡鉴别乙醇与甲醚(CH3OCH3)
用此装置制备溴苯并验证有HBr产生



 A、A B、B C、C D、D4. 实验室用下图装置制备气体,合理的是( )
A、A B、B C、C D、D4. 实验室用下图装置制备气体,合理的是( )
选项
反应试剂
制备的气体
A
电石、饱和食盐水
C2H2
B
FeS、稀 H2SO4
H2S
C
Zn、稀 H2SO4
H2
D
大理石、稀 HCl
CO2
A、A B、B C、C D、D5. 某矿石中含有硅、铁、铝的氧化物,为综合开发资源提高矿石的利用率,化工厂采取如图工艺制备铁红和AlCl3•6H2O。下列说法错误的是( ) A、“酸浸”过程中选择盐酸比硫酸更为合适 B、“氧化”过程中少量多次添加双氧水可有效减少Fe3+催化H2O2分解 C、“洗涤”的操作是将沉淀转移至洁净的烧杯中,加蒸馏水清洗2~3次 D、将SOCl2与AlCl3•6H2O混合并加热,可得到无水AlCl36. 用如图所示装置制备并收集气体,其中合理的是( )
A、“酸浸”过程中选择盐酸比硫酸更为合适 B、“氧化”过程中少量多次添加双氧水可有效减少Fe3+催化H2O2分解 C、“洗涤”的操作是将沉淀转移至洁净的烧杯中,加蒸馏水清洗2~3次 D、将SOCl2与AlCl3•6H2O混合并加热,可得到无水AlCl36. 用如图所示装置制备并收集气体,其中合理的是( )
选项
反应物
制备的气体
A
稀盐酸+石灰石
CO2
B
浓盐酸+MnO2
Cl2
C
HNO3 (稀) +铜片
NO
D
H2SO4 (稀) +Zn
H2
A、A B、B C、C D、D7. 下列实验装置能达到实验目的的是( )A
B
C
D




制纯碱
制NH3
制SO2
制取乙烯
A、A B、B C、C D、D二、多选题
-
8. 实验室可用如图所示装置(夹持、加热装置略去)制备一定量的草酸()。其中制备原理为

下列说法正确的是( )
A、淀粉的分子式为 B、装置A反应中每生成1mol转移电子的物质的量为6mol C、实验时在装置C中充入的目的是将和NO充分转化为 D、向反应后的装置A中滴加溶液,有气泡产生,说明酸性大于9. 下列实验操作和现象正确并与预期实验目的或结论一致的是( )选项
实验操作和现象
预期实验目的或结论
A
将过量稀硫酸加入碳酸钠溶液中,观察到有无色气泡产生
非金属性:S>C
B
向品红溶液中通入足量Cl2 , 观察到品红溶液褪色
Cl2具有漂白性
C
向0.1mol•L-1FeCl3溶液中滴加稀氨水,观察到溶液由黄色变为红褐色
制备Fe(OH)3胶体
D
将10~15滴溴乙烷和1mL5%NaOH溶液混合后加热,然后静置,待溶液分层后,取上层液体于另一支试管中,先加入足量稀硝酸酸化,再滴加AgNO3溶液,观察到有浅黄色沉淀生成
检验溴乙烷中的溴原子
A、A B、B C、C D、D10. 某炼铁废渣中含有大量CuS及少量铁的化合物,工业上以该废渣为原料生产 晶体的工艺流程如下: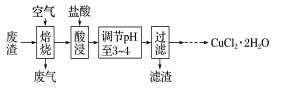
下列说法正确的是( )
A、滤渣为Fe(OH)3 B、焙烧过程中每消耗1 mol CuS则消耗1.5 mol O2 C、焙烧后的废气能够使酸性高锰酸钾溶液褪色,证明该气体具有漂白性 D、将获得的CuCl2·2H2O晶体直接加热分解可制得CuCl2固体11. 以菱镁矿(主要成分为MgCO3 , 含少量SiO2/Fe2O3和Al2O3)为原料制备高纯镁砂的工艺流程如下:
已知浸出时产生的废渣中有SiO2、Fe(OH)3和Al(OH)3 , 下列说法错误的是( )
A、浸出镁的反应为 B、浸出和沉镁的操作均应在较高温度下进行 C、流程中可循环使用的物质只有NH3 D、分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同12. Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。一种制取Cl2O的装置如图所示。
已知:Cl2O的熔点为-116℃,沸点为3.8℃;Cl2的沸点为-34.6℃;HgO+2Cl2=HgCl2+Cl2O。
下列说法中错误的是( )
A、装置②、③中盛装的试剂依次是浓硫酸和饱和食盐水 B、通入干燥空气的目的是将生成的Cl2O稀释减小爆炸危险 C、从装置⑤中逸出气体的主要成分是Cl2O D、装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸三、非选择题
-
13.
乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备.

完成下列填空:
(1)、实验时,通常加入过量的乙醇,原因是 . 加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是;浓硫酸用量又不能过多,原因是 .(2)、饱和Na2CO3溶液的作用是 .(3)、反应结束后,将试管中收集到的产品倒入分液漏斗中,、 , 然后分液.(4)、若用b装置制备乙酸乙酯,其缺点有、 . 由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是 , 分离乙酸乙酯与该杂质的方法是 .14.以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如图1:
 (1)、氯化过程控制电石渣过量,在75℃左右进行.氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2 , 少量Ca(ClO)2 分解为CaCl2和O2 .
(1)、氯化过程控制电石渣过量,在75℃左右进行.氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2 , 少量Ca(ClO)2 分解为CaCl2和O2 .①生成Ca(ClO)2的化学方程式为 .
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有(填序号).
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(2)、氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为:6Ca(OH)2+6Cl2═Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤.
①滤渣的主要成分为(填化学式).
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]:n[CaCl2]1:5(填“>”、“<”或“=”).
(3)、向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3 , 若溶液中KClO3的含量为100g▪L﹣1 , 从该溶液中尽可能多地析出KClO3固体的方法是 .15.[实验化学]
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2 , 实验装置如图所示.当溶液pH约为4时,停止反应.在20℃静置结晶,生成Na2S2O5的化学方程式为:2NaHSO3═Na2S2O5+H2O.
 (1)、SO2与Na2CO3溶液反应生成NaHSO3和CO2 , 其离子方程式为 .(2)、装置Y的作用是 .(3)、析出固体的反应液经减压抽滤,洗涤,25℃﹣30℃干燥,可获得Na2S2O5固体.
(1)、SO2与Na2CO3溶液反应生成NaHSO3和CO2 , 其离子方程式为 .(2)、装置Y的作用是 .(3)、析出固体的反应液经减压抽滤,洗涤,25℃﹣30℃干燥,可获得Na2S2O5固体.①组成减压抽滤装置的主要仪器是布氏漏斗、和抽气泵.
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体,用饱和SO2水溶液洗涤的目的是 .
(4)、实验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4 , 其可能的原因是 .16.[化学--选修2:化学与技术]双氧水是一种重要的氧化剂、漂白剂和消毒剂.生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:

生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水.回答下列问题:
(1)、蒽醌法制备H2O2理论上消耗的原料是 , 循环使用的原料是 , 配制工作液时采用有机溶剂而不采用水的原因是 .(2)、氢化物A中反应的化学方程式为 . 进入氧化塔C的反应混合液中的主要溶质为 .(3)、萃取塔D中的萃取剂是 , 选择其作萃取剂的原因是 .(4)、工作液再生装置F中要除净残留的H2O2 , 原因是 .(5)、双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为 , 一种双氧水的质量分数为27.5%(密度为1.10g•cm﹣3),其浓度为mol•L﹣1 .17.NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
 (1)、NaClO2中Cl的化合价为 .(2)、写出“反应”步骤中生成ClO2的化学方程式 .(3)、“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+ , 要加入的试剂分别为、 . “电解”中阴极反应的主要产物是 .(4)、“尾气吸收”是吸收“电解”过程排出的少量ClO2 . 此吸收反应中,氧化剂与还原剂的物质的量之比为 , 该反应中氧化产物是 .(5)、“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力.NaClO2的有效氯含量为 . (计算结果保留两位小数)18.
(1)、NaClO2中Cl的化合价为 .(2)、写出“反应”步骤中生成ClO2的化学方程式 .(3)、“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+ , 要加入的试剂分别为、 . “电解”中阴极反应的主要产物是 .(4)、“尾气吸收”是吸收“电解”过程排出的少量ClO2 . 此吸收反应中,氧化剂与还原剂的物质的量之比为 , 该反应中氧化产物是 .(5)、“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力.NaClO2的有效氯含量为 . (计算结果保留两位小数)18.[化学--选修2:化学与技术]高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等.以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:

回答下列问题:
(1)、原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 .(2)、“平炉”中发生的化学方程式为 .(3)、“平炉”中需要加压,其目的是 .(4)、将K2MnO4转化为KMnO4的生产有两种工艺.①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4 , MnO2和(写化学式).
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为
, 阴极逸出的气体是 .
③“电解法”和“CO2歧化法”中,K2MnO4的理论利用率之比为 .
(5)、高锰酸钾纯度的测定:称取1.0800g样品,溶解后定容于100mL容量瓶中,摇匀.取浓度为0.2000mol•L﹣1的H2C2O4标准溶液20.00mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48mL,该样品的纯度为(列出计算式即可,已知2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O).19.过氧化钙微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂.以下是一种制备过氧化钙的实验方法.回答下列问题:
(一)碳酸钙的制备
 (1)、步骤①加入氨水的目的是 . 小火煮沸的作用是使沉淀颗粒长大,有利于 .(2)、
(1)、步骤①加入氨水的目的是 . 小火煮沸的作用是使沉淀颗粒长大,有利于 .(2)、如图是某学生的过滤操作示意图,其操作不规范的是(填标号).

a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加过过滤速度
(3)、(二)过氧化钙的制备

步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈性(填“酸”、“碱”或“中”).将溶液煮沸,趁热过滤,将溶液煮沸的作用是 .
(4)、步骤③中反应的化学方程式为 , 该反应需要在冰浴下进行,原因是 .(5)、将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是 .(6)、制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品.该工艺方法的优点是 , 产品的缺点是 .20.无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2 , 装置如图1,主要步骤如下:

步骤1 三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴.
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中.
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚溴化镁粗品.
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品.
已知:①Mg与Br2反应剧烈放热;MgBr2具有强吸水性.
②MgBr2+3C2H5OC2H5⇌MgBr2•3C2H5OC2H5
请回答:
(1)、仪器A的名称是 . 实验中不能用干燥空气代替干燥N2 , 原因是 .(2)、如将装置B改为装置C(图2),可能会导致的后果是 .(3)、步骤3中,第一次过滤除去的物质是 .(4)、有关步骤4的说法,正确的是 .A、可用95%的乙醇代替苯溶解粗品 B、洗涤晶体可选用0℃的苯 C、加热至160℃的主要目的是除去苯 D、该步骤的目的是除去乙醚和可能残留的溴(5)、为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Mg2++Y4﹣═MgY2﹣
①滴定前润洗滴定管的操作方法是 .
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol•L﹣1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是(以质量分数表示).
21.CuCl广泛应用于化工和印染等行业.某研究性学习小组拟热分解CuCl2•2H2O制备CuCl,并进行相关探究.
【资料查阅】

【实验探究】
该小组用如图所示装置进行实验(夹持仪器略).

请回答下列问题:
(1)、仪器X的名称是 .(2)、实验操作的先后顺序是a→→e(填操作的编号)a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)、在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是 .(4)、装置D中发生的氧化还原反应的离子方程式是 .(5)、【探究反思】反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:①若杂质是CuCl2 , 则产生的原因是 .
②若杂质是CuO,则产生的原因是 .
22.资源的高效利用对保护环境.促进经济持续健康发展具有重要作用.磷尾矿主要含Ca5(PO4)3F和CaCO3•MgCO3 . 某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2其简化流程如图:

已知:①Ca5(PO4)3F在950℃不分解
②4Ca5(PO4)3F+18SiO2+30C
 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4请回答下列问题:
(1)、950℃煅烧磷尾矿生成气体的主要成分是(2)、实验室过滤所需的玻璃仪器是(3)、NH4NO3溶液能从磷矿Ⅰ中浸取出Ca2+的原因是(4)、在浸取液Ⅱ中通入NH3 , 发生反应的化学方程式是(5)、工业上常用磷精矿[Ca5PO4)3F]和硫酸反应制备磷酸.已知25℃,101kPa时:CaO(s)+H2SO4(l)═CaSO4(s)+H2O(l)△H=﹣271kJ/mol5CaO(s)+3H3PO4(l)+HF(g)═Ca5(PO4)3F(s)+5H2O(l)△H=﹣937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是
(6)、在一定条件下CO(g)+H2O(g)⇌CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了 . 若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4 , 将产生的CO与H2O(g)按起始物质的量之比1:3混合,则在相同条件下达平衡时能产生H2kg.23. 是一种浅粉色晶体,易溶于水。是饲料中常用的添加剂,也是电解锰及其他锰盐的原料,工业用途广泛。某同学设计下列实验装置制备硫酸锰:
回答下列问题:
(1)、装置Ⅰ盛放的固体药品是(填化学式)。(2)、装置Ⅱ中反应的化学方程式为;实验中提高反应速率的措施有;反应后从溶液得到的操作为。(3)、兴趣小组同学拟继续研究硫酸锰晶体高温分解的固体产物,经查资料可知:硫酸锰晶体高温下的分解产物为、、及水蒸气。为了确定的化学式,采用下列装置进行测定(已知:的熔点为16.8℃,沸点为44.8℃)。
①装置正确的连接顺序为h→。
②在装置中加入152.1g , 充分反应后,测得质量为19.2g,则的化学式为。
(4)、测定饲料中硫酸锰含量常将饲料溶于水,以磷酸作络合剂,用硝酸铵作氧化剂,将试样中的二价锰定量氧化成三价锰,过量的硝酸铵立即与产生的亚硝酸盐反应而消除其影响。然后加入指示剂,用硫酸亚铁铵标准溶液滴定生成的三价锰,溶液由红色变为亮黄色为滴定终点。有关离子反应方程式为:、、
取ag饲料,消耗浓度为c的硫酸亚铁按标准溶液VmL,则饲料中的质量分数为(用含a、c、V的表达式表示),若滴定前平视读数,滴后俯视,则会导致测定结果(填“偏大”、“偏小”或“无影响”)
24. 正戊醚可用作油脂、生物碱的萃取剂,Grignard反应的溶剂。以正戊醇为原料制备正戊醚的反应原理、有关数据和实验装置(夹持仪器已省略)如下:2CH3CH2CH2CH2CH2OHCH3CH2CH2CH2CH2OCH2CH2CH2CH2CH3+H2O
名称
相对分子质量
密度/(g·cm-3)
沸点/℃
水中溶解性
正戊醇
88
0.82
137.5
微溶
正戊醚
158
0.78
186.7
难溶

实验步骤:①向三颈烧瓶中加入43mL(约0.4mol)正戊醇及6mL浓硫酸,摇动使混合均匀,再加入几粒沸石。
②按示意图连接装置,向分水器中预先加少量水(略低于直管口)。维持反应约1小时。
③待反应液冷却后依次用60mL水、30mL水、20mLNaOH溶液和20mL水洗涤。
④分离出的产物加入约3g无水氯化钙颗粒,静置一段时间过滤除去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正戊醚15.8g。
回答下列问题:
(1)、根据上述实验药品的用量,三颈烧瓶最适宜规格为。A.100mL B.150mL C.250mL D.500mL(2)、将实验步骤②补全:按示意图连接装置,向分水器中预先加少量水(略低于直管口)。 , 维持反应约1小时。(3)、装置中分水器的作用是 , 判断反应已经完成的标志是。(4)、洗涤粗正戊醚在(填“仪器名称”)中进行;最后一次水洗的目的是。(5)、本次实验的产率为(某种生成物的实际产量与理论产量的百分比)。25. 钛在医疗领域的应用非常广泛,如:制人造关节、头盖、主动心瓣等。TiCl4是制备金属钛的重要中间体,某小组同学利用如下装置在实验室制备TiCl4 (夹持装置略)。
资料表明:室温下,TiCl4为无色液体,易挥发,高温时能与O2反应,与HCl不发生反应。其他相关信息如下表所示:
物质
熔点/℃
沸点/℃
水溶性
TiCl4
- 25
136.4
易水解成白色沉淀,能溶于有机溶剂
CCl4
-23
76.8
难溶于水
请回答下列问题:
(1)、实验中起冷凝作用的仪器的名称是。(2)、装置A中发生反应的离子方程式为。(3)、装置B的作用是。(4)、组装好仪器后,部分实验操作步骤如下:①加热装置C中陶瓷管②打开分液漏斗 活塞③关闭分液漏斗活塞④检查装置气密性 ⑤停止加热,充分冷却⑥装入药品,正确的操作顺序是( 填操作序号)。(5)、装置C中除生成TiCl4外,同时还生成一种有毒气体,该反应的化学方程式为。(6)、装置D的锥形瓶中可能会有少量CCl4可用的方法分离除去。(7)、该实验设计略有缺陷,请指出其不足之处:。(8)、利用如图装置测定所得TiCl4的纯度:取m g TiCl4产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴0.1 mol·L-1 K2CrO4溶液作指示剂(Ag2CrO4呈砖红色),用c mol·L-1AgNO3溶液滴定至终点,消耗滴定液V mL。[已知: TiCl4+(2+n)H2O= TiO2·nH2O↓+4HCl;常温下,Ksp(AgCl)=1.8 ×10-10 , Ksp(Ag2CrO4)=1. 1×10-12],根据上述数据计算该产品纯度为(用含m、c和V的代数式表示)。 26. 硫氰化钾(KSCN)是一种用途广泛的化学药品。某小组以二疏化碳(CS2)和氨水为原料制备KSCN晶体,按如下流程开展了实验:
26. 硫氰化钾(KSCN)是一种用途广泛的化学药品。某小组以二疏化碳(CS2)和氨水为原料制备KSCN晶体,按如下流程开展了实验:
已知:①CS2不溶于水,密度比水的大;不溶于CS2;
②
请回答:
(1)、步骤Ⅰ中判断反应已经完全的实验现象是(2)、步骤Ⅱ的脱硫蒸发的目的是除去 , 产生的气体用上图1进行吸收。
①采用多孔球泡的作用是
②吸收硫化氢的离子反应方程式是
(3)、下列说法错误的是____A、步骤Ⅲ可以用溶液潜换KOH溶液 B、步骤Ⅳ中减压蒸发可以加快蒸发速率及防止产物的分解 C、步骤Ⅳ中采取冰水快速冷却溶液以得到颗粒比较大的晶体 D、步骤Ⅳ中采用的离心分离是借助于离心力,使密度不同的物质进行分离的方法(4)、步骤Ⅴ提纯的方法是KSCN粗品在沸腾的乙醇中重结晶。请给出合理的操作排序:(下列提供的部分步骤可不用,也可重复使用)→→→→→→纯品
a.趁热过滤 b.粗品溶于乙醇制热饱和溶液 c.粗品溶于水制热饱和溶液 d.缓慢冷却 e.加入活性炭回流脱色 f.100℃减压干燥 h.抽滤
(5)、测定产品中KSCN的含量:称取10.0g样品,配成1000mL溶液。量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴溶液,用标准溶液滴定,达到滴定终点时消耗溶液20.00mL。滴定时发生的反应:)
①判断到达滴定终点的方法是
②样品中KSCN的质量分数为(计算结果精确至0.1%)。
27. 实验室可用如图所示装置模拟工业上制备FeCl3的过程,向500~600℃的铁粉中通入Cl2制备无水FeCl3(熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解)
已知:工业上采用向炽热铁粉中通入HCl制备FeCl2(熔点为670℃,易升华)。
请按要求回答下列相关问题:
(1)、完善该实验步骤:①将n导管口与图中装置导管口(填字母)连接;检查装置的气密性;盛装药品。
②启动装置A反应,直至。
③用酒精灯在铁屑下方加热,假设铁屑反应完全。
④体系冷却后,停止装置A中反应;改用干燥的气体Y,Y可能是(填化学式)赶尽体系中的气体,将收集器密封。
(2)、装置A中生成气体X反应的离子方程式为。(3)、为在收集器中收集到更多的产品,装置D已采取的有效措施:用较粗的导管m、。(4)、用此装置制得的产品比理论含Fe量偏高,其中含有杂质是(填化学式);为验证此结论,除了蒸馏水外,还需的试剂Z是;为消除该误差,需对装置进行的改进是。(5)、某同学为了验证FeCl3溶液与K3[Fe(CN)6]溶液中的铁元素存在形式的区别,进行了如表实验:操作
现象
结论
i.向盛有2mL蒸馏水的试管a中滴加2滴FeCl3溶液,然后再滴加2滴KSCN溶液
②
④
ii.①
③
28. 是一种高性能磁性材料。实验室以为原料制备的流程如下:第一步:将向浊液中通入 , 发生反应;
第二步:向溶液中加入 , 有气体逸出,同时获得粗产品。
已知部分含锰化合物的溶解性如下:
含锰化合物
溶解性
不溶
不溶
可溶
不溶
完成下列填空:
(1)、①第一步的反应装置如下图所示:
②石灰乳的作用是。
③反应过程中,为使尽可能转化完全,在通入与比例一定,不改变与用量的条件下,可以采取的合理措施有(任写一种)。
(2)、若实验中将换成空气,测得反应液中的浓度随反应时间t变化如图。导致溶液中浓度变化产生明显差异的原因可能是:。 (3)、完成第二步反应的离子方程式: , 实验发现,若用相同物质的量浓度的溶液代替溶液,则得到的中会混有较多的杂质,该杂质可能是(填化学式)。
(3)、完成第二步反应的离子方程式: , 实验发现,若用相同物质的量浓度的溶液代替溶液,则得到的中会混有较多的杂质,该杂质可能是(填化学式)。实验室可以用无色的酸性溶液来检验,原理如下所示:
已知的结构如下图所示。
(4)、标明上述反应的电子转移方向与数目。确认溶液中是否含的操作与现象是:。(5)、利用重量法探究的热分解,数据如下表所示(残留固体均为锰的氧化物):实验
固体质量g
加热前
加热至后
第一组(空气氛围)
3.450
2.610
第二组(氢气氛围)
3.450
2.130
①第二组实验中残留固体的化学式为。
②结合两组实验数据,推测在空气中加热至时发生反应的化学方程式:。
29. 五氧化二氮(N2O5)是一种绿色硝化剂,在军用炸药、火箭推进剂、医药等工业中得到广泛应用。常温下N2O5为白色固体,可溶于二氯甲烷等氯代烃溶剂,微溶于水且与水反应生成硝酸,高于室温时不稳定。回答下列问题:(1)、1840年,Devill将干燥的氯气通入无水硝酸银中,首次制得了固体N2O5。该反应的氧化产物为空气中的主要成分之一,写出反应的化学方程式:。(2)、某化学兴趣小组设计用臭氧(O3)氧化法制备N2O5 , 反应原理为 N2O4+O3→N2O5+O2。实验装置如下图:
装置B的仪器名称是;装置E的作用是。实验时,先将三口烧瓶C浸入 (填字母编号)中,打开装置A中分液漏斗的活塞,随即关闭。一段时间后C中液体变为红棕色。然后打开活塞K,通过臭氧发生器向三口烧瓶中通入含有臭氧的氧气。
a.热水 b.冰水 c.自来水 d.饱和食盐水
(3)、C中二氯甲烷(CH2Cl2)的作用是 (填字母编号)。判断C中反应已结束的简单方法是。a.溶解反应物NO2 b.充分混合反应物使其反应更加充分 c.控制O3的通入速度 d.溶解生成物N2O5
(4)、该装置存在一处明显缺陷,请指出。(5)、N2O5粗产品中常含有N2O4。该兴趣小组用滴定法测定N2O5粗产品的纯度。取2.0g粗产品,加入20.00mL 0.1250mol·L-1酸性高锰酸钾溶液。充分反应后,用0.1000mol·L-1 H2O2溶液滴定剩余的高锰酸钾,达到滴定终点时,消耗H2O2溶液17.50mL。已知:N2O4与KMnO4发生反应的离子方程式为5N2O4+2MnO+2H2O→Mn2++10NO+4H+ , H2O2与KMnO4发生反应的离子方程式为5H2O2+2MnO+6H+→2Mn2++5O2↑+8H2O,H2O2与HNO3不反应且不考虑其分解。判断滴定到达终点的方法是。粗产品的纯度为(结果保留三位有效数字)。30. 化工原料K2([Cu(C2O4)2]·2H2O(二草酸合铜酸钾晶体)为蓝色针状或絮状沉淀,某校同学设计实验制备K2([Cu(C2O4)2]·2H2O,并进行性质探究。已知: Cu(OH)2分解温度为80℃; Cu2O 为红色。
回答下列相关问题:
(1)、 [实验一] 制备K2([Cu(C2O4)2]·2H2O晶体向CuSO4溶液中加入足量NaOH,搅拌加热至80~90℃,观察到的现象是; 采用如图装置抽滤,打开水龙头,可在布氏漏斗中快速过滤出沉淀,快速过滤的原理是。
 (2)、将H2C2O4·2H2O和K2CO3溶液混合制备KHC2O4溶液,则酸性H2C2O4 H2CO3(填“大于”“小于”或“等于”)。(3)、将(1)步抽滤出的沉淀加入(2) 步KHC2O4溶液中,50℃的水浴加热充分反应,过滤得K2([Cu(C2O4)2]·2H2O。发生反应的化学方程式为。(4)、 [实验二]探究K2([Cu(C2O4)2]·2H2O晶体热分解产物
(2)、将H2C2O4·2H2O和K2CO3溶液混合制备KHC2O4溶液,则酸性H2C2O4 H2CO3(填“大于”“小于”或“等于”)。(3)、将(1)步抽滤出的沉淀加入(2) 步KHC2O4溶液中,50℃的水浴加热充分反应,过滤得K2([Cu(C2O4)2]·2H2O。发生反应的化学方程式为。(4)、 [实验二]探究K2([Cu(C2O4)2]·2H2O晶体热分解产物按如图所示,装置B、C、F中均盛有足量的澄清石灰水。

实验操作步骤为:连接装置→ (用 数字编号回答)
a.检查装置气密性;b. 加热两处酒精灯;c. 熄灭两处酒精灯: d.通氮气;e.停止通氮气;f.装入药品
①f→a→b→d→e→c ②a→f→d→b→c→e
③a→f→b→d→e→c ④f→a→d→b→c→e
(5)、D中盛放的试剂是 , 将K2([Cu(C2O4)2]·2H2O晶体持续加热至600℃左右,观察到装置B中澄清石灰水变浑浊,E中黑色固体变为红色,由此可判断分解产生的气体产物为。 充分分解后冷却,观察到A中固体未见黑色物质,取少量固体于试管中,滴加足量稀硫酸振荡,有气体产生,溶液变蓝,静置仍有红色固体,由此判断试管A中固体成分为(将可能情况全部列出)。31. 高铁酸钾(K2FeO4)是一种绿色净水剂。某课外小组利用KClO与Fe(NO3)3、KOH溶液反应制备K2FeO4 , 其方法是先用Cl2与KOH溶液反应制取KClO,再向KClO溶液中加入KOH、Fe(NO3)3溶液。装置如下图所示(部分夹持装置已省略):
已知:①Cl2与KOH溶液的反应是放热反应,在20℃以下反应生成KClO,在较高温度时则生成KClO3;②K2FeO4易溶于水、微溶于浓KOH溶液,在0~5 ℃的强碱性环境中较稳定。
回答下列问题:
(1)、仪器a的名称是 , 装置A中发生反应的化学方程式为 , 装置B的作用是。(2)、装置C中三颈烧瓶置于冰水浴中的目的是;搅拌的作用是 , 向三颈烧瓶中加入KOH、Fe(NO3)3溶液,搅拌并在0~5 ℃下反应制得K2FeO4 , 反应的离子方程式为。(3)、装置D的作用是。(4)、测定制得K2FeO4样品的质量分数。称取4.0g K2FeO4样品溶于适量的KOH溶液中,向其中加入足量的KCrO2溶液,充分反应后过滤,滤液在250 mL容量瓶中定容。取25. 00 mL加入稀硫酸酸化,用0.2 mol·L-1的(NH4)2 Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为24. 00 mL,K2FeO4样品的质量分数为。已知相关反应为
① + +2H2O=Fe(OH)3↓+ +OH-;
②2 +2H+= +H2O;
③ +6Fe2+ +14H+=6Fe3+ +2Cr3+ +7H2O。
32. 过氧化锶可作为曳光弹、焰火的引火剂,亦用于漂白、制药行业。是一种白色粉末,加热条件下可与、水蒸气反应,室温时在水中逐渐形成无色晶体 , 遇酸能生成过氧化氢。(1)、实验室利用锶单质制备过氧化锶可能用到的仪器如下:
①按气流从左到右的流向,制备过氧化锶的导管接口顺序为a→。(选择必要的仪器,可重复选择)
②在空气中会变质生成碳酸盐,写出该反应的化学方程式。
(2)、通入氨气的条件下,在水溶液中可制备得到 , 实验装置如下:
仪器a的名称为 , 装置乙的作用为。
(3)、装置丙中制备的离子方程式 , 的作用是。(4)、为测定样品的纯度,可进行下列实验:准确称取2.0g样品置于锥形瓶中,加入适量的盐酸充分溶解;加入过量KI溶液,摇匀后置于暗处;充分反应后加入少量淀粉溶液,用0.8000mol/L标准溶液滴定至溶液蓝色恰好消失,记下此时消耗标准溶液的体积,重复实验3~4次,得下表数据:平行实验
1
2
3
4
消耗标准溶液体积(mL)
14.98
14.50
15.00
15.02
样品的纯度为。(已知:)
33. 硫酸镍(NiSO4)是电镀镍工业所用的主要镍盐,易溶于水。下图为某兴趣小组设计的在实验室中制备NiSO4·6H2O的装置。
回答下列问题:
(1)、仪器a的名称为 , 有同学认为将图甲中仪器a换作图乙中的仪器b效果更好,其理由为。(2)、混酸与镍粉反应时,除生成NiSO4外,还生成了NO2、NO和H2O,若NO2与NO的物质的量之比为3:1,则该反应的氧化剂与还原剂的物质的量之比为。如果产生的气体被NaOH溶液完全吸收,写出气体与NaOH溶液反应的离子方程式:;从反应后的溶液中得到NiSO4·6H2O的操作有和过滤等。(3)、该小组同学查阅资料发现用镍粉与混酸制备NiSO4成本高,用冶铁尾矿提取的草酸镍(NiC2O4)与硫酸制取NiSO4成本较低。反应原理为:NiC2O4NiO+CO↑+CO2↑,NiO+H2SO4=NiSO4+H2O(已知PdCl2溶液能够吸收CO)。现加热NiC2O4制备NiO,并检验生成的CO,可能用到的装置如下:
①各装置的连接顺序为:(填装置标号,可重复使用)。

②能够说明生成CO的现象有。
(4)、将NiSO4·6H2O制成电镀液时往往加入少量稀硫酸,其目的是。(5)、在NaOH溶液中用NaClO与NiSO4反应可得NiO(OH),NiO(OH)与贮氢的镧镍合金可组成镍氢碱性电池(KOH溶液),工作原理为:LaNi5H6+6NiO(OH)LaNi5+6NiO+6H2O,负极的电极反应式:。34. 重铬酸铵[(NH4)2Cr2O7 ]可用作媒染剂和有机合成催化剂,具有强氧化性。实验室将NH3通入重铬酸(H2Cr2O7)溶液中制备[(NH4)2Cr2O7 ],的装置如图所示(夹持装置略)。回答下列问题:
已知: (橙色)+ H2O2 (黄色)+2H+。
(1)、仪器a的名称是 , b处的作用为;实验时控制三颈烧瓶内溶液pH约为4,pH不宜过大的原因是;A 装置的作用为。(2)、在试管中加入少量(NH4)2Cr2O7固体,加水溶解,再滴加足量KOH浓溶液,振荡,微热,观察到的主要现象是。(3)、实验室常用甲醛法测定含(NH4)2Cr2O7的产品中(NH4)2Cr2O7的质量分数,其反应原理为2Ba2+ + +H2O=2BaCrO4 +2H+、4 +6HCHO=(CH2)6N4H+ +6H2O+ 3H+ , 然后用NaOH标准溶液滴定反应生成的酸。实验步骤:Ⅰ.称取样品12. 00 g,配成250 mL溶液。
Ⅱ.量取25.00mL样品溶液,用氯化钡溶液使完全沉淀后,加入足量的20%中性甲醛溶液,摇匀,静置5 min。
Ⅲ.以酚酞作指示剂,用1. 00 mol·L-1的NaOH标准溶液滴定,记录数据。
Ⅳ.重复步骤Ⅱ、Ⅲ2~3次,处理数据。
①滴定终点的颜色变化为。
②用(填“酸式”或“碱式”)滴定 管量取25.00 mL样品溶液于 250 mL锥形瓶中。
③与NaOH反应时,1 mol(CH2)6N4H+与1 mol H+相当,步骤III中(CH2)6N4H+与NaOH发生反应的离子方程式是。
④若实验平均消耗NaOH溶液的体积为16.00mL,则所得产物中(NH4)2Cr2O7 (摩尔质量为252 g·mol-1)的质量分数为%。
⑤若滴定终点时仰视读数,则测定的质量分数将(填“偏大”、“偏小”或“不变”)。
35. 乙酸硅[ (CH3COO)4Si,熔点:110℃,沸点:148℃]是白色至米色晶体。某校同学设计实验先制备SiCl4(熔点:-70℃,沸点:57.6℃,极易水解),再由SiCl4与乙酸酐[(CH3CO)2O(熔点:-73℃,沸点:140℃反应制备乙酸硅。回答下列问题:(1)、制备SiCl4装置(部分夹持仪器已省路)如下:
①A中制取Cl2反应的离子方程式为。
②B中盛放的试剂是。
③F中收集到的气体是CO,制备SiCl4的化学方程式为。
④上述设计的装置有一处明显不妥,改进的方法是。
(2)、制备(CH3COO)4Si的反应装置如图所示。将一定量的SiCl4放入仪器a中,在电磁搅拌下,由滴液漏斗滴入过量的乙酸酐,关闭活塞。SiCl4和(CH3CO)2O的反应为放热反应,反应后反应混合物带色,并开始析出(CH3COO)4Si晶体。
①仪器a的名称为;图中支管的作用是。
②写出生成(CH3COO)4Si的化学方程式: (生成物有两种)。
③完成反应后,将反应混合液放置数日,再用干冰-丙酮浴冷却后,将导管伸入液面以下,(结合装置图填写操作),获得(CH3COO)4Si晶体粗品,若得到较纯 (CH3COO)4Si,则下一步操作为。