高考二轮复习知识点:制备实验方案的设计7
试卷更新日期:2023-08-02 类型:二轮复习
一、选择题
-
1.
实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有碳等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是( )
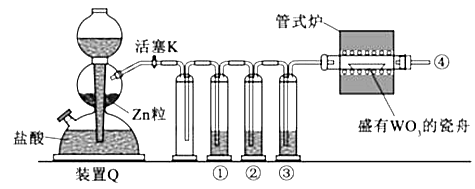 A、①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 B、管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体浓度 C、结束反应时,先关闭活塞K,再停止加热 D、装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气2. 可用于制陶瓷、药物、催化剂等,微溶于水,在冷水中溶解度较热水中大,不溶于醇。利用海水资源(主要含、 , 少量的、、、、)制备碳酸锂的一种工艺如图所示:
A、①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 B、管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体浓度 C、结束反应时,先关闭活塞K,再停止加热 D、装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气2. 可用于制陶瓷、药物、催化剂等,微溶于水,在冷水中溶解度较热水中大,不溶于醇。利用海水资源(主要含、 , 少量的、、、、)制备碳酸锂的一种工艺如图所示: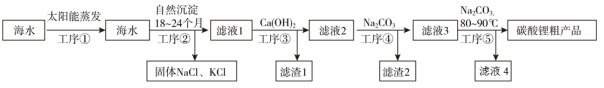
下列说法错误的是( )
A、工序③和工序④顺序可互换 B、选择温度为80~90℃,可降低碳酸锂在水中的溶解度,提高产率 C、用乙醇洗涤粗产品可起到快速干燥的效果 D、利用重结晶可分离和3. Li和N2在450℃时反应制得储氢材料Li3N,Li3N易水解,在空气中加热可发生剧烈燃烧。下图是某实验小组设计的实验室制备少量Li3N的装置图。下面有关说法错误的是( ) A、洗气瓶a中盛放NaOH溶液 B、浓硫酸的作用是防止空气中的水蒸气和氧气进入d,避免Li3N水解和燃烧 C、反应时,先对d加热,再点燃c中酒精灯 D、取少量反应后固体,滴加酚酞溶液,若溶液变红不能说明反应后固体中含Li3N4. 1-丁醇、溴化钠和70%的硫酸共热反应,经过回流、蒸馏、萃取分液制得1-溴丁烷粗产品,装置如图所示:
A、洗气瓶a中盛放NaOH溶液 B、浓硫酸的作用是防止空气中的水蒸气和氧气进入d,避免Li3N水解和燃烧 C、反应时,先对d加热,再点燃c中酒精灯 D、取少量反应后固体,滴加酚酞溶液,若溶液变红不能说明反应后固体中含Li3N4. 1-丁醇、溴化钠和70%的硫酸共热反应,经过回流、蒸馏、萃取分液制得1-溴丁烷粗产品,装置如图所示:
已知:
下列说法正确的是( )
A、装置I中回流的目的是为了提高产率 B、装置II中a为进水口,b为出水口 C、用装置III萃取分液时,将分层的液体依次从下放出 D、蒸馏完毕后,应先停止通冷凝水,再停止加热5. 实验室制备硫氰酸钾的装置如图所示: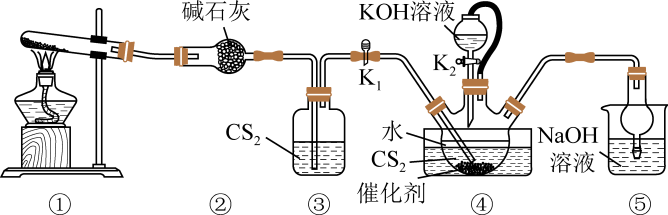
已知:;密度大于水。下列说法错误的是( )
A、根据观察③中气泡流速调控①的加热温度 B、④中长导管必须插入液面以下 C、滴加生成的反应为 D、⑤的主要作用为除去 , 防止空气污染6. 某同学分别用下列装置a和b制备溴苯,下列说法错误的是( ) A、两烧瓶中均出现红棕色气体,说明液溴沸点低 B、a装置锥形瓶中出现淡黄色沉淀,说明烧瓶中发生取代反应 C、b装置试管中CCl4吸收Br2 , 液体变红棕色 D、b装置中的倒置漏斗起防倒吸作用,漏斗内形成白烟7. 已知锰酸钾(K2MnO4)在浓的强碱溶液中可稳定存在,在强碱性K2MnO4溶液中通入CO2气体发生反应:3+2CO2=2+MnO2↓+2 , 当溶液的pH值达到10~11之间时,即停止通CO2 , 然后把溶液加热,趁热用砂芯漏斗抽滤,滤去MnO2残渣,即可制得KMnO4 , 下列用CO2与K2MnO4制备KMnO4的实验原理和装置不能达到实验目的的是( )
A、两烧瓶中均出现红棕色气体,说明液溴沸点低 B、a装置锥形瓶中出现淡黄色沉淀,说明烧瓶中发生取代反应 C、b装置试管中CCl4吸收Br2 , 液体变红棕色 D、b装置中的倒置漏斗起防倒吸作用,漏斗内形成白烟7. 已知锰酸钾(K2MnO4)在浓的强碱溶液中可稳定存在,在强碱性K2MnO4溶液中通入CO2气体发生反应:3+2CO2=2+MnO2↓+2 , 当溶液的pH值达到10~11之间时,即停止通CO2 , 然后把溶液加热,趁热用砂芯漏斗抽滤,滤去MnO2残渣,即可制得KMnO4 , 下列用CO2与K2MnO4制备KMnO4的实验原理和装置不能达到实验目的的是( ) A、用装置甲制取CO2 B、用装置乙除去CO2中的HCl C、用装置丙使K2MnO4转化成KMnO4 D、用装置丁分离出溶液中的MnO28. 硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO)生产ZnSO4•7H2O的流程如图:
A、用装置甲制取CO2 B、用装置乙除去CO2中的HCl C、用装置丙使K2MnO4转化成KMnO4 D、用装置丁分离出溶液中的MnO28. 硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO)生产ZnSO4•7H2O的流程如图:
下列叙述错误的是( )
A、“溶浸”时搅拌可以加快“溶浸”速率,“滤渣A”的主要成分是PbSO4 B、NaClO的作用主要是将Fe2+氧化为Fe3+方便以沉淀的形式除去 C、“反应II”中,加入锌粉时反应的离子方程式为Cu2++Zn=Zn2++Cu D、从滤液获得ZnSO4•7H2O的实验操作为蒸发结晶、洗涤、干燥9. 下列实验操作不能达到实验目的的是( )实验目的
实验操作
A
配制 Na2S 溶液
将 Na2S 固体加入适量 NaOH 溶液,搅拌
B
除去MgCl2溶液中的Fe2+杂质
加入H2O2 , 再加入 MgO,搅拌、静置、过滤
C
测定 NaHCO3溶液的浓度
用标准 HCl 溶液滴定 NaHCO3溶液,用甲基橙作指示剂
D
证明2Fe3++2I-2Fe2++I2反应存在限度
将浓度均为 0.1mol/L 的硫酸铁溶液和 KI 溶液等体积混合, 充分反应后再滴加数滴 KSCN 溶液,振荡
A、A B、B C、C D、D10. 目前碘酸钾被广泛应用于食盐加碘。一种由含碘的酸性废水制取碘酸钾的工艺如下,其中“制”时,会水解形成胶状物吸附 , 造成的损失。下列说法正确的是 ( ) A、滤渣1能够完全溶解于稀硫酸中 B、该流程涉及的化学反应均为氧化还原反应 C、制备时要控制溶液的不宜过大 D、制备过程中,理论上消耗的与的物质的量之比为11. ZnS常用于制造分析试剂荧光体、光导体材料、染料、涂料、颜料、玻璃、固化油等。以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
A、滤渣1能够完全溶解于稀硫酸中 B、该流程涉及的化学反应均为氧化还原反应 C、制备时要控制溶液的不宜过大 D、制备过程中,理论上消耗的与的物质的量之比为11. ZnS常用于制造分析试剂荧光体、光导体材料、染料、涂料、颜料、玻璃、固化油等。以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
已知:常温下,;;。离子浓度小于10-5时,可认为沉淀完全,下列说法错误的是( )
A、常温下使Fe3+沉淀完全的最小 B、还原过程中加入的物质X可能是金属Zn C、沉淀过程中发生反应的离子方程式为 D、第二次调节pH也可以用ZnO,但不能用、二、多选题
-
12. 硫酰氯(SO2Cl2)是一种重要的化工试剂。实验室合成硫酰氯的部分实验装置如图所示(部分夹持装置未画出):
已知:①SO2(g)+Cl2(g)=SO2Cl2(l)ΔH<0
②硫酰氯熔点为-54.1℃,沸点为69.1℃,易水解,100℃以上分解生成二氧化硫和氯气。
下列说法错误的是( )
 A、装置甲、装置丙中所装药品都是浓硫酸 B、装置乙中球形干燥管盛装的药品可以是无水CaCl2 , 作用是防止空气中的水蒸气进入装置 C、装置丁中饱和食盐水的作用是排出氯气进入乙中与二氧化硫反应 D、硫酰氯与氢氧化钠反应可以生成两种盐分别是Na2SO3和NaCl13. 氯化亚铜为白色粉末状固体,难溶于水和乙醇,潮湿时易被氧化,可用作催化剂、杀菌剂、媒染剂等。工业以硫化铜精矿为原料,制备氯化亚铜的流程如图:
A、装置甲、装置丙中所装药品都是浓硫酸 B、装置乙中球形干燥管盛装的药品可以是无水CaCl2 , 作用是防止空气中的水蒸气进入装置 C、装置丁中饱和食盐水的作用是排出氯气进入乙中与二氧化硫反应 D、硫酰氯与氢氧化钠反应可以生成两种盐分别是Na2SO3和NaCl13. 氯化亚铜为白色粉末状固体,难溶于水和乙醇,潮湿时易被氧化,可用作催化剂、杀菌剂、媒染剂等。工业以硫化铜精矿为原料,制备氯化亚铜的流程如图:
下列说法正确的是( )
A、步骤①焙烧产生的有毒气体可用碱液吸收 B、步骤②所用硫酸浓度越大浸出速率越快 C、步骤③离子方程式: D、步骤④用乙醇洗涤的目的是使 尽快干燥,防止被空气氧化14. 碘酸钾(KIO3)是重要的食品添加剂,某化学兴趣小组査阅资料得知,HIO3与KIO3均为白色固体,能溶于水,难溶于部分有机溶剂,且KIO3在碱性条件下易被ClO氧化为KIO4 , 于是设计了以下路线制备碘酸钾。下列有关说法正确的是( )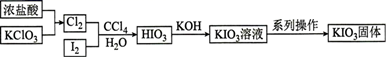 A、浓盐酸在反应中体现了氧化性 B、加入CCl4目的是萃取I2 C、加入KOH前,应先对原溶液加热煮沸 D、系列操作包括:加入乙醇溶液、搅拌、静置、过滤、洗涤、干燥15. 二氧化氯(ClO2)是一种黄绿色气体,易溶于水,熔点为﹣59.5℃,沸点为11.0℃,浓度过高时易发生分解引起爆炸,制备二氧化氯溶液的装置如图。下列说法错误的是( )
A、浓盐酸在反应中体现了氧化性 B、加入CCl4目的是萃取I2 C、加入KOH前,应先对原溶液加热煮沸 D、系列操作包括:加入乙醇溶液、搅拌、静置、过滤、洗涤、干燥15. 二氧化氯(ClO2)是一种黄绿色气体,易溶于水,熔点为﹣59.5℃,沸点为11.0℃,浓度过高时易发生分解引起爆炸,制备二氧化氯溶液的装置如图。下列说法错误的是( ) A、装置A发生的反应中氧化剂与还原剂的物质的量之比为2:1 B、实验中氮气的作用就是将装置内的空气排出 C、装置B可以起到防止倒吸的作用 D、当看到装置C中导管液面上升时应减慢氮气的通入速率16. 乳酸亚铁晶体是一种优良补铁剂,可由乳酸与碳酸亚铁反应制得。实验室制备碳酸亚铁的装置如图所示,下列说法正确的是( )
A、装置A发生的反应中氧化剂与还原剂的物质的量之比为2:1 B、实验中氮气的作用就是将装置内的空气排出 C、装置B可以起到防止倒吸的作用 D、当看到装置C中导管液面上升时应减慢氮气的通入速率16. 乳酸亚铁晶体是一种优良补铁剂,可由乳酸与碳酸亚铁反应制得。实验室制备碳酸亚铁的装置如图所示,下列说法正确的是( ) A、仪器B为蒸馏烧瓶,此仪器可直接进行加热 B、稀硫酸和Fe粉反应的目的是生成Fe2+溶液,同时防止Fe2+被氧化 C、仪器C中反应的离子方程式为Fe2++HCO =FeCO3↓+H+ D、向B反应后的溶液中加入NaOH溶液,若无白色沉淀,证明Fe2+全部进入了C中
A、仪器B为蒸馏烧瓶,此仪器可直接进行加热 B、稀硫酸和Fe粉反应的目的是生成Fe2+溶液,同时防止Fe2+被氧化 C、仪器C中反应的离子方程式为Fe2++HCO =FeCO3↓+H+ D、向B反应后的溶液中加入NaOH溶液,若无白色沉淀,证明Fe2+全部进入了C中三、非选择题
-
17. KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:(1)、KIO3的化学名称是。(2)、利用“KClO3氧化法”制备KIO3工艺流程如下图所示:
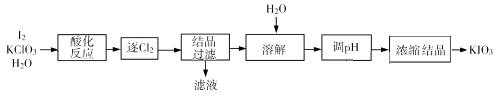
“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是。“滤液”中的溶质主要是。“调pH”中发生反应的化学方程式为。
(3)、KClO3也可采用“电解法”制备,装置如图所示。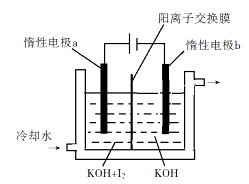
①写出电解时阴极的电极反应式。
②电解过程中通过阳离子交换膜的离子主要为 , 其迁移方向是。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有(写出一点)。
18. 以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示: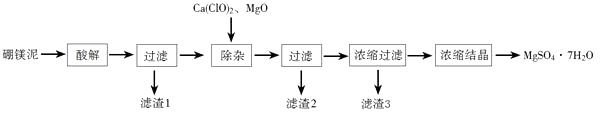
硼镁泥的主要成分如下表:
MgO
SiO2
FeO、Fe2O3
CaO
Al2O3
B2O3
30%~40%
20%~25%
5%~15%
2%~3%
1%~2%
1%~2%
回答下列问题:
(1)、“酸解”时应该加入的酸是 , “滤渣1”中主要含有(写化学式)。(2)、“除杂”时加入次氯酸钙、氧化镁的作用分别是、。(3)、判断“除杂”基本完成的检验方法是。(4)、分离滤渣3应趁热过滤的原因是。19.TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
化合物
SiCl4
TiCl4
AlCl3
FeCl3
MgCl2
沸点/℃
58
136
181(升华)
316
1412
熔点/℃
﹣69
25
193
304
714
在TiCl4中的溶解性
互溶
﹣
微溶
难溶
(1)、氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行.
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H1=+175.4kJ•mol﹣1
2C(s)+O2(g)=2CO(g)△H2=﹣220.9kJ•mol﹣1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式: .
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的
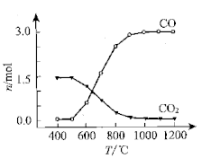
△H0(填“>”“<”或“=”),判断依据: .
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是 .
④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有 .
(2)、精制过程:粗TiCl4经两步蒸馏得纯TiCl4 . 示意图如下:
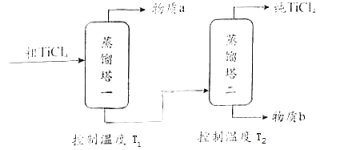
物质a是 , T2应控制在 .
20.(15分)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO•Cr2O3 , 还含有硅、铝等杂质.制备流程如图所示:
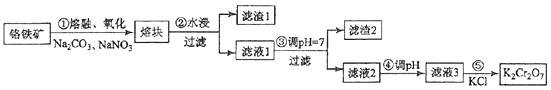
回答下列问题:
(1)、步骤①的主要反应为:FeO•Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeO•Cr2O3与NaNO3的系数比为 . 该步骤不能使用陶瓷容器,原因是 .(2)、滤渣1中含量最多的金属元素是 , 滤渣2的主要成分是及含硅杂质.(3)、步骤④调滤液2的pH使之变(填“大”或“小”),原因是(用离子方程式表示).(4)、有关物质的溶解度如图所示.
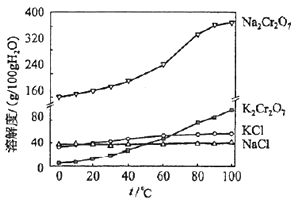
向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体.冷却到(填标号)得到的K2Cr2O7固体产品最多.
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是 .
(5)、某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7 , 最终得到产品 m2 kg,产率为 .21.B . [实验化学]
1﹣溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g•cm﹣3 . 实验室制备少量1﹣溴丙烷的主要步骤如下:
步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20mL水,冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24g NaBr.
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止.

步骤3:将馏出液转入分液漏斗,分出有机相.
步骤4:将分出的有机相转入分液漏斗,依次用12mL H2O、12mL 5% Na2CO3溶液和12mL H2O洗涤,分液,得粗产品,进一步提纯得1﹣溴丙烷.
(1)、仪器A的名称是;加入搅拌磁子的目的是搅拌和 .(2)、反应时生成的主要有机副产物有2﹣溴丙烷和 .(3)、步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是 .(4)、步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是 .(5)、步骤4中用5%Na2CO3溶液洗涤有机相的操作:向分液漏斗中小心加入12mL 5% Na2CO3溶液,振荡, , 静置,分液.22. 碱式氯化铜是重要的无机杀菌剂.(1)、碱式氯化铜有多种制备方法①方法1:45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2•3H2O,该反应的化学方程式为 .
②方法2:先制得CuCl2 , 再与石灰乳反应生成碱式氯化铜.Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2 , Fe3+对该反应有催化作用,其催化原理如图所示. M'的化学式为 .
 (2)、碱式氯化铜有多种组成,可表示为Cua(OH)bClc•xH2O. 为测定某碱式氯化铜的组成,进行下列实验:
(2)、碱式氯化铜有多种组成,可表示为Cua(OH)bClc•xH2O. 为测定某碱式氯化铜的组成,进行下列实验:①称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得AgCl 0.1722g;
③另取25.00mL溶液A,调节pH 4~5,用浓度为0.08000mol•L﹣1的EDTA(Na2H2Y•2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++H2Y2﹣═CuY2﹣+2H+),滴定至终点,消耗标准溶液30.00mL.通过计算确定该样品的化学式(写出计算过程).
23.(14分)Li4Ti3O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为Fe TiO3 , 还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
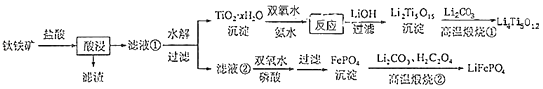
回答下列问题:
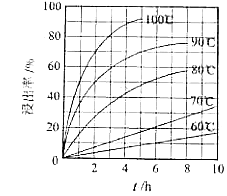
(1)、“酸浸”实验中,铁的浸出率结果如下图所示.由图可知,当铁的净出率为70%时,所采用的实验条件为 .
 (2)、“酸浸”后,钛主要以TiOCl42﹣形式存在,写出相应反应的离子方程式 .(3)、TiO2•xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
(2)、“酸浸”后,钛主要以TiOCl42﹣形式存在,写出相应反应的离子方程式 .(3)、TiO2•xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:温度/℃
30
35
40
45
50
TiO2•xH2O转化率/%
92
95
97
93
88
分析40℃时TiO2•xH2O转化率最高的原因 .
(4)、Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为 .(5)、若“滤液②”中c(Mg2+)=0.02mol•L﹣1 , 加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10﹣5 , 此时是否有Mg3(PO4)2沉淀生成?(列式计算).FePO4、Mg3(PO4)2的分别为1.3×10﹣22、1.0×10﹣24(6)、写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 .24. 在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:(已知:Ksp[Fe(OH)3]=4.0×10﹣38)Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气.
回答下列问题:
(1)、FeCl3蚀刻铜箔反应的离子方程式为:(2)、过程Ⅰ加入铁屑的主要作用是 , 分离得到固体的主要成分是 , 从固体中分离出铜需采用的方法是;(3)、过程Ⅱ中发生反应的化学方程式为;(4)、过程Ⅱ中调节溶液的pH为5,金属离子浓度为 . (列式计算)25.KAl(SO4)2•12H2O(明矾)是一种复盐,在造纸等方面应用广泛.实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示.回答下列问题:
 (1)、为尽量少引入杂质,试剂①应选用(填标号).
(1)、为尽量少引入杂质,试剂①应选用(填标号).a.HCl溶液 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)、易拉罐溶解过程中主要反应的化学方程式为 .(3)、沉淀B的化学式为;将少量明矾溶于水,溶液呈弱酸性,其原因是 .(4)、已知:Kw=1.0×10﹣14 , Al(OH)3⇌AlO2﹣+H++H2O K=2.0×10﹣13 . Al(OH)3溶于NaOH溶液反应的平衡常数等于 .26. 为测定某氟化稀土样品中氟元素的质量分数,进行如图实验。利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再进行吸收滴定来测定含量。实验装置如图所示。 (1)、装置d的名称是。玻璃管a的作用为。(2)、实验步骤:①连接好实验装置,检查装置气密性;②往c中加入mg氟化稀土样品和一定体积的高氯酸,f中盛有滴加酚酞的NaOH溶液。加热装置b、c。
(1)、装置d的名称是。玻璃管a的作用为。(2)、实验步骤:①连接好实验装置,检查装置气密性;②往c中加入mg氟化稀土样品和一定体积的高氯酸,f中盛有滴加酚酞的NaOH溶液。加热装置b、c。①下列物质可代替高氯酸的是(填序号)。
A.硫酸 B.盐酸 C.硝酸 D.磷酸
②装置b中产生的水蒸气的作用是。
(3)、定量测定:将f中得到的馏出液配成100mL溶液,取其中20mL加入V1mLamol·L-1La(NO3)3溶液,得到LaF3沉淀(不考虑其他沉淀的生成),再用bmol·L-1冠醚标准溶液滴定剩余La3+(La3+与冠醚按1:1配合),消耗冠醚标准溶液V2mL,则氟化稀土样品中氟的质量分数为。(4)、问题讨论:若观察到f中溶液红色褪去,可采用最简单的补救措施是。否则会使实验结果。实验中除有HF气体外,可能还有少量SiF4(极易水解)气体生成。若有SiF4生成,实验结果将。(填“偏高”“偏低”或“不受影响”)。理由是。27. 某湿法炼锌的萃余液中含有Na+、Zn2+、Fe2+、 Mn2+、Co2+、Cd2+及30 ~60g·L-1 H2SO4等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图:
已知:
沉淀物
Fe(OH)3
Fe(OH)2
Co(OH)2
Co(OH)3
Cd(OH)2
Ksp
2.6×10-39
4.9×10-17
5.9×10-15
1.6× 10-44
7.2× 10-15
回答下列问题:
(1)、“中和氧化水解”时,先加入适量的石灰石调节溶液的pH为1.0;加入一定量的Na2S2O8;再加入石灰石调节溶液的pH为4.0。①氧化”时,Mn2+转化为MnO2除去,反应的离子方程式为。
②“沉渣”的主要成分除MnO2外还有。
③“氧化”时,若加入过量的Na2S2O8 , 钴元素将会进入“沉渣”中,则水解后的溶液中含钴微粒的浓度为mol·L-1。
(2)、“除镉”时,主要反应的离子方程式为。(3)、“沉锌”时,在近中性条件下加入Na2CO3可得碱式碳酸锌[ZnCO3·2Zn(OH)2·H2O]固体,同时产生大量的气体。①产生大量气体的原因是。
②ZnCO3·2Zn(OH)2·H2O需洗涤,检验是否洗净的试剂是。
(4)、不同质量分数的Na2SO4溶液在不同温度下析出Na2SO4晶体的物种如图所示。欲从含20% Na2SO4及微量杂质的“沉锌后液”中直接析出无水Na2SO4 , “操作a”为。 28. 纯品氯化钠可用于食品、制药、氯碱工业等许多领域。实验室中利用下列装置进行从海水提取纯品氯化钠的实验。海水中主要离子及浓度见下表:
28. 纯品氯化钠可用于食品、制药、氯碱工业等许多领域。实验室中利用下列装置进行从海水提取纯品氯化钠的实验。海水中主要离子及浓度见下表:离子
Cl-
Na+
Mg2+
SO
Ca2+
K+
浓度(×10-3mol/L)
546
468
53.3
28.1
10.4
9.97
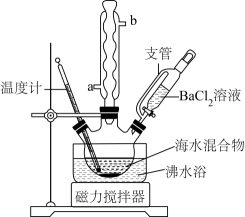
回答下列问题。
(1)、盛放BaCl2溶液的仪器名称为 , 球形冷凝管的出水管为(填“a”或“b”)。(2)、在95℃下对30mL海水混合物进行加热搅拌,同时缓慢滴加约2mL1mol·L-1BaCl2溶液,加热10min后取下,确定沉淀完全的实验方法是 , 能否用CaCl2代替BaCl2做沉淀剂(填“能”或“否”)。(3)、减压过滤(第一次)出泥沙与BaSO4 , 减压过滤的主要优点是(写一条)。(4)、加热滤液至沸,分别加入2mL3mol·L-1NaOH溶液和2mL饱和Na2CO3溶液,10min后减压过滤(第二次)。进行两次过滤而不是合并一次过滤的主要目的是:①防止泥沙溶于NaOH溶液;②防止发生沉淀转化:(写出离子方程式)。工业上不宜选择用Ba(OH)2同时除去Mg2+和SO , 可能的合理考虑是(双选)。A.Ba(OH)2比较贵
B.Ba(OH)2的溶解度比较低
C.Ba(OH)2属于二元强碱
D.SO恰好沉淀完全时,Mg2+不能完全沉淀
(5)、在滤液中滴加2mol·L-1盐酸,直至溶液pH在2~3之间,搅拌。有人认为调节溶液酸碱性呈中性即可,这样做的后果是。(6)、据下图分析,将调节pH后的溶液转移至蒸发皿中,小火加热,再经、 , 乙醇洗涤,干燥,得到纯品氯化钠。 29. 锂辉石矿[主要含有LiAlSi2O6 , 还有少量Fe2+、Mg2+]是主要锂源,现利用锂辉石矿制取LiBr,用于高级电池的电解质、医用镇静剂等。工艺流程如下:
29. 锂辉石矿[主要含有LiAlSi2O6 , 还有少量Fe2+、Mg2+]是主要锂源,现利用锂辉石矿制取LiBr,用于高级电池的电解质、医用镇静剂等。工艺流程如下: (1)、锂辉石中主要成分LiAlSi2O6改写为氧化物形式为。(2)、工业选择石灰石进行“中和”而不选择纯碱的主要考虑是 ;在“除镁除铁(调节pH≈11)”步骤中得到的滤渣中含铁成分是;写出“除铝”所发生的离子反应方程式。(3)、碳酸锂在水中的溶解度较小,其-lgKsp与温度t关系如下:
(1)、锂辉石中主要成分LiAlSi2O6改写为氧化物形式为。(2)、工业选择石灰石进行“中和”而不选择纯碱的主要考虑是 ;在“除镁除铁(调节pH≈11)”步骤中得到的滤渣中含铁成分是;写出“除铝”所发生的离子反应方程式。(3)、碳酸锂在水中的溶解度较小,其-lgKsp与温度t关系如下:t/℃
0
10
20
30
40
50
60
70
80
-1gKsp
1.44
1.53
1.63
1.71
1.80
1.90
2.00
2.21
2.43
由此可知碳酸锂在水中的溶解热效应ΔH0(填“>”或者“<”);加入纯碱试剂进行“沉锂”后,依次进行保温静置、(填写正确的顺序)。
①洗涤 ②趁热过滤 ③离心分离
(4)、在“合成”中,碳酸锂粉末分次少量加入到冰水中溶解,再加入尿素搅拌得到“料液”,料液中徐徐加入溴,控制pH=5.0,反应生成LiBr和两种无色无味气体,写出化学方程式。30. 纳米级PbO是大规模集成电路(IC)制作过程中的关键性基础材料。一种以方铅矿(含PbS及少量Fe2O3、MgO、SiO2等)为原料制备PbO的工艺流程如图:
已知:[PbCl4]2-(aq)PbCl2(s)+2Cl-(aq) ΔH<0
回答下列问题:
(1)、“酸浸氧化”过程中被氧化的元素是: , 该过程需要加热,其目的是。FeCl3与PbS发生反应生成[PbCl4]2-的离子方程式为。(2)、检验滤液1中存在Fe2+ , 可取样后滴加少量溶液(填化学式),观察到有蓝色沉淀析出。(3)、“降温”步骤中析出的晶体主要是(填化学式);滤液2中的金属阳离子有Na+、Fe3+、。(填离子符号)(4)、要实现PbSO4转化为PbCO3 , 的最小值为。(Ksp(PbCO3)=7.4×10-14、Ksp(PbSO4)=1.6×10-8)(保留两位有效数字)(5)、“煅烧”时,PbCO3发生反应的化学方程式为。31. 亚硝酸钠(NaNO2)是一种常 见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用下图所示装置制备NaNO2并进行纯度测定(夹持装置及A中加热装置已略去)。
已知:①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4溶液氧化成NO , MnO被还原为Mn2+。
③在酸性条件下NaNO2能把I-氧化为I2; S2O能把I2还原为I-。
(1)、装置A中盛装浓HNO3的仪器名称为 , 三领烧瓶中发生反应的化学方程式为。(2)、二氧化氮在装置B中与水反应转化为一氧化氮, 其中铜发生反应的离子方程式为。(3)、为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是____(填序号)。A、P2O5 B、碱石灰 C、无水CaCl2 D、氧化钙(4)、E装置的作用是 , 若撤去装置E中试管,则导管口可能看到的现象为。(5)、利用滴定的方法进行纯度测定。可供选择的试剂有: A.稀硫酸 B.稀硝酸 C.c1mol·L-1KI溶液 D.淀粉溶液 E. c2mol·L -1Na2S2O3溶液 F. c3 mol·L-1酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,须选用的试剂是 (填序号),滴定终点的现象为。
②利用NaNO2的氧化性来测定其纯度,须选用的试剂有 (填序号)。
32. 甘氨酸亚铁[(NH2CH2COO)2Fe]是一种肠溶性饲料添加剂。某化学实验小组利用FeCO3与甘氨酸反应制备(NH2CH2COO)2Fe,实验过程如下:步骤Ⅰ:将足量废铁屑和 1.0 mol·L-1硫酸充分反应后,再与1.0 mol·L-1NH4HCO3溶液混合,装置如图1,反应结束后过滤并洗涤得FeCO3
步骤Ⅱ :将FeCO3溶于甘氨酸和柠檬酸的混合溶液,生成(NH2CH2COO)2Fe.当溶液中Fe(Ⅱ)浓度为0.5 mol·L-1时,(NH2CH2COO)2Fe产率随溶液pH的变化如图2所示。
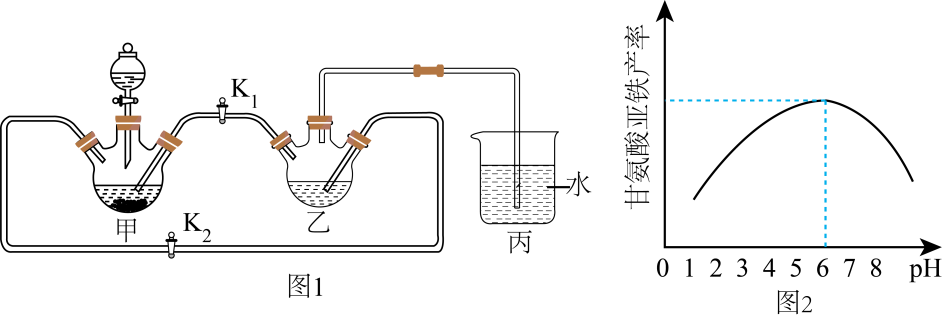
已知:①甘氨酸亚铁易溶于水,难溶于酒精;②甘氨酸具有两性,易溶于水;③柠檬酸易溶于水和酒精,具有强酸性和强还原性。
(1)、连接好装置,检查装置气密性的方法是。(2)、乙中发生反应的离子方程式为。实验中不能用1.0 mol·L-1NaHCO3溶液代替1.0 mol·L-1NH4HCO3溶液的可能原因是。(3)、柠檬酸的作用是。(4)、步骤Ⅱ具体操作:取0.10mol步骤I得到的沉淀置于反应容器内, , 使得Fe(Ⅱ)浓度约为0.5 mol·L-1 , , 用乙醇洗涤,干燥得到甘氨酸亚铁。(须使用的仪器和试剂:pH计、1.0mol·L-1甘氨酸溶液、柠檬酸、0.1 mol·L-1NaOH溶液、乙醇)33. 氯化镍(NiCl2·6H2O)常用于电镀、陶瓷等工业,某实验室以单质Ni为原料制取氯化镍的实验步骤如下:
已知:①Fe(OH)3完全沉淀pH为3.2;Ni(OH)2开始沉淀pH为7.2,完全沉淀pH为9.2。
②NiCl2易水解,从溶液中获取NiCl2·6H2O须控制pH<2。
(1)、在三颈烧瓶中(装置见如图)加入一定量Ni粉和水,通入空气,滴入稀硝酸和稀硫酸的混酸,至反应结束,过滤,制得NiSO4溶液。
①向A装置中通入空气的作用除搅拌外还有。
②若镍粉过量,判断反应完成的现象是。
(2)、将所得NiSO4溶液与NaHCO3溶液混合反应得到NiCO3·Ni(OH)2沉淀,过滤,洗涤。①沉淀反应的离子方程式为。
②检验NiCO3·Ni(OH)2沉淀已经洗涤完全的方法是。
(3)、所得NiCO3·Ni(OH)2固体中混有少量Fe(OH)3。请补充完整由NiCO3·Ni(OH)2固体制备NiCl2·6H2O的实验方案:向NiCO3·Ni(OH)2固体中加入盐酸,搅拌, 。 [NiCl2溶解度曲线如图所示。实验中须选用的仪器和试剂:pH计、盐酸、NiCO3] 34. 实验室利用下图装置制备溴苯和硫酸锰。已知反应原理为MnO2 + 2NaBr + 2H2SO4MnSO4+Na2SO4 +Br2↑+2H2O
34. 实验室利用下图装置制备溴苯和硫酸锰。已知反应原理为MnO2 + 2NaBr + 2H2SO4MnSO4+Na2SO4 +Br2↑+2H2O (1)、丁装置中冷凝水应由(填“m”或“n”)口进,丙装置圆底烧瓶中(填“需要”或“不需要”)加入沸石。(2)、按气流方向,装置接口的连接顺序为d →→c。(3)、装置甲中长颈漏斗的作用是 , 热水浴的目的是。(4)、利用装置乙中有淡黄色沉淀产生不能证明苯与溴发生了取代反应,请设计改进装置。(5)、反应结束后,装置丁中液体因溶解了Br2而呈棕褐色,请用离子方程式表示洗去Br2的方法 , 干燥之后分离出产物溴苯的方法为。35. 水合肼(N2H4·H2O)是一种用途广泛的化工原料,在空气中会与CO2反应产生烟雾。利用尿素制备N2H4·H2O的实验流程如下图所示:
(1)、丁装置中冷凝水应由(填“m”或“n”)口进,丙装置圆底烧瓶中(填“需要”或“不需要”)加入沸石。(2)、按气流方向,装置接口的连接顺序为d →→c。(3)、装置甲中长颈漏斗的作用是 , 热水浴的目的是。(4)、利用装置乙中有淡黄色沉淀产生不能证明苯与溴发生了取代反应,请设计改进装置。(5)、反应结束后,装置丁中液体因溶解了Br2而呈棕褐色,请用离子方程式表示洗去Br2的方法 , 干燥之后分离出产物溴苯的方法为。35. 水合肼(N2H4·H2O)是一种用途广泛的化工原料,在空气中会与CO2反应产生烟雾。利用尿素制备N2H4·H2O的实验流程如下图所示:
回答下列问题:
(1)、步骤I制备NaClO溶液的离子方程式为;该反应为放热反应,为避免副反应发生,需控制温度不高于40℃,可采取的措施是 (任答一条)。(2)、由步骤II和步骤III获得N2H4·H2O的装置如图1所示,反应原理为: CO(NH2)2+ 2NaOH+ NaClO= Na2CO3+ N2H4·H2O +NaCl
①仪器X的名称为 , 干燥管中盛装的试剂为。
②N2H4的电子式为。
③反应过程中,如果分液漏斗中溶液滴速过快,部分N2H4·H2O与NaClO反应产生大量氮气,该化学反应方程式为。
④蒸馏获得水合肼粗品后,剩余溶液进一步处理还可获得副产品NaCl和Na2CO3 , NaCl和Na2CO3的溶解度曲线如图2所示。获得NaCl粗品的操作是、 、洗涤、干燥。
 (3)、馏分中水合肼含量的测定方法:称取馏分0.2500g,加入适量NaHCO3固体,配成溶液,用0.1500 mol·L-1的标准I2溶液滴定。
(3)、馏分中水合肼含量的测定方法:称取馏分0.2500g,加入适量NaHCO3固体,配成溶液,用0.1500 mol·L-1的标准I2溶液滴定。①滴定时,碘的标准溶液盛放在 (填 “酸式”或“碱式”)滴定管中。
②实验测得消耗I2溶液的体积为18.00 mL,馏分中N2H4·H2O的质量分数为。 (已知:N2H4·H2O +2I2=N2 ↑+ 4HI+H2O)