高考二轮复习知识点:制备实验方案的设计3
试卷更新日期:2023-08-02 类型:二轮复习
一、选择题
-
1. 已知苯胺(液体)、苯甲酸(固体)微溶于水,苯胺盐酸盐易溶于水。实验室初步分离甲苯、苯胺、苯甲酸混合溶液的流程如下。下列说法正确的是( )
 A、苯胺既可与盐酸也可与溶液反应 B、由①、③分别获取相应粗品时可采用相同的操作方法 C、苯胺、甲苯、苯甲酸粗品依次由①、②、③获得 D、①、②、③均为两相混合体系2. 高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下,可能用到的数据见下表。
A、苯胺既可与盐酸也可与溶液反应 B、由①、③分别获取相应粗品时可采用相同的操作方法 C、苯胺、甲苯、苯甲酸粗品依次由①、②、③获得 D、①、②、③均为两相混合体系2. 高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下,可能用到的数据见下表。
开始沉淀pH
1.9
4.2
6.2
沉淀完全pH
3.2
6.7
8.2
下列说法错误的是( )
A、固体X主要成分是和S;金属M为Zn B、浸取时,增大压强可促进金属离子浸出 C、中和调pH的范围为3.2~4.2 D、还原时,增大溶液酸度有利于Cu的生成3. 尖晶石矿的主要成分为(含杂质)。已知:。该反应难以发生,但采用“加炭氯化法”可以制备和 , 同时还可得到副产物(沸点为 , 在升华):。下列说法不正确的是( )A、制备时要保持无水环境 B、输送气态产物的管道温度要保持在以上 C、氯化时加炭,既增大了反应的趋势,又为氯化提供了能量 D、为避免产生大量 , 反应过程中需保持炭过量4. 碘化钾为白色固体,可用作分析试剂、感光材料、制药和食品添加剂等,可通过碘酸钾与硫化氢反应制备。实验装置如图所示(夹持及加热装置已省略),下列说法错误的是 A、仪器a、b名称是恒压滴液漏斗,实验中应先关闭K,打开仪器b,制备碘酸钾 B、滴入30%氢氧化钾溶液后,乙装置中紫黑色固体溶解,棕黄色溶液逐渐变为无色 C、乙装置中稀硫酸主要作用是减小硫化氢溶解度,以利于其逸出在丙装置中被吸收 D、如果乙装置中最终生成4.8g黄色沉淀,则理论上可制得碘化钾的质量为8.3g5. 1-丁醇、溴化钠和的硫酸共热反应,经过回流、蒸馏、萃取分液制得1-溴丁烷粗产品,装置如图所示:
A、仪器a、b名称是恒压滴液漏斗,实验中应先关闭K,打开仪器b,制备碘酸钾 B、滴入30%氢氧化钾溶液后,乙装置中紫黑色固体溶解,棕黄色溶液逐渐变为无色 C、乙装置中稀硫酸主要作用是减小硫化氢溶解度,以利于其逸出在丙装置中被吸收 D、如果乙装置中最终生成4.8g黄色沉淀,则理论上可制得碘化钾的质量为8.3g5. 1-丁醇、溴化钠和的硫酸共热反应,经过回流、蒸馏、萃取分液制得1-溴丁烷粗产品,装置如图所示: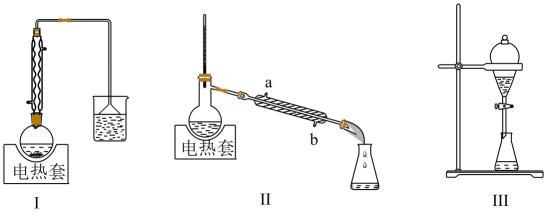
已知:CH3(CH2)3OH+NaBr+H2SO4CH3(CH2)3Br+NaHSO4+H2O,说法正确的是
A、装置I中回流的目的是为了减少物质的挥发,提高产率 B、装置II中a为进水口,b为出水口 C、用装置III萃取分液时,将分层的液体依次从下放出 D、蒸馏、过滤、分液、洗气四种分离物质的方法,均不可能发生化学变化6. 用绿矾()制备电池电极材料的流程如下:
下列说法正确的是
A、溶解过程中可抑制的水解 B、可用酸性溶液检验反应1中是否完全反应 C、洗涤沉淀时可用玻璃棒搅拌 D、反应2中氧化剂与还原剂的物质的量之比为1∶27. 锌焙砂(主要含ZnO、ZnFe2O4还含有少量FeO、CuO等)可用于湿法制锌,其流程如图所示。下列说法错误的是 A、“酸浸”中ZnFe2O4发生的反应为:ZnFe2O4+8H+=Zn2++2Fe3++4H2O B、可用ZnS除去溶液中的Cu2+的依据是Ksp(ZnS)>Ksp(CuS) C、为提高生产效率,“酸浸”“净化I”“净化II”的反应温度越高越好 D、“电解”的产物之一可用于替换“净化I”中的H2O2
A、“酸浸”中ZnFe2O4发生的反应为:ZnFe2O4+8H+=Zn2++2Fe3++4H2O B、可用ZnS除去溶液中的Cu2+的依据是Ksp(ZnS)>Ksp(CuS) C、为提高生产效率,“酸浸”“净化I”“净化II”的反应温度越高越好 D、“电解”的产物之一可用于替换“净化I”中的H2O2二、多选题
-
8. 氧钒(Ⅳ)碱式碳酸铵晶体{}难溶于水,可用于制备热敏材料。已知+4价钒的化合物易被氧化,实验室以和为原料制备氧钒(Ⅳ)碱式碳酸铵晶体的装置如图所示。下列说法正确的是
 A、按气流方向从左往右,各装置接口为 B、装置①的优点是节约原料且能随开随用、随关随停 C、实验时需先关闭K2 , 打开K1 , 待③中出现浑浊,再打开K2 , 关闭K1 D、装置②发生反应的离子方程式为9. 实验室中常以废铁屑为原料来制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O],流程如下:
A、按气流方向从左往右,各装置接口为 B、装置①的优点是节约原料且能随开随用、随关随停 C、实验时需先关闭K2 , 打开K1 , 待③中出现浑浊,再打开K2 , 关闭K1 D、装置②发生反应的离子方程式为9. 实验室中常以废铁屑为原料来制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O],流程如下:
下列说法错误的是( )
A、操作①可选用的仪器是烧杯、玻璃棒、酒精灯 B、操作②只需蒸发、冷却、结晶三步操作,即可把产品装入试剂瓶 C、硫酸亚铁铵易分解、易被氧化,需低温密闭保存 D、把水沿玻璃棒缓慢地倒入浓硫酸中,边加边搅拌即可得到稀硫酸10. 为完成下列各组实验,所选玻璃仪器和试剂均准确、完整的是(不考虑存放试剂的容器和夹持仪器)( )实验目的
玻璃仪器
试剂
A
精制含Ca2+、Mg2+、的食盐水
胶头滴管、烧杯、试管、漏斗、玻璃棒
粗盐水、稀盐酸、氯化钡溶液、氢氧化钠溶液、碳酸钠溶液
B
制备Fe(OH)3胶体
烧杯、酒精灯、胶头滴管
1mol/L氢氧化钠溶液、1mol/L氯化铁溶液
C
确定FeCl3是否完全变质
试管、酒精灯、胶头滴管
稀硫酸、高锰酸钾溶液
D
利用反萃取原理从碘的四氯化碳溶液中获取碘单质
漏斗、烧杯、玻璃棒、分液漏斗
稀硫酸、氢氧化钠溶液
A、A B、B C、C D、D11. 硫代硫酸钠晶体(Na2S2O3·5H2O)不溶于乙醇,可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分Na2S,含少量Na2SO4 )及纯碱等为原料制备Na2S2O3·5H2O的流程如下:
下列说法正确的是( )
A、Na2S2O3作脱氯剂时主要利用其还原性 B、“净化”时加入的试剂X可选用BaCl2溶液 C、“反应”过程中体系pH大小对产品产率无影响 D、提纯Na2S2O3·5H2O时,应先用水洗,再用乙醇洗涤12. 工业上以铬铁矿(主要成分为FeCr2O4 , 含有MgO、Al2O3等杂质)为主要原料制备K2Cr2O7的工艺流程如图(部分操作和条件略):
已知:
①100g水中溶解度数据如表所示。
物质
20℃
40℃
50℃
80℃
100℃
K2Cr2O7/g
12.0
29.0
37.0
73.0
102.0
Na2SO4/g
19.5
48.8
46.2
43.7
42.5
②Cr2O+H2O2CrO+2H+
下列说法错误的是( )
A、“高温煅烧”中Na2O2做氧化剂 B、“调pH”时应加过量硫酸以保证除杂效果 C、“沉铬”时应蒸发浓缩、冷却至40℃后过滤得K2Cr2O7晶体 D、“沉铬”后滤液可回到“水浸”过程循环利用三、非选择题
-
13. 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、(绿色)、(紫色)。
ii.浓碱条件下,可被OH-还原为。
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)

序号
物质a
C中实验现象
通入Cl2前
通入Cl2后
I
水
得到无色溶液
产生棕黑色沉淀,且放置后不发生变化
II
5%NaOH溶液
产生白色沉淀,在空气中缓慢变成棕黑色沉淀
棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
III
40%NaOH 溶液
产生白色沉淀,在空气中缓慢变成棕黑色沉淀
棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
(1)、B中试剂是。(2)、通入Cl2前,II、III中沉淀由白色变为黑色的化学方程式为。(3)、对比实验I、II通入Cl2后的实验现象,对于二价锰化合物还原性的认识是。(4)、根据资料ii,III中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将氧化为。
①化学方程式表示可能导致溶液碱性减弱的原因 , 但通过实验测定溶液的碱性变化很小。
②取III中放置后的1 mL悬浊液,加入4 mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为 , 溶液绿色缓慢加深,原因是MnO2被(填“化学式”)氧化,可证明III的悬浊液中氧化剂过量;
③取II中放置后的1 mL悬浊液,加入4 mL水,溶液紫色缓慢加深,发生的反应是。
④从反应速率的角度,分析实验III未得到绿色溶液的可能原因。
14. 白云石的主要化学成分为 , 还含有质量分数约为2.1%的Fe2O3和1.0%的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。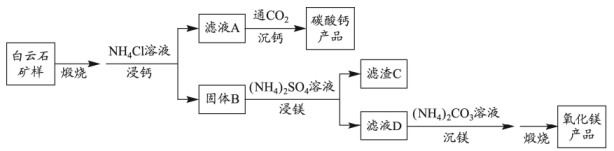
已知:
物质
(1)、白云石矿样煅烧完全分解的化学方程式为。(2)、用量对碳酸钙产品的影响如下表所示。氧化物()浸出率/%
产品中纯度/%
产品中Mg杂质含量/%
(以计)
计算值
实测值
2.1∶1
98.4
1.1
99.1
99.7
——
2.2∶1
98.8
1.5
98.7
99.5
0.06
2.4∶1
99.1
6.0
95.2
97.6
2.20
备注:ⅰ、浸出率=(浸出的质量/煅烧得到的质量)(M代表Ca或Mg)
ⅱ、纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中纯度。
①解释“浸钙”过程中主要浸出的原因是。
②沉钙反应的离子方程式为。
③“浸钙”过程不适宜选用的比例为。
④产品中纯度的实测值高于计算值的原因是。
(3)、“浸镁”过程中,取固体B与一定浓度的溶液混合,充分反应后的浸出率低于60%。加热蒸馏,的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是。(4)、滤渣C中含有的物质是。(5)、该流程中可循环利用的物质是。15. 胆矾()是一种重要化工原料,某研究小组以生锈的铜屑为原料[主要成分是Cu,含有少量的油污、CuO、、]制备胆矾。流程如下。
回答问题:
(1)、步骤①的目的是。(2)、步骤②中,若仅用浓溶解固体B,将生成(填化学式)污染环境。(3)、步骤②中,在存在下Cu溶于稀 , 反应的化学方程式为。(4)、经步骤④得到的胆矾,不能用水洗涤的主要原因是。(5)、实验证明,滤液D能将氧化为。ⅰ.甲同学认为不可能是步骤②中过量将氧化为 , 理由是。
ⅱ.乙同学通过实验证实,只能是将氧化为 , 写出乙同学的实验方案及结果(不要求写具体操作过程)。
16. 磷酸氢二铵[]常用于干粉灭火剂。某研究小组用磷酸吸收氢气制备 , 装置如图所示(夹持和搅拌装置已省略)。
回答问题:
(1)、实验室用和制备氨气的化学方程式为。(2)、现有浓质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的溶液,则需浓mL(保留一位小数)。(3)、装置中活塞的作用为。实验过程中,当出现现象时,应及时关闭 , 打开。(4)、当溶液pH为8.0~9.0时,停止通 , 即可制得溶液。若继续通入 , 当时,溶液中、和(填离子符号)浓度明显增加。(5)、若本实验不选用pH传感器,还可选用作指示剂,当溶液颜色由变为时,停止通。17. 实验室利用和亚硫酰氯()制备无水的装置如图所示(加热及夹持装置略)。已知沸点为 , 遇水极易反应生成两种酸性气体。回答下列问题: (1)、实验开始先通。一段时间后,先加热装置(填“a”或“b”)。装置b内发生反应的化学方程式为。装置c、d共同起到的作用是。(2)、现有含少量杂质的 , 为测定n值进行如下实验:
(1)、实验开始先通。一段时间后,先加热装置(填“a”或“b”)。装置b内发生反应的化学方程式为。装置c、d共同起到的作用是。(2)、现有含少量杂质的 , 为测定n值进行如下实验:实验Ⅰ:称取样品,用足量稀硫酸溶解后,用标准溶液滴定达终点时消耗(滴定过程中转化为 , 不反应)。
实验Ⅱ:另取样品,利用上述装置与足量反应后,固体质量为。
则;下列情况会导致n测量值偏小的是(填标号)。
A.样品中含少量杂质
B.样品与反应时失水不充分
C.实验Ⅰ中,称重后样品发生了潮解
D.滴定达终点时发现滴定管尖嘴内有气泡生成
(3)、用上述装置、根据反应制备。已知与分子结构相似,与互溶,但极易水解。选择合适仪器并组装蒸馏装置对、混合物进行蒸榴提纯(加热及夹持装置略),安装顺序为①⑨⑧(填序号),先馏出的物质为。 18. 工业上以氟磷灰石[ , 含等杂质]为原料生产磷酸和石膏,工艺流程如下:
18. 工业上以氟磷灰石[ , 含等杂质]为原料生产磷酸和石膏,工艺流程如下:
回答下列问题:
(1)、酸解时有产生。氢氟酸与反应生成二元强酸 , 离子方程式为。(2)、部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比加入脱氟,充分反应后,;再分批加入一定量的 , 首先转化为沉淀的离子是。(3)、浓度(以计)在一定范围时,石膏存在形式与温度、浓度(以计)的关系如图甲所示。酸解后,在所得、为45的混合体系中,石膏存在形式为(填化学式);洗涤时使用一定浓度的硫酸溶液而不使用水,原因是 , 回收利用洗涤液X的操作单元是;一定温度下,石膏存在形式与溶液中和的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是(填标号)。
A.、、 B.、、
C.、、 D.、、
19. 氨基钠()是重要的化学试剂,实验室可用下图装置(夹持、搅拌、尾气处理装置已省略)制备。
简要步骤如下:
Ⅰ.在瓶A中加入液氨和 , 通入氨气排尽密闭体系中空气,搅拌。
Ⅱ.加入钠粒,反应,得粒状沉积物。
Ⅲ.除去液氨,得产品。
已知:几乎不溶于液氨,易与水、氧气等反应。
请回答:
(1)、的作用是;装置B的作用是。(2)、步骤Ⅰ,为判断密闭体系中空气是否排尽,请设计方案。(3)、步骤Ⅱ,反应速率应保持在液氨微沸为宜。为防止速率偏大,可采取的措施有。(4)、下列说法不正确的是____。A、步骤Ⅰ中,搅拌的目的是使均匀地分散在液氨中 B、步骤Ⅱ中,为判断反应是否已完成,可在N处点火,如无火焰,则反应已完成 C、步骤Ⅲ中,为避免污染,应在通风橱内抽滤除去液氨,得到产品 D、产品应密封保存于充满干燥氮气的瓶中(5)、产品分析:假设是产品的唯一杂质,可采用如下方法测定产品纯度。从下列选项中选择最佳操作并排序。准确称取产品→→→→计算
a.准确加入过量的水
b.准确加入过量的标准溶液
c.准确加入过量的标准溶液
d.滴加甲基红指示剂(变色的范围4.4~6.2)
e.滴加石蕊指示剂(变色的范围4.5~8.3)
f.滴加酚酞指示剂(变色的范围8.2~10.0)
g.用标准溶液滴定
h.用标准溶液滴定
i.用标准溶液滴定
20. 为抑制新冠病毒传播,含氯消毒剂被广泛使用。常见的含氯消毒剂有次氯酸盐、ClO2、有机氯化物等。用NaCl电解法生成ClO2的工艺原理示意图如图,发生器内电解生成ClO2。
完成下列填空:
(1)、Cl原子的最外层电子层上具有种不同能量的电子;HClO的电子式是;(2)、Cl2性质活泼,易形成多种化合物。请说明NaCl的熔沸点比HCl高的原因:(3)、根据示意图,补充并配平ClO2发生器中发生的化学反应方程式:。_NaClO3+_HCl =_+_H2O
若反应中有2mol电子发生转移,则生成ClO2 mol。
(4)、某兴趣小组通过实验测定不同pH环境中,相同浓度NaClO溶液的细菌杀灭率(%),实验结果如下表。NaClO溶液浓度/ (mg·L-1)
不同pH下的细菌杀灭率/%
pH=4.0
pH=6.5
pH=9.0
250
98.90
77.90
53.90
①NaClO溶液呈碱性的原因是(用离子方程式表示)。
②调节NaClO溶液pH时不能选用盐酸的原因为。
③由表中数据可推断,该实验得到的结论是
④家用消毒常用84消毒液而不采用次氯酸,说明其理由。
21. 碳酸乙烯酯( EC)是一种性能优良的溶剂和精细化工中间体,是有机化工潜在的基础原料。EC的熔点为36℃,沸点为243℃,相对密度为1.4259g·cm-3。某课外小组拟用下图装置在100 ~120℃下以NY -2作催化剂,环氧乙烷( EO)和CO2为原料合成EC。
其反应原理为主反应:

副反应:

回答下列问题:
(1)、用固体NY-2配制500g 4.8%的NY-2水溶液未用到下列仪器中的(填仪器名称)。 (2)、控制装置D中反应温度的方法是(填“水浴加热”或“油浴加热”)。(3)、用装置A制备CO2时,应先打开K1和K2 , 然后。(4)、将装置C中的EO导入三颈烧瓶中的操作是 , 继续通入 CO2 , 用搅拌器搅拌,使反应物充分混合。(5)、CO2在水中的溶解度较小,但随着反应进行,从三颈烧瓶中逸出的CO2减少,其可能原因是。(6)、温度超过120℃后, EO的转化率增大,而EC的产率却减小,其可能原因是。(7)、计算结果表明,EO的转化率为91.5% ,EC的选择性为82% (EC的选择性=生成EC的物质的量/转化的EO的物质的量) ,若实验加入22 g EO,则得到g EC(结果保留两位有效数字)。22. 选择性催化还原法脱硝技术在工业上广泛应用,为实现废SCR催化剂(主要成分V2O5、WO3、TiO2等)再生利用,工艺流程如下。已知:钒酸钠和钨酸钠易溶于水,钛酸钠难溶于水。25℃时Ksp(CaWO4)>Ksp(H2WO4)。
(2)、控制装置D中反应温度的方法是(填“水浴加热”或“油浴加热”)。(3)、用装置A制备CO2时,应先打开K1和K2 , 然后。(4)、将装置C中的EO导入三颈烧瓶中的操作是 , 继续通入 CO2 , 用搅拌器搅拌,使反应物充分混合。(5)、CO2在水中的溶解度较小,但随着反应进行,从三颈烧瓶中逸出的CO2减少,其可能原因是。(6)、温度超过120℃后, EO的转化率增大,而EC的产率却减小,其可能原因是。(7)、计算结果表明,EO的转化率为91.5% ,EC的选择性为82% (EC的选择性=生成EC的物质的量/转化的EO的物质的量) ,若实验加入22 g EO,则得到g EC(结果保留两位有效数字)。22. 选择性催化还原法脱硝技术在工业上广泛应用,为实现废SCR催化剂(主要成分V2O5、WO3、TiO2等)再生利用,工艺流程如下。已知:钒酸钠和钨酸钠易溶于水,钛酸钠难溶于水。25℃时Ksp(CaWO4)>Ksp(H2WO4)。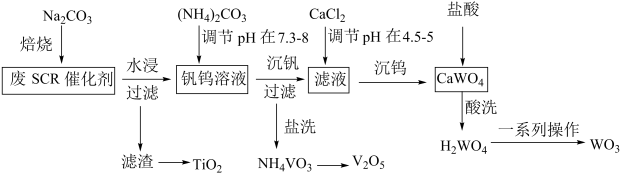 (1)、“焙烧”过程中V2O5与Na2CO3反应的化学方程式为。(2)、“水浸、过滤”后滤渣的化学式为。(3)、“盐洗”使用的试剂是。(4)、“沉钒”反应的离子方程式为。(5)、“沉钨”后用盐酸对CaWO4沉淀进行酸洗的目的是。(6)、H2WO4经“一系列操作”得到WO3 , “一系列操作”是。(7)、该工艺流程实现废SCR催化剂再生利用的产品有。23. 焦亚硫酸钠(Na2S2O5)常用于食品抗氧化剂。温度高于150℃易分解,已知:2NaHSO3=Na2S2O5+H2O,25℃时,H2SO3的Ka1=1.3×10-2 , Ka2=6.24×10-8。实验室制备Na2S2O5 , 装置如图所示。
(1)、“焙烧”过程中V2O5与Na2CO3反应的化学方程式为。(2)、“水浸、过滤”后滤渣的化学式为。(3)、“盐洗”使用的试剂是。(4)、“沉钒”反应的离子方程式为。(5)、“沉钨”后用盐酸对CaWO4沉淀进行酸洗的目的是。(6)、H2WO4经“一系列操作”得到WO3 , “一系列操作”是。(7)、该工艺流程实现废SCR催化剂再生利用的产品有。23. 焦亚硫酸钠(Na2S2O5)常用于食品抗氧化剂。温度高于150℃易分解,已知:2NaHSO3=Na2S2O5+H2O,25℃时,H2SO3的Ka1=1.3×10-2 , Ka2=6.24×10-8。实验室制备Na2S2O5 , 装置如图所示。
步骤一:除尽装置中空气,控制反应温度在40℃左右将SO2通入Na2CO3过饱和溶液中并不断搅拌。
步骤二:装置B中溶液pH约为4时,停止反应。在20℃静置结晶,经减压抽滤,洗涤、干燥得到Na2S2O5产品。
回答下列问题:
(1)、仪器a名称是。(2)、装置A中化学方程式为。(3)、装置B中反应生成NaHSO3的离子方程式为。(4)、装置C作用是。(5)、步骤二中洗涤操作先用饱和SO2水溶液洗涤,原因是。后用无水乙醇洗涤,目的是。(6)、Na2S2O5溶于水可生成NaHSO3 , 判断NaHSO3溶液是(填“酸性”“碱性”或“中性”),原因是。24. 铬是人体必需的微量元素,其在肌体的糖代谢和脂代谢中发挥着特殊作用,铬缺乏会造成葡萄糖耐量受损,可能伴随高血糖、尿糖等。而在工业中铬及其化合物在无机合成和有机合成中均有着重要作用。Ⅰ.工业上以铬铁矿为原料生产铬酸钠 , 实际操作是将铬铁矿和纯碱置于坩埚中,在空气中加热,得到。
Ⅱ.市售的为深绿色晶体,实验室中可用甲醇在酸性条件下还原制备(装置如图A所示):

①将一定量铬酸钠、甲醇与水的混合物加入三颈烧瓶中;②升温至120℃时,缓慢滴加足量浓盐酸,保持100℃反应3h;③冷却,用NaOH溶液调节pH为6.5~7.5,得到沉淀;④洗净沉淀后,加入过量盐酸溶解,通过结晶法得到晶体。
已知:易溶于水、乙醇,易水解。
Ⅲ.重铬酸钾俗称红矾,是一种重要的化工产品,可向溶液中加酸,使转化为 , 再向溶液中加入KCl,升高温度,经过一系列操作后可获得晶体。已知的溶解度随温度变化的曲线如图B所示。
回答下列问题:
(1)、是配位化合物,由于内界配体不同而有不同的颜色,呈深绿色的晶体为 , 该配合物的配体为、(填化学式)。(2)、在Ⅱ中制备晶体时,步骤④中“加入过量盐酸”的目的是。(3)、装置图A中,仪器c的名称为 , 仪器b的作用是。(4)、已知步骤Ⅱ中有产生,则三颈烧瓶中甲醇还原铬酸钠的离子方程式为。(5)、往溶液中加入KCl,升高温度能获得。获得晶体的一系列操作包括:趁热过滤、、过滤、洗涤、干燥。其中“洗涤”步骤选用的洗涤剂为丙酮,其原因是。25. 过氧乙酸(CH3COOOH)在卫生医疗、食品消毒及漂白剂领域等有广泛应用。实验室利用醋酸(CH3COOH)与双氧水(H2O2)共热,在难溶固体酸的催化下制备过氧乙酸(CH3COOOH)。同时利用乙酸丁酯与水形成共沸物(沸点90.7℃)及时分离出水,以提高产率。实验装置如图所示,请回答下列问题:
已知:i.过氧乙酸为无色液体,易溶于水;极不稳定,遇高热会引起爆炸;氧化性与高锰酸钾相当。
ii.相关物质性质
相关物质
CH3COOH
CH3COOOH
乙酸丁酯
沸点(℃)
118
105
126
实验步骤:
①向油水分离器中加入适量蒸馏水液面低于分水器支管口;
②仪器2中加入冰醋酸、固体酸催化剂和适量乙酸丁酯,仪器6中通冷却水,开通仪器1和8,缓慢关闭仪器7处放空阀,温度维持为55℃;
③待真空度达到反应要求时,打开仪器3的活塞,缓慢逐滴滴入浓度为35%的双氧水;
④当油水分离器中水层液面升高到支管口时,经过操作a后,打开活塞逐滴放出适量水……;
⑤待反应结束,冷却后放出油水分离器中下层水,将上层液体从油水分离器上口倒入仪器2,分离仪器2中的混合物,初步得到粗产品。
(1)、仪器2的名称是 , 仪器2中制备过氧乙酸(CH3COOOH)的化学反应方程式为;(2)、实验中反应温度控制在55℃,且缓慢逐滴滴入浓度为35%的双氧水,以上操作的原因是;(3)、步骤④的“操作a”指;定期从油水分离器放出水的原因是;(4)、待观察到(填现象)时,说明反应已经结束;(5)、反应结束,分离仪器2中的混合物初步得到粗产品的方法是;(6)、粗产品中过氧乙酸(CH3COOOH)含量的测定:取一定体积的样品VmL,分成2等份。其中一份用过量KI溶液与过氧化物作用,以0.10mol·L-1的硫代硫酸钠溶液滴定碘(I2+2=2I-+)消耗量为V1mL;另一份用0.02mol·L-1的酸性高锰酸钾溶液滴定,消耗量为V2mL。则样品中的过氧乙酸的浓度为mol·L-1。26. 乙二胺四乙酸(简称EDTA,结构简式为 , 白色粉末,微溶于冷水)是一种能与Ca2+、Mg2+等结合的螯合剂,可用其测定地下水的硬度。某实验室用氯乙酸(ClCH2COOH)、乙二胺(H2NCH2CH2NH2)、NaOH为原料制备EDTA步骤如下:
, 白色粉末,微溶于冷水)是一种能与Ca2+、Mg2+等结合的螯合剂,可用其测定地下水的硬度。某实验室用氯乙酸(ClCH2COOH)、乙二胺(H2NCH2CH2NH2)、NaOH为原料制备EDTA步骤如下:
步骤1:称取94.5g氯乙酸于1000mL的仪器A中(如图1),慢慢加入50%NaHCO3溶液,至不再产生无色气泡。
步骤2:加入15.6g乙二胺,摇匀后放置片刻,加入2.0mol·L-1NaOH溶液90mL,加水至总体积为600mL左右,温度计控温50℃加热2h。
步骤3:冷却液体后倒入烧杯中,加入活性炭脱色,搅拌、静置、过滤。用盐酸调节滤液至pH=1.2,有白色沉淀生成。
步骤4:将该沉淀置于图2装置的布氏漏斗中抽滤,干燥,制得EDTA。

回答下列问题:
(1)、“步骤1”中制备氯乙酸钠反应的化学方程式。(2)、制备EDTA所使用的装置(加热及夹持仪器省略)如图1所示,仪器A的名称为 , 仪器Q的进水口是(填“a”或“b”),滴液漏斗中具支管的作用为。(3)、4ClCH2COONa+H2NCH2CH2NH2⇌ +4HCl是“步骤2”中的发生反应,该步骤中使用NaOH的作用为 , 对A采用的加热方式(选填“酒精灯”“热水浴”或“油浴”)加热。配制该NaOH溶液需要称量NaOH固体的质量为g。 (4)、“步骤3”中混合液的pH可用精密pH试纸测量,简述其测定溶液pH的方法。使用活性炭脱色时一般加入活性炭的量为粗产品质量的1%~5%,加入量过多造成的影响是。(5)、与普通过滤比较,“步骤4”中用图2抽滤分离EDTA的优点是。27. 2-萘乙醚是香皂和化妆品等的香料添加剂。实验室用化学纯的2-萘酚、乙醇,分析纯的无水三氯化铁等反应制取。实验装置如图(夹持和加热装置略去),反应原理和有关数据如下:
+4HCl是“步骤2”中的发生反应,该步骤中使用NaOH的作用为 , 对A采用的加热方式(选填“酒精灯”“热水浴”或“油浴”)加热。配制该NaOH溶液需要称量NaOH固体的质量为g。 (4)、“步骤3”中混合液的pH可用精密pH试纸测量,简述其测定溶液pH的方法。使用活性炭脱色时一般加入活性炭的量为粗产品质量的1%~5%,加入量过多造成的影响是。(5)、与普通过滤比较,“步骤4”中用图2抽滤分离EDTA的优点是。27. 2-萘乙醚是香皂和化妆品等的香料添加剂。实验室用化学纯的2-萘酚、乙醇,分析纯的无水三氯化铁等反应制取。实验装置如图(夹持和加热装置略去),反应原理和有关数据如下:
物质
相对分子质量
密度/(g·cm-3)
熔点/℃
沸点/℃
溶解性
2-萘酚
144
1.22
121.6
285.5
不溶于冷水,溶于热水、乙醇等,能在NaOH溶液中溶解
乙醇
46
0.79
-114.1
78.5
与水任意比互溶
2-萘乙醚
172
1.06
35
282
不溶于水,溶于乙醇、乙醚等

实验步骤:
①在50mL三颈烧瓶中,加入3.6g2-蔡酚,1.2g氯化铁,6mL乙醇和沸石,微沸3h.稍微冷却,取下分水器和冷凝管,蒸出剩余的大部分乙醇。
②用冰水冷却三颈烧瓶析出固体,减压抽滤分离,冰水洗涤固体。再将漏斗上的固体转移至研钵中,加5mL冰水研磨后,减压抽滤,冰水洗涤。
回答下列问题:
(1)、上述制备2-萘乙醚的反应类型与下列反应相同的是____(填标号)。A、甲烷燃烧 B、乙烯水化法制乙醇 C、制备乙酸乙酯(2)、回流装置中分水器上方仪器的作用是;步骤①使用分水器不断分离除去水,本实验应先在分水器中加入适量苯,让蒸出的有机物能流回反应瓶,这些措施都是为了使用分水器进行回流制备,回流物应满足的条件是。(3)、步骤②中,进行两次“抽滤,洗涤”的作用是 , 洗涤固体用冰水的目的是。(4)、结合题给信息,猜测2-萘酚具有(填酸、碱或中)性,依据是。(5)、实验结束后测得从分水器中流出的水为0.35mL,则2-萘乙醚的产率为%(保留两位有效数字,忽略②步洗涤的损失)。28. 以盐湖锂精矿(主要成分为Li2CO3 , 还含有少量的CaCO3)和盐湖卤水(含一定浓度的LiCl 和MgCl2 )为原料均能制备高纯Li2CO3。回答下列问题:(1)、由锂精矿为原料制取碳酸锂的过程中,需要先“碳化溶解”使Li2CO3转为LiHCO3 , 实验装置如图所示。
已知: I.20℃时LiOH的溶解度为12.8g。
II.Li2CO3在不同温度下的溶解度:0℃ 1.54 g,20℃ 1.33 g,80℃ 0.85 g。
①装有盐酸的仪器的名称为。
②装置B中盛放的试剂为 , 其作用是。
③装置C中除了生成LiHCO3 , 还可能生成的杂质为(填化学式)。
④装置C中的反应需在常温下进行,温度越高锂精矿转化率越小的原因可能是。保持温度、反应时间、反应物和溶剂的量不变,实验中提高锂精矿转化率的操作有。
⑤热解过滤获得的Li2CO3表面有少量Li2C2O4 , 不进行洗涤也不会影响最终Li2CO3产品的纯度,其原因是。
(2)、设计由盐湖卤水制取高纯Li2CO3的实验方案:向浓缩后的盐湖卤水中。(实验中必须使用的试剂:NaOH溶液、Na2CO3溶液;已知:pH= 10时Mg(OH)2完全沉淀)29. “奥密克戎”对人体健康危害降低,但患者仍会出现高烧发热、身体疼痛等症状。对乙酰氨基酚( , M=151g·mol-1)具有解热镇痛的效果,其解热作用缓慢而持久,具有刺激性小、极少有过敏反应等优点。某科学小组在实验室进行对乙酰氨基酚的制备,物质转化流程如下(部分产物已略去):
, M=151g·mol-1)具有解热镇痛的效果,其解热作用缓慢而持久,具有刺激性小、极少有过敏反应等优点。某科学小组在实验室进行对乙酰氨基酚的制备,物质转化流程如下(部分产物已略去): (1)、步骤I中,亚硝酸因不稳定易分解产生体积比为1:1的NO和NO2 , 工业上常通入空气进行废物利用制备硝酸,请写出该反应的化学方程式。(2)、步骤II为对亚硝基苯酚的还原过程,其装置如图1所示。
(1)、步骤I中,亚硝酸因不稳定易分解产生体积比为1:1的NO和NO2 , 工业上常通入空气进行废物利用制备硝酸,请写出该反应的化学方程式。(2)、步骤II为对亚硝基苯酚的还原过程,其装置如图1所示。
该科学小组通过实验测定了不同温度下的对亚硝基苯酚还原产率,数据如下表:
温度/℃
25
45
55
65
产率/%
52.6
64.7
62.5
58.8
①通过实验,步骤II中最佳反应温度为℃;
②该反应放热易导致反应速率过快,要适当控制反应速率,结合装置最有效的操作是;
③步骤II中主要发生的反应为:
 , 实际操作中,硫化钠的实际用量比理论量高些,其目的是。(3)、步骤III中须用硫酸酸化步骤II反应后的混合溶液,以便析出对氨基苯酚。若加入硫酸过多、过快,可能导致发生副反应的离子方程式为。(4)、步骤IV为对氨基苯酚的乙酰化反应,实验装置如图2所示。其中,冷凝管的进水口是(填“a”或“b”);反应结束后,得到的晶体需用冰水洗涤,其目的是。
, 实际操作中,硫化钠的实际用量比理论量高些,其目的是。(3)、步骤III中须用硫酸酸化步骤II反应后的混合溶液,以便析出对氨基苯酚。若加入硫酸过多、过快,可能导致发生副反应的离子方程式为。(4)、步骤IV为对氨基苯酚的乙酰化反应,实验装置如图2所示。其中,冷凝管的进水口是(填“a”或“b”);反应结束后,得到的晶体需用冰水洗涤,其目的是。 (5)、该科学小组用0.2mol苯酚进行实验,该实验中对乙酰氨基酚总产率为55%,实际得到对乙酰氨基酚g。30. 四氧化三锰是电子工业生产锰锌铁氧体软磁材料的重要原料。以碳酸锰矿(主要成分为MnCO3 , 还含有少量FeCO3、Al2O3、MgO和SiO2等杂质)为原料制备高品位四氧化三锰的一种工艺流程如下:
(5)、该科学小组用0.2mol苯酚进行实验,该实验中对乙酰氨基酚总产率为55%,实际得到对乙酰氨基酚g。30. 四氧化三锰是电子工业生产锰锌铁氧体软磁材料的重要原料。以碳酸锰矿(主要成分为MnCO3 , 还含有少量FeCO3、Al2O3、MgO和SiO2等杂质)为原料制备高品位四氧化三锰的一种工艺流程如下:
已知:①0.01mol/L金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子
Al3+
Fe3+
Fe2+
Mg2+
Mn2+
开始沉淀
4.1
2.2
7.5
9.6
8.8
完全沉淀
5.4
3.2
9.5
/
/
②Ksp(MgF2)=7.4×10-1l;Ksp(MnF2)=5.6×10-3
回答下列问题:
(1)、提高“酸浸”效果的方法有、(任写两种)。(2)、“氧化1”步骤中,氧化剂a可选用MnO2 , 发生反应的离子方程式为 , 为了检验氧化是否完全可选用的试剂是(写化学式)。(3)、“沉铁铝”步骤中,调节pH的范围为。(4)、“沉镁”步骤中,沉淀转化反应的平衡常数K值等于。(5)、“沉锰”步骤中,杂质含量直接影响四氧化三锰的品位,实验测得温度对四氧化三锰中硫酸根含量的影响如图所示。实际生产中综合考虑选择50℃为宜,不选择更高温度的原因是。 (6)、“氧化2”步骤中发生反应的化学方程式为。31. 叠氮化钾能促进难以萌发的种子发育,在新作物育种中应用广泛,实验室制备流程如下。回答下列问题:(1)、I.制备:
(6)、“氧化2”步骤中发生反应的化学方程式为。31. 叠氮化钾能促进难以萌发的种子发育,在新作物育种中应用广泛,实验室制备流程如下。回答下列问题:(1)、I.制备: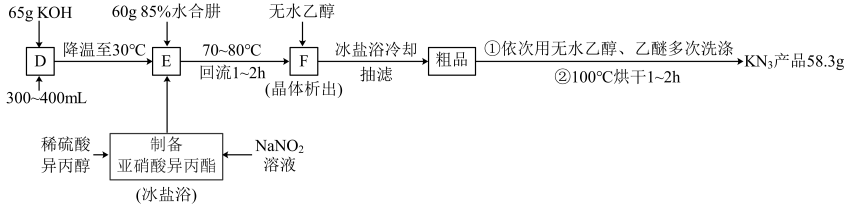
已知:
①制备亚硝酸异丙酯在烧杯中进行;
②制备的D、E和F阶段均在图甲装置中完成。
属于(填“离子化合物”或“共价化合物”)。
(2)、仪器A的名称为 , 仪器B的作用是。(3)、仪器A中发生反应时,与水合肼在碱性条件下,重新生成(异丙醇),该反应的化学方程式为。(4)、关于上述流程中各步骤的说法,错误的是____(填标号)。A、步骤D还需要的仪器是容量瓶和胶头滴管 B、制备亚硝酸异丙酯时用冰盐浴的目的是防止反应过于剧烈 C、步骤F加入无水乙醇的目的是促进的溶解(5)、II.纯度检测——“分光光度法”:与反应灵敏,生成红色配合物,在一定波长下测量红色溶液的吸光度,利用“—吸光度”曲线确定样品溶液中的。查阅文献可知:不同浓度的5.0mL标准溶液,分别加入5.0mL(足量)溶液,摇匀后测量吸光度,可绘制标准溶液的与吸光度的关系曲线如图乙所示。

纯度检测步骤如下:
①准确称取晶体,配制100mL标准液(与文献浓度一致)。
②准确称取0.36g样品,配制成100mL溶液,取5.0mL待测溶液,向其中加入V mL(足量)标准液,摇匀后测得吸光度为0.6。
配制100mL溶液需要用到下列操作:
a.打开容量瓶玻璃塞,加入适量水,塞紧塞子,倒立
b.将塞子反转180°,倒立
c.洗涤烧杯内壁和玻璃棒2~3次
d.冷却至室温
e.轻轻振荡容量瓶
f.称取0.36g试样置于烧杯中,加入适量水充分溶解
g.将溶液转移到容量瓶中
h.定容,摇匀
上述给出操作的正确顺序:a→→h(操作可重复)。
(6)、步骤②中取用标准液V =mL,样品的质量分数为。32. 实验室利用四氯化钛气相氧化法制备二氧化钛,装置如图(部分夹持装置已略去)。已知:的熔点为-24.1℃,沸点为136.4℃,在潮湿空气中易水解。回答下列问题: (1)、装置C中仪器a的名称为 , 实验装置从左到右的连接顺序为 , D装置的作用为 , C装置的加热方式为。
(1)、装置C中仪器a的名称为 , 实验装置从左到右的连接顺序为 , D装置的作用为 , C装置的加热方式为。a.温水浴 b.油浴(100-260℃) c.热水浴 d.沙浴温度(400-600℃)
(2)、写出B装置三颈烧瓶内发生反应的化学方程式。(3)、测定产品中钛含量的方法是:精确称取0.2000 g样品放入锥形瓶中,加入热的硫酸和硫酸铵的混合溶液,使其溶解。冷却,稀释,得到含的溶液。加入金属铝,将全部转化为 , 加入指示剂,用0.1000 mol·L溶液滴定至终点。重复操作2次,消耗0.1000 mol·L溶液的平均值为20.00 mL(已知:)。①配制标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的(填字母代号)。

②滴定时所用的指示剂为 , 产品中钛的质量分数为。
33. ZnS常用于制造白色颜料、发光粉和发光油漆等。以火法炼铜的废料(主要含ZnO、CuO,含少量PbO、As2O3、SiO2等)为原料制备粗锌和硫化锌的流程如下:
回答下列问题:
(1)、中含键mol。(2)、从“滤渣1”中提取粗铜的操作是将“滤渣1”、过滤、洗涤、干燥,得到粗铜。(3)、“沉铁”中的作用是(用离子方程式表示),可用绿色氧化剂(填化学式)替换。(4)、加入ZnO调节溶液pH,滤液中Fe元素的质量浓度、“滤渣2”中Zn元素的质量分数与pH关系如图所示。最适宜的pH为。 (5)、工业上常用电解法精炼锌,阴极材料是。(6)、“复分解沉锌”中,的平衡常数。[已知:常温下, , 的电离常数 , ]34. 20℃下,制作网红“天气瓶”流程如下,请根据下述制作流程,结合下列信息和所学知识,回答问题:
(5)、工业上常用电解法精炼锌,阴极材料是。(6)、“复分解沉锌”中,的平衡常数。[已知:常温下, , 的电离常数 , ]34. 20℃下,制作网红“天气瓶”流程如下,请根据下述制作流程,结合下列信息和所学知识,回答问题:
温度/℃
0
10
20
30
40
50
60
70
80
90
100
硝酸钾溶解度/g
13.3
20.9
31.6
45.8
63.9
85.5
110
138
169
202
246
氯化铵溶解度/g
29.4
33.2
37.2
41.4
45.8
50.4
55.3
60.2
65.6
71.2
77.3
樟脑(
 )是一种白色晶体,易溶于酒精、难溶于水。(1)、樟脑难溶于水,易溶于酒精的原因主要是。(2)、由硝酸钾、氯化铵制备得到“溶液b”的过程中需要用到的玻璃仪器有。得到“溶液c”时需控制温度50℃,可采取的方法是。(3)、实验中发现硝酸钾溶解速率很慢,请推测原因。(4)、温度改变,天气瓶内或清澈干净,或浑浊朦胧,或产生大片美丽的结晶。请通过计算说明0℃时出现的是樟脑晶体 , 推测晶体产生的原因。(5)、从晶体生长析出的角度分析,“天气瓶”制作中硝酸钾和氯化铵的作用是。35. 苯甲酸乙酯可用于配制香水香精和人造精油,也可用于食品中。某实验小组以苯甲酸和乙醇为原料,利用如图装置合成苯甲酸乙酯,步骤如下:
)是一种白色晶体,易溶于酒精、难溶于水。(1)、樟脑难溶于水,易溶于酒精的原因主要是。(2)、由硝酸钾、氯化铵制备得到“溶液b”的过程中需要用到的玻璃仪器有。得到“溶液c”时需控制温度50℃,可采取的方法是。(3)、实验中发现硝酸钾溶解速率很慢,请推测原因。(4)、温度改变,天气瓶内或清澈干净,或浑浊朦胧,或产生大片美丽的结晶。请通过计算说明0℃时出现的是樟脑晶体 , 推测晶体产生的原因。(5)、从晶体生长析出的角度分析,“天气瓶”制作中硝酸钾和氯化铵的作用是。35. 苯甲酸乙酯可用于配制香水香精和人造精油,也可用于食品中。某实验小组以苯甲酸和乙醇为原料,利用如图装置合成苯甲酸乙酯,步骤如下:
Ⅰ.反应回流:向圆底烧瓶中加入磁搅拌子,然后依次加入苯甲酸、95%乙醇、环己烷,搅拌均匀后再加入浓硫酸。按如图组装好仪器后,水浴加热回流1.5小时。实验过程中分水器中得到的液体会分层,需多次开启分水器活塞放出下层液体。
Ⅱ.产物蒸馏提纯:继续水浴加热,从圆底烧瓶中蒸出环己烷和剩余的乙醇,经分水器放出。将圆底烧瓶中残留物倒入盛有冷水的烧杯中,再经一系列除杂操作后,最后蒸馏收集210~213℃的馏分,得到产品。
可能用到的数据如下:
相对分子质量
密度
沸点/℃
水中溶解性
苯甲酸
122
1.266
249
微溶
乙醇
46
0.789
78
溶
苯甲酸乙酯
150
1.045
213
难溶
环己烷
84
0.779
80.8*
难溶
*环己烷、乙醇和水可形成共沸物,其沸点为62.1℃。
回答下列问题:
(1)、若用标记乙醇,则所得产品苯甲酸乙酯的结构简式为。(2)、如果步骤Ⅰ中加热一段时间后发现忘记加入磁搅拌子,应采取的正确操作为。(3)、步骤Ⅰ中“多次开启分水器活塞放出下层液体”的目的为。(4)、步骤Ⅱ中“一系列除杂操作”用到的试剂包括a.无水氯化钙b.碳酸钠c.食盐。按照操作先后顺序,应依次加入(填试剂的字母编号)。操作过程中,当观察到现象时,即可停止加入碳酸钠;加入食盐的目的为。(5)、步骤Ⅱ中蒸馏收集产物时,所需用到的玻璃仪器有酒精灯、蒸馏烧瓶、尾接管、接收瓶和(填仪器名称)。(6)、本实验的产率为%(保留两位有效数字)。(7)、下列仪器不能为产品结构分析提供有效信息的是(填选项字母)。A元素分析仪 B.质谱仪 C.红外光谱仪 D.核磁共振仪 E.X射线衍射仪