高考二轮复习知识点:性质实验方案的设计5
试卷更新日期:2023-08-02 类型:二轮复习
一、选择题
-
1. 下列由实验得出的结论正确的是( )
实验
结论
A
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明
生成的1,2﹣二溴乙烷无色、可溶于四氧化碳
B
乙醇和水都可与金属钠反应产生可燃性气体
乙醇分子中的氢与水分子中的氢具有相同的活性
C
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性小于碳酸的酸性
D
甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红
生成的一氯甲烷具有酸性
A、A B、B C、C D、D2. 下列有关实验原理或实验操作正确的是( ) A、实验室用图甲所示装置制取少量氨气 B、为使100mL0.5mol/L的NaNO3溶液物质的量浓度变为1mol/L,可将原溶液加热蒸发掉50mL水 C、利用图乙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化 D、利用图丙装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性3. 由下列实验及现象能推出相应结论的是( )
A、实验室用图甲所示装置制取少量氨气 B、为使100mL0.5mol/L的NaNO3溶液物质的量浓度变为1mol/L,可将原溶液加热蒸发掉50mL水 C、利用图乙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化 D、利用图丙装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性3. 由下列实验及现象能推出相应结论的是( )实验
现象
结论
A
某溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
原溶液中有Fe2+ , 没有Fe3+
B
将红热的木炭投入浓硫酸中产生的气体通入澄清的石灰水
石灰水变浑浊
木炭被氧化成CO2
C
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3显碱性
D
将0.1mol/L的NaCl溶液滴入硝酸银溶液至不再有沉淀产生,再滴加0.1mol/L KI溶液
先有白色沉淀生成,后变为黄色沉淀
Ksp(AgCl)>Ksp(AgI)
A、A B、B C、C D、D4. 氧气性质的微型实验装置如图所示,①是浓盐酸,⑥是高锰酸钾,②至⑤是滤纸条,依次滴有石蕊试液、淀粉KI试液、KBr溶液、含KSCN的FeCl2几种溶液,实验时滴几滴浓盐酸,下列说法错误的是( ) A、产生氯气的离子方程式为:16H++10Cl-+2MnO4-=2Mn2++5Cl2↑+8H2O B、⑤处变红色,发生反应为:2Fe2++Cl2=2Fe3++2Cl- , Fe3++3SCN-=Fe(SCN)3 C、②处先变红后褪色,能说明氯气溶于水后,溶液有酸性和强氧化性 D、③处变蓝,④处变橙色能说明氧化性:Cl2>Br2>I25. 氧化铅(PbO)是黄色固体。实验室用草酸在浓硫酸作用下分解制备CO,其原理为H2C2O4 CO↑+CO2↑+H2O。某学习小组设计实验探究CO还原氧化铅并检验氧化产物的装置如图所示(已知CO通入银氨溶液产生黑色银粒)。下列说法正确的是( )
A、产生氯气的离子方程式为:16H++10Cl-+2MnO4-=2Mn2++5Cl2↑+8H2O B、⑤处变红色,发生反应为:2Fe2++Cl2=2Fe3++2Cl- , Fe3++3SCN-=Fe(SCN)3 C、②处先变红后褪色,能说明氯气溶于水后,溶液有酸性和强氧化性 D、③处变蓝,④处变橙色能说明氧化性:Cl2>Br2>I25. 氧化铅(PbO)是黄色固体。实验室用草酸在浓硫酸作用下分解制备CO,其原理为H2C2O4 CO↑+CO2↑+H2O。某学习小组设计实验探究CO还原氧化铅并检验氧化产物的装置如图所示(已知CO通入银氨溶液产生黑色银粒)。下列说法正确的是( )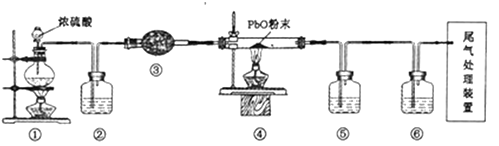 A、装置②③⑤⑥中的试剂依次为氢氧化钠溶液、碱石灰、银氨溶液、澄清石灰水 B、实验时,先点燃①处酒精灯,等装置⑥中有明显现象且有连续气泡后再点燃④处酒精灯 C、实验完毕时,先熄灭①处酒精灯,再熄灭④处酒精灯 D、尾气处理装置可选用盛NaOH溶液的洗气瓶6. 下列实验操作、实验现象和实验结论均正确的是( )
A、装置②③⑤⑥中的试剂依次为氢氧化钠溶液、碱石灰、银氨溶液、澄清石灰水 B、实验时,先点燃①处酒精灯,等装置⑥中有明显现象且有连续气泡后再点燃④处酒精灯 C、实验完毕时,先熄灭①处酒精灯,再熄灭④处酒精灯 D、尾气处理装置可选用盛NaOH溶液的洗气瓶6. 下列实验操作、实验现象和实验结论均正确的是( )选项
实验操作
实验现象
实验结论
A
向待测溶液中先滴加几滴氯水,然后滴加KSCN溶液
溶液变红
待测溶液中含有Fe2+
B
向KMnO4酸性溶液中滴加乙二酸
溶液褪色
乙二酸具有还原性
C
向AgNO3溶液中滴加过量氨水
得到澄清溶液
Ag+与NH3·H2O能大
量共存
D
向10mL0.1mol·L-1Na2S溶液中滴入2mL0.1 mol·L-1ZnSO4溶液,再加入0.1 mol·L-1CuSO4溶液
开始有白色沉淀生成;后有黑色沉淀生成
Ksp(CuS)<Ksp(ZnS)
A、A B、B C、C D、D7. 下列实验操作规范且能达到实验目的的是( )操作
目的
A
称取5.0gCuSO4·5H2O加入27.0g水中,搅拌溶解
配制10%CuSO4溶液
B
先用稀盐酸洗涤,再用水清洗
洗涤分解KMnO4制O2的试管
C
用玻璃棒蘸取溶液,点在干燥的pH试纸上,片刻后与标准比色卡比较并读数
测定0.05mol.L-1NaClO溶液的pH
D
将粗碘放入烧杯中,烧杯口放一盛满冷水的烧瓶,隔石棉网对烧杯加热,然后收集烧瓶外壁的固体
提纯混有NH4Cl的粗碘
A、A B、B C、C D、D8. 在一定条件下,向Al2O3和过量C粉的混合物中通入氯气,可制得易水解的AlCl3 , 实验装置如图所示。下列说法错误的是( )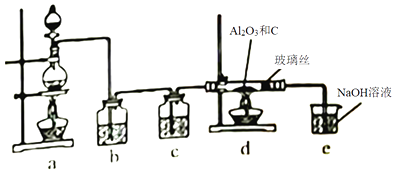 A、c中盛装的是浓硫酸 B、实验时应先点燃d处酒精灯,再点燃a处酒精灯 C、此反应中的尾气,除氯气外都可直接排放到大气中 D、该装置不完善,其中应改进的一项是在d、e之间添加一个干燥装置9. 某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2 , 排尽装置内的空气。
A、c中盛装的是浓硫酸 B、实验时应先点燃d处酒精灯,再点燃a处酒精灯 C、此反应中的尾气,除氯气外都可直接排放到大气中 D、该装置不完善,其中应改进的一项是在d、e之间添加一个干燥装置9. 某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2 , 排尽装置内的空气。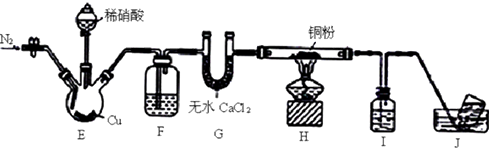
已知:在溶液中.FeSO4+NO [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法错误的是( )
A、装置F、I中的试剂依次为水、硫酸亚铁溶液 B、若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应 C、实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞 D、装置J收集的气体中一定不含NO10. 下列实验装置能完成相应实验目的的是( )A、 制取二氧化氮
B、
制取二氧化氮
B、 制取氨
C、
制取氨
C、 制取氯气
D、
制取氯气
D、 制取乙酸乙酯
11. 某研究小组为了探究NaClO溶液的性质,设计了下列实验,并记录实验现象。
制取乙酸乙酯
11. 某研究小组为了探究NaClO溶液的性质,设计了下列实验,并记录实验现象。实验装置
实验序号
滴管试剂
试管试剂
实验现象
①
0.2 mol/L
NaClO溶液
饱和Ag2SO4溶液
产生白色沉淀
②
CH3COOH溶液
光照管壁有无色气泡
③
0.2mol/LFeSO4酸性溶液和KSCN溶液
溶液变红
④
0.2mol/L的AlCl3溶液
产生白色沉淀
则以下判断错误的是( )
A、实验①:发生的反应为Ag++ClO-+H2O=AgCl↓+2OH- B、实验②:无色气体为O2 C、实验③:还原性强弱顺序Fe2+>Cl- D、实验④:ClO-与Al3+的水解相互促进二、非选择题
-
12. (三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图,回答下列问题:(1)、晒制蓝图时,用 作感光剂,以K3[Fe(CN6)]溶液为显色剂.其光解反应的化学方程式为 ,显色反应的化学方程式为.
(2)、某小组为探究三草酸合铁酸钾的热分解产物,按下面所示装置进行实验。
①通入氮气的目的是。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有、。
③为防止倒吸,停止实验时应进行的操作是。
④样品完全分解后,装置A中的残留物含有 和 ,检验 存在的方法是:。
(3)、测定三草酸合铁酸钾中铁的含量。①称量 样品于锥形瓶中,溶解后加稀 酸化,用 溶液滴定至终点。滴定终点的现象是。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用 溶液滴定至终点,消耗 溶液 ,该晶体中铁的质量分数的表达式为。
13. 某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+ , 发现和探究过程如下.向硝酸酸化的0.05mol•L﹣1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
(1)、检验产物①取少量黑色固体,洗涤后,(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有 .
(2)、针对“溶液呈黄色”,甲认为溶液中有Fe3+ , 乙认为铁粉过量时不可能有Fe3+ , 乙依据的原理是(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号
取样时间/min
现象
ⅰ
3
产生大量白色沉淀;溶液呈红色
ⅱ
30
产生白色沉淀;较3min时量小;溶液红色较3min时加深
ⅲ
120
产生白色沉淀;较30min时量小;溶液红色较3 0min时变浅
(资料:Ag+与SCN﹣生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2 , 由于(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3﹣具有氧化性,可产生Fe3+;
假设d:根据现象,判断溶液中存在Ag+ , 可产生Fe3+ .
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
实验Ⅱ:装置如图.其中甲溶液是 , 操作现象是 .
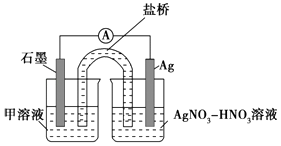 (3)、根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因: .14. (14分)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途.某化学兴趣小组对绿矾的一些性质进行探究.回答下列问题:(1)、在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化.再向试管中通入空气,溶液逐渐变红.由此可知:、 .(2)、
(3)、根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因: .14. (14分)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途.某化学兴趣小组对绿矾的一些性质进行探究.回答下列问题:(1)、在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化.再向试管中通入空气,溶液逐渐变红.由此可知:、 .(2)、为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g.将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g.按下图连接好装置进行实验.
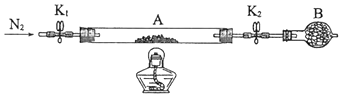
①仪器B的名称是 .
②将下列实验操作步骤正确排序(填标号);重复上述操作步骤,直至A恒重,记为m3 g.
a.点燃酒精灯,加热b.熄灭酒精灯c.关闭K1和K2
d.打开K1和K2 , 缓缓通入N2e.称量Af.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=(列式表示).若实验时按a、d次序操作,则使x(填“偏大”“偏小”或“无影响”).
(3)、为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2 , 缓缓通入N2 , 加热.实验后反应管中残留固体为红色粉末.
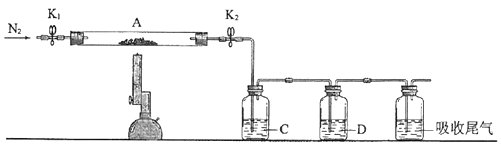
①C、D中的溶液依次为(填标号).C、D中有气泡冒出,并可观察到的现象分别为 .
a.品红b.NaOHc.BaCl2d.Ba(NO3)2e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式 .
15.以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性.
实验
试剂
现象
滴管
试管

0.2 mol•L﹣1 Na2SO3溶液
饱和Ag2SO4溶液
Ⅰ.产生白色沉淀
0.2 mol•L﹣1 CuSO4
Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀
0.1 mol•L﹣1 Al2(SO4)3溶液
Ⅲ.开始无明显变化,继续滴加产生白色沉淀
(1)、经检验,现象Ⅰ中的白色沉淀是Ag2SO3 . 用离子方程式解释现象Ⅰ: .(2)、经检验,现象Ⅱ的棕黄色沉淀中不含SO42﹣ , 含有Cu+、Cu2+和SO32﹣ . 已知:Cu+
 Cu+Cu2+ , Cu2+
Cu+Cu2+ , Cu2+ CuI↓(白色)+I2 .
CuI↓(白色)+I2 . ①用稀硫酸证实沉淀中含有Cu+的实验现象是 .
②通过下列实验证实,沉淀中含有Cu2+和SO32﹣ .

a.白色沉淀A是BaSO4 , 试剂1是 .
b.证实沉淀中含有Cu+和SO32﹣的理由是 .
(3)、已知:Al2(SO3)3在水溶液中不存在.经检验,现象Ⅲ的白色沉淀中无SO42﹣ , 该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色.
①推测沉淀中含有亚硫酸根和 .
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.被Al(OH)3所吸附;ii.存在于铝的碱式盐中.对假设ii设计了对比实验,证实了假设ii成立.
a.将对比实验方案补充完整.
步骤一:

步骤二:(按图形式呈现).
b.假设ii成立的实验证据是
(4)、根据实验,亚硫酸盐的性质有 . 盐溶液间反应的多样性与有关.16.(1)、Ⅰ.含CN-电镀废水的一种方法如图(CN-和CNO-中N的化合价均为-3价)
某学习小组依据上述方法,用如图实验装置进行该电镀废水处理的研究。

操作步骤:
ⅰ.先关闭装置甲的活塞,再将含CN-废水与过量NaClO溶液混合,取200mL混合液[其中c(CN-)相当于0.200mol·L-1]加入装置甲中。
ⅱ.待装置甲中充分反应后,打开活塞,使溶液全部流入装置乙中,关闭活塞。
ⅲ.测定干燥管Ⅰ增加的质量。
装置甲玻璃仪器名称为;装置乙中反应的离子方程式为。
(2)、装置丙中的试剂是 , 装置丁的作用是。(3)、假定上述实验中的气体都被充分吸收。若干燥管Ⅰ增重1.408g。则CN-被处理的百分率为。(4)、你认为用此装置进行实验,CN-实际被处理的百分率与(3)中比较会(填“偏高”、“偏低”、“无法确定”或“无影响”),简述你的理由。(5)、Ⅱ.防治空气污染,燃煤脱硫很重要。目前,科学家对Fe3+溶液脱硫技术的研究已取得新成果。某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:A中加入少量KMnO4溶液,溶液紫红色褪去。
方案②:B中加入KSCN溶液,溶液不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是(填方案编号)。
17. 硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分(C、D中溶液成分均过量)。 (1)、B装置的作用是。(2)、实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有气体产生,写出D中发生反应的离子方程式。若去掉C,是否能得出同样结论并解释其原因。(3)、A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3 , 而不含FeO,请完成表中内容。(试剂,仪器和用品自选)
(1)、B装置的作用是。(2)、实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有气体产生,写出D中发生反应的离子方程式。若去掉C,是否能得出同样结论并解释其原因。(3)、A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3 , 而不含FeO,请完成表中内容。(试剂,仪器和用品自选)实验步骤
预期现象
结论
取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解,平均分成2份;
固体残留物仅为Fe2O3
(4)、若E中收集到的气体只有N2 , 其物质的量为x mol,固体残留物Fe2O3的物质的量为y mol,D中沉淀物质的量为z mol,根据氧化还原反应的基本规律,x、y和z应满足的关系为。(5)、结合上述实验现象和相关数据的分析,完成硫酸亚铁铵[(NH4)2Fe(SO4)2]在500℃时隔绝空气加热完全分解的化学方程式。18. 为探究工业制硫酸接触室中的反应,设计如图所示装置,并测定此条件下二氧化硫的转化率。 (1)、①中浓硫酸的作用除了通过观察气泡,调节气体的流速外,还能、。(2)、③锥形瓶中盛放的是足量的氯化钡溶液,实验过程观察到锥形瓶中产生白色沉淀,反应的化学方程式为;锥形瓶浸入冰水浴的原因是。(3)、⑤中品红颜色没有发生改变,说明。(4)、若通入SO2的体积为V L(已折算为标准状况下的体积),要测定该条件下二氧化硫的转化率,实验时还需要测定的数据是m g,则m可以是 , 此条件下二氧化硫的转化率是(列式表示)。(5)、反应结束后还需通入N2的原因是。19. 实验室用粗锌与稀硫酸反应制取氢气,利用氢气还原氧化铜来测定铜的相对原子质量。实验装置如下:
(1)、①中浓硫酸的作用除了通过观察气泡,调节气体的流速外,还能、。(2)、③锥形瓶中盛放的是足量的氯化钡溶液,实验过程观察到锥形瓶中产生白色沉淀,反应的化学方程式为;锥形瓶浸入冰水浴的原因是。(3)、⑤中品红颜色没有发生改变,说明。(4)、若通入SO2的体积为V L(已折算为标准状况下的体积),要测定该条件下二氧化硫的转化率,实验时还需要测定的数据是m g,则m可以是 , 此条件下二氧化硫的转化率是(列式表示)。(5)、反应结束后还需通入N2的原因是。19. 实验室用粗锌与稀硫酸反应制取氢气,利用氢气还原氧化铜来测定铜的相对原子质量。实验装置如下: (1)、在启普发生器中纯锌与稀硫酸反应过于缓慢,可采取的加快速率的措施是① , ②。(2)、用纯度不高的锌(粗锌)制取氢气,反应速率快,但制得的氢气因含H2S等还原性杂质而有难闻的气味,CuSO4洗气瓶中观察到的现象是有黑色沉淀生成,请写出该洗气瓶中发生复分解反应的化学方程式 , 是否可以将CuSO4溶液换成浓硫酸(答“是”或“否”);理由是。请简述用CuSO4溶液配制检验醛基的新制氢氧化铜的方法。(3)、装置中氯化钙的作用是。有同学发现粗锌与稀硫酸反应一段时间后,锌粒表面变黑,于是收集了少量该黑色固体,验证黑色固体含铁元素的化学方法。(4)、实验中得到的数据有:小瓷皿的质量mg,小瓷皿加样品的质量n g,反应后小瓷皿加固体的质量w g,已知氧的相对原子质量为16,则铜的相对原子质量是 (用含m、n、w的代数式表示)。20. 硫酸镍晶体(NiSO4•7H2O)可用于电镀工业,可用含镍废催化剂为原料来制备。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al、Fe的单质及其他不溶杂质(不溶于酸碱)。某小组通过查阅资料,设计了如下图所示的制备流程:
(1)、在启普发生器中纯锌与稀硫酸反应过于缓慢,可采取的加快速率的措施是① , ②。(2)、用纯度不高的锌(粗锌)制取氢气,反应速率快,但制得的氢气因含H2S等还原性杂质而有难闻的气味,CuSO4洗气瓶中观察到的现象是有黑色沉淀生成,请写出该洗气瓶中发生复分解反应的化学方程式 , 是否可以将CuSO4溶液换成浓硫酸(答“是”或“否”);理由是。请简述用CuSO4溶液配制检验醛基的新制氢氧化铜的方法。(3)、装置中氯化钙的作用是。有同学发现粗锌与稀硫酸反应一段时间后,锌粒表面变黑,于是收集了少量该黑色固体,验证黑色固体含铁元素的化学方法。(4)、实验中得到的数据有:小瓷皿的质量mg,小瓷皿加样品的质量n g,反应后小瓷皿加固体的质量w g,已知氧的相对原子质量为16,则铜的相对原子质量是 (用含m、n、w的代数式表示)。20. 硫酸镍晶体(NiSO4•7H2O)可用于电镀工业,可用含镍废催化剂为原料来制备。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al、Fe的单质及其他不溶杂质(不溶于酸碱)。某小组通过查阅资料,设计了如下图所示的制备流程: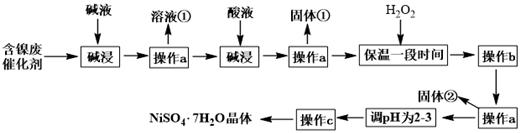
已知:Ksp[Fe(OH)3]=4.0×10-38 ,Ksp[Ni(OH)2]=1.2×10-15
(1)、“碱浸”过程中发生反应的离子方程式是。(2)、操作a所用到的玻璃仪器有烧杯、、;操作c的名称为、、过滤、洗涤。(3)、固体①是;加H2O2的目的是(用离子方程式表示)。(4)、调pH为2-3时所加的酸是。(5)、操作b为调节溶液的pH,若经过操作b后溶液中c(Ni2+)=2mol·L-1 , 当铁离子恰好完全沉淀溶液中c(Fe3+)=1.0×10-5mol·L-1时,溶液中是否有Ni(OH)2沉淀生成?(填“是”或“否”)。(6)、NiSO4•7H2O可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在放电过程中总反应的化学方程式是NiOOH+MH=Ni(OH)2+M,则NiMH电池充电过程中,阳极的电极反应式为。21. 较活泼金属与硝酸反应,产物复杂。如一定浓度的硝酸与镁反应,可同时得到NO、NO2、N2三种气体。某同学欲用下列仪器组装装置来直接验证有NO、NO2生成并制取氮化镁。(假设实验中每步转化均是完全的)
已知:①NO2沸点是21.1℃、熔点是-11℃;NO的沸点是-151℃、熔点是-164℃;②氮化镁遇水会发生水解。
回答下列问题:
(1)、为达到上述实验目的,所选用的仪器的正确连接方式是() (填序号)。a. A→ D → C → F → B → F →E
b. A→ C → D → F → B → F →E
c. A→ F → C → D → F → B →E
d. A→ F → D → C → F → B →E
(2)、确定还原产物中有NO2的现象是 , 实验中两次使用装置F,第二次使用装置F的作用是。(3)、实验前需先打开开关K,向装置内通CO2气体,其目的是 , 当时停止通入CO2。(4)、实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式。(5)、在A中反应开始时,某同学马上点燃B处的酒精灯,实验结束后通过测定发现B处的产品纯度不高,原因是(用化学方程式回答)。(6)、验证B处有氮化镁生成的方法是。22. 一种从含铝锂钴废料[铝箔、CoO和Co2O3(只溶于酸,不溶于碱)及LiCoO2]中回收氧化钴的工艺流程如下:
回答下列问题:
(1)、步骤I“碱溶”时,为提高铝的去除率,除升高温度和不断搅拌外,还可采取的措施是(列举1点),“碱溶”时发生主要反应的化学方程式为;步骤II“过滤、洗涤”过程中滤渣还会有少量的Al(OH)3 , 是因为(填离子方程式)。(2)、步骤III“酸溶”时,Co2O3 转化为CoSO4 的离子方程式为。(3)、步骤V“除铝和锂”时,调节pH的适用范围是(已知该条件下,Al3+开始沉淀时的pH为4.1,沉淀完全时的pH为4.7.Co2+开始沉淀时的pH为6.9。沉淀完全时的pH为9.4);步骤VI所得滤渣的成分为。(4)、煅烧CoC2O4时发生氧化还原反应,则CoC2O4分解的化学方程式是;若仅从沉淀转化角度考虑,能否利用反应CoCO3+ C2O42-= CoC2O4 + CO32- 将CoCO3 转化为CoC2O4? (填“能”或“不能”),说明理由:[已知Ksp(CoCO3) =1.4×10-13 , Ksp(CoC2O4)=6.3×10-8]23. 过氧化钙(CaO2)在室温下稳定,加热至350℃左右,迅速分解。微溶于水,不溶于乙醇,可溶于稀酸生成过氧化氢。实验室用如下方法制备CaO2并测定其纯度。过氧化钙的制备实验装置和步骤如下:将盛有H2O2溶液和氨水混合液的三颈烧瓶置于冷水浴中,在搅拌下滴入CaCl2溶液,析出固体CaO2·8H2O。对所得固体过滤,用5mL无水乙醇洗涤2 3次,转移至坩埚于烘箱内105℃下脱水干燥,冷却后称重,得产品CaO2。回答下列问题:
(1)、仪器A的名称为:;恒压分液漏斗的导管a的作用为。(2)、三颈烧瓶中发生反应的化学方程式为;将三颈烧瓶置于冷水浴中,其主要目的为。(3)、用无水乙醇代替水洗涤的目的是:;判断脱水干燥是否完全,需要至少冷却后称重次。(4)、过氧化钙纯度的测定,装置如下图所示: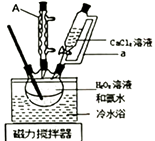
检查装置气密性后,精确称取m g过氧化钙样品加入试管中,调整甲管内液面读数在0-1mL之间,并与乙管的液面相平,记下甲管内液面的初读数V1mL。加热,过氧化钙逐渐分解放出氧气,完全分解,停止加热冷却至室温后,使甲乙两管的液面相平,记下甲管内液面的终读数V2mL,设在此温度和压强下气体摩尔体积为VmL·mol-1 , 则样品中CaO2的质量分数为%。
(5)、过氧化钙用于长途运输鱼苗,可能的原因是。24. 磷酸铁锂是锂电池的电极材料,其成分为LiFePO4、 碳粉和铝箔。对该材料进行资源回收研究,设计实验流程如下: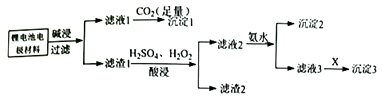
已知:溶解度表:
Li2CO3
LiOH
LiI
0℃
l.54g
12.7g
151g
100℃
0.72g
13.6g
179g
回答下列问题:
(1)、由滤液1到沉淀1反应的离子方程式为。(2)、向滤渣1加入H2SO4、H2O2混合溶液时,磷酸铁锂溶解,反应的离子方程式为。(3)、对滤渣1酸浸操作,下列实验条件控制正确的是(填字母代号) 。a.加入H2O2溶液适当过量,有利于滤渣1的转化
b.适当提高硫酸溶液浓度并搅拌
c.用HNO3代替所加H2SO4和H2O2 , 节约药品更环保
(4)、滤液2加氨水时,调节pH=3,此时溶液中c(Fe3+)= (常温下,Ksp[Fe(OH)3]=4.0×10-38)。(5)、向滤液3中加入物质X,根据溶解度表判断X可能是: (填Na2CO3、NaOH或Nal)。(6)、对沉淀3进行洗涤操作,应选择(选填“冷水”或“热水”)进行洗涤。(7)、磷酸铁锂电池的工作原理为:LiFePO4+ 6C Li1-xFePO4 +LixC6 , 电池中的电解质可传导Li+。放电时正极的电极反应式为。25. 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:
已知:
①硫酸浸取液中的金属离子主要是Cr3+ , 其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子
Fe3+
Mg2+
Al3+
Cr3+
沉淀完全时的pH
3.7
11.1
5.4(>8溶解)
9(>9溶解)
(1)、酸浸时,为了提高浸取率可采取的措施有(写出两条)。(2)、过滤操作时所用玻璃仪器除烧杯外,还需要。(3)、H2O2的作用是将滤液I中的Cr3+转化为C2O72- , 该反应的离子方程式为:。(4)、加入NaOH溶液调节溶液pH=8,既可以使溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O72-转化为(填微粒的化学式),当溶液的pH>8时,沉淀的主要成分为 (填化学式)。(5)、钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+ , 则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有 , 交换后溶液中浓度明显增大的离子为。26. 某小组研究NaClO溶液与KI溶液的反应,实验记录如下:实验编号
实验操作
实验现象
Ⅰ

ⅰ.溶液变为浅黄色
ⅱ.溶液变蓝
Ⅱ

ⅰ.溶液保持无色
ⅱ.溶液不变蓝,溶液的pH=10
【资料】:碘的化合物主要以I−和IO3−的形式存在。酸性条件下IO3−不能氧化Cl− , 可以氧化I−。ClO−在pH<4并加热的条件下极不稳定。
(1)、0.5 mol·L−1 NaClO溶液的pH=11,用离子方程式表示其原因:。(2)、实验Ⅰ中溶液变为浅黄色的离子方程式是。(3)、对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是。
② 进一步提出假设b:NaClO可将I2氧化为IO3−。进行实验证实了假设b成立,装置如下图,其中甲溶液是 , 实验现象是。
 (4)、检验实验Ⅱ所得溶液中的IO3−:
(4)、检验实验Ⅱ所得溶液中的IO3−:取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3−。
① 产生的黄绿色气体是。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3− , 理由是。欲证明实验Ⅱ所得溶液中存在IO3− , 改进的实验方案是。
③ 实验Ⅱ中反应的离子方程式是。
27. 溴化锂是一种高效的水汽吸收剂,其一种绿色工业合成工艺如下(部分操作和条件已略去)。
已知:碳酸锂微溶于水,水溶液显碱性。
(1)、Br2的电子式是。(2)、合成过程中发生的反应如下,请写出ii反应的化学方程式并将iii补充完整。ⅰ. Br2 +H2O HBr +HBrO;
ⅱ.;
ⅲ. 3LiBrO + CO(NH2)2(尿素)=3LiBr+。
(3)、LiBrO3是生产过程中的副产物。①用化学方程式表示生成改副产物的原因:。
②为了提高原料的利用率,减少副产物的生成,必须调控体系的pH在3~5之间,通过合理的加料方法来实现:将碳酸锂粉末溶解于冷的溴水中至饱和,并一次性加入尿素,然后再 , 直到尿素完全转化。
③常用硫脲除去LiBrO3 , 反应的化学方程式是4LiBrO3 +3CS(NH2)2(硫脲) +3H2O=4LiBr +3CO(NH2)2 +3H2SO4 , 选用硫脲除杂的优点是;缺点是引入新杂质且溶液酸性增强,为解决该问题需要加入的试剂是。
28. 某化学兴趣小组做以下属于对SO2的性质进行研究。请回答下列问题: (1)、装置B的作用是。(2)、装置C的目的是检验SO2的性。装置D中NaOH全部转化为NaHSO3的标志是。(3)、请设计简单实验证明:室温下,NaHSO3溶液中HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小关系。(4)、向装置D所得NaHSO3溶液中加入NaClO溶液时,反应有下列三种可能的情况:
(1)、装置B的作用是。(2)、装置C的目的是检验SO2的性。装置D中NaOH全部转化为NaHSO3的标志是。(3)、请设计简单实验证明:室温下,NaHSO3溶液中HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小关系。(4)、向装置D所得NaHSO3溶液中加入NaClO溶液时,反应有下列三种可能的情况:Ⅰ.HSO3-与ClO-恰好反应 Ⅱ. NaClO不足 Ⅲ. NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
实验序号
实验操作
现象
结论
①
加入几小块CaCO3固体
有气泡产生
Ⅰ或Ⅱ
②
滴加少量淀粉KI溶液,振荡
Ⅲ
③
滴加少量溴水,振荡
Ⅱ
④
滴加少量酸性KMnO4溶液,振荡
溶液呈紫色
(5)、测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
(已知:滴定时反应的化学方程式为SO2+I2 +2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为g·L-1。
②在上述实验过程中,若有部分HI 被空气氧化,则测得结果(填“偏高”、偏低”或“不变”)。
29. I.某学习小组设计如下图装置制取SO2 , 研究其性质,并进一步探究不同浓度硫酸的氧化性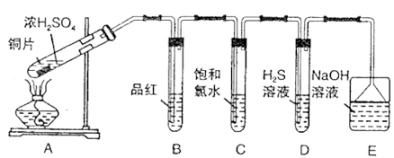
请回答下列问题:
(1)、B、C、D分别用于检验SO2的性质,写出C中反应的离子方程式。(2)、实验中观察到D中有浑浊出现,有同学提出此现象不能证明SO2具有氧化性。请简述理由:。
(3)、E装置的作用为。(4)、Ⅱ.某学习小组设计并完成如下实验:称取一定量的还原铁粉放入一定体积的浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。经检验,气体Y中含有SO2、H2。)溶液X中一定大量含有的金属阳离子是 , 简述如何检验溶液X中该离子。
(5)、为了测定气体Y中SO2的含量,将2.24L(标准状况)气体Y通入到200.00mL 0.2000mol/L酸性高锰酸钾溶液中,充分反应后,取出20.00mL溶液转入锥形瓶中进行滴定,消耗浓度为0.0500mol/L的KHC2O4标准液20.00mL。①室温下,0.05mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4)。滴定操作时,标准液应装在
(填仪器名称)中;滴定终点的现象为。
②气体Y中SO2的物质的量分数为。
30. 实验室用下图所示装置模拟石灰石燃煤烟气脱硫实验: (1)、实验中为提高石灰石浆液脱硫效率采取的措施是 , 写出通入SO2和空气发生反应生成石膏(CaSO4·2H2O)的化学方程式。(2)、将脱硫后的气体通入KMnO4溶液,可粗略判断烟气脱硫效率的方法是。(3)、研究发现石灰石浆液的脱硫效率受pH和温度的影响。烟气流速一定时,脱硫效率与石灰石浆液pH的关系如图所示,在为5.7时脱硫效果最佳,石灰石浆液5.7<pH<6.0时,烟气脱硫效果降低的可能原因是 , 烟气通入石灰石浆液时的温度不宜过高,是因为。
(1)、实验中为提高石灰石浆液脱硫效率采取的措施是 , 写出通入SO2和空气发生反应生成石膏(CaSO4·2H2O)的化学方程式。(2)、将脱硫后的气体通入KMnO4溶液,可粗略判断烟气脱硫效率的方法是。(3)、研究发现石灰石浆液的脱硫效率受pH和温度的影响。烟气流速一定时,脱硫效率与石灰石浆液pH的关系如图所示,在为5.7时脱硫效果最佳,石灰石浆液5.7<pH<6.0时,烟气脱硫效果降低的可能原因是 , 烟气通入石灰石浆液时的温度不宜过高,是因为。 (4)、石灰石烟气脱硫得到的物质中的主要成分是CaSO4和CaSO3 , 实验人员欲测定石灰石浆液脱硫后的物质中CaSO3的含量,以决定燃煤烟气脱硫时通入空气的量。请补充完整测定CaSO3含量的实验方案:取一定量石灰石烟气脱硫后的物质,。[浆液中CaSO3能充分与硫酸反应。实验中须使用的药品:75%的硫酸、标准浓度的(NH4)2Fe(SO4)2溶液,标准浓度的酸性KMnO4溶液]31. 在有机化学中,硫酰氯(SO2Cl2)常用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =−97.3 kJ·mol−1 , 实验装置如图所示(部分夹持装置未画出)。
(4)、石灰石烟气脱硫得到的物质中的主要成分是CaSO4和CaSO3 , 实验人员欲测定石灰石浆液脱硫后的物质中CaSO3的含量,以决定燃煤烟气脱硫时通入空气的量。请补充完整测定CaSO3含量的实验方案:取一定量石灰石烟气脱硫后的物质,。[浆液中CaSO3能充分与硫酸反应。实验中须使用的药品:75%的硫酸、标准浓度的(NH4)2Fe(SO4)2溶液,标准浓度的酸性KMnO4溶液]31. 在有机化学中,硫酰氯(SO2Cl2)常用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =−97.3 kJ·mol−1 , 实验装置如图所示(部分夹持装置未画出)。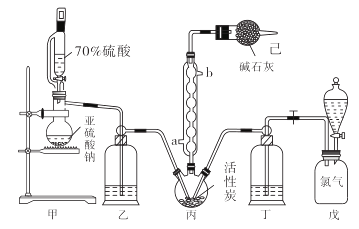
已知:硫酰氯通常条件下为无色液体,熔点−54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)、装置丙中作为反应容器的仪器的名称为 , 装置丙中球形冷凝管的作用是;如何控制两种反应物体积相等:。(2)、装置戊上方分液漏斗中最好选用下列试剂:_________________(选填字母)A、蒸馏水 B、饱和食盐水 C、浓氢氧化钠溶液 D、6.0 mol·L-1盐酸(3)、若缺少装置己,硫酰氯(SO2Cl2)会和空气中的水反应而变质,其化学方程式是。(4)、氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H SO2Cl2 + H2SO4 , 分离两种产物的方法是_____________(选填字母)。A、重结晶 B、过滤 C、蒸馏 D、萃取(5)、长期储存的硫酰氯会发黄,可能的原因是(用化学方程式和必要的文字加以解释)。(6)、若反应中消耗的氯气体积为896 mL(标准状况下),最后经过分离提纯得到4.05 g纯净的硫酰氯,则硫酰氯的产率为。(7)、请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):。32. 氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:实验Ⅰ:制取NaClO2晶体按下图装置进行制取。


已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl。
(1)、用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要(填仪器名称);(2)、装置C的作用是;(3)、装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2 , 生成NaClO2的反应方程式为。(4)、如果撤去D中的冷水浴,可能导致产品中混有的杂质是;(5)、反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作③。①55℃蒸发结晶; ②趁热过滤; ③;④低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)、上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是;a.B中有SO2气体产生,并有部分进入D装置内
b.B中浓硫酸挥发进入D中与NaOH中和
c.B中的硫酸钠进入到D装置内
(7)、测定样品中NaClO2的纯度。测定时进行如下实验:准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl- , 将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是;
②所称取的样品中NaClO2的物质的量为(用含c、V的代数式表示)。
33. 某校化学研究性学习小组设计实验验证NH3能还原CuO,并对还原产物进行探究。请回答下列问题:(1)、Ⅰ.验证NH3能还原CuO 试剂X为。(2)、请将提供的装置按合理顺序连接。g→。(3)、装置B的作用是。(4)、证明NH3能还原CuO的实验现象是。(5)、II.探充还原产物的成分
试剂X为。(2)、请将提供的装置按合理顺序连接。g→。(3)、装置B的作用是。(4)、证明NH3能还原CuO的实验现象是。(5)、II.探充还原产物的成分【查阅资料】Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
【实验探究】
实验操作
实验现象
实验结论
取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置
若无现象
①证明红色固体为。
若溶液变蓝
②证明红色固体肯定含有 , 可能含有。
取上述反应后的混合物过滤、洗涤、干燥、称重,得固体6.4g
③经计算,红色固体的成分及其物质的量
34. 某化工厂排放的工业废水中主要含Na+、HSO3ˉ、SO42- , 研究小组欲测定其中HSO3ˉ的浓度,设计如下三个方案。
量取20.00mL废水试样,用0.02moL·K-1MnO4标准溶液进行滴定。记录数据,计算。
回答下列问题
(1)、利用如图所示的装置完成方案一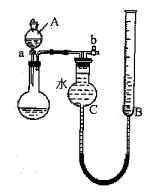
①仪器A的名称是。
②读数前,应进行的操作是。
③该方案存在较大的误差,可能的一种原因是。
(2)、①方案二中吸收气体a的“X溶液”可能是 (填标号)。a.Na2SO3溶液
b.双氧水
c.硝酸钠溶液
d.H2SO4酸化的KMnO4溶液
②若Ⅹ为次氯酸钠,写出气体a与X溶液反应的离子方程式。
③该方案中,操作I包含的操作名称依次为。
(3)、①方案三设计的下列滴定方式中,最合理的是 (填标号)。该方案是否需要指示剂? (填“是”或“否”),原因是。
②滴定记录数据如下表:
滴定前读数/mL
滴定后读数/mL
第一次
0.10
16.12
第二次
1.10
17.08
第三次
1.45
21.45
第四次
0.00
16.00
计算该废水试样中HSO3ˉ的浓度为 mol ·L-1。
35. 氰化钠化学式为NaCN(C元素+2价,N元素-3价),氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。(1)、NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是。(2)、氰化钠与硫代硫酸钠的反应为:NaCN+Na2S2O3═NaSCN+Na2SO3;已知:NaSCN中S为-2价,写出SCN-的电子式。(3)、CN-中C元素显+2价,N元素显-3价,说明非金属性N>C,请设计实验证明:。(4)、同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如表:弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25℃)
Ka=1.77×10-4
Ka=5.0×10-10
Ka1=4.3×10-7 Ka2=5.6×10-11
①向NaCN溶液中通入少量CO2 , 发生的离子反应为。
②等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数的关系是:HCOONaNaCN。(填“>”、“<”或“=”)
(5)、常温下,用0.10mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。
①常温时醋酸的电离常数为1.96×10-5 , 0.10 mol·L-1CH3COOH溶液中c(H+)=mol·L-1。
②在①所示的溶液中溶质为
③在①和②所示溶液中c(CH3COO-)-c(CN-)(填“>”、“<”或“=”)c(HCN)-c(CH3COOH)。