高考二轮复习知识点:溴乙烷的制取
试卷更新日期:2023-08-02 类型:二轮复习
一、选择题
-
1. 1-溴丁烷是密度比水大、难溶于水的无色液体,常用作有机合成的烷基化试剂。将浓硫酸、NaBr固体、1-丁醇混合加热回流后,再经洗涤→干燥→蒸馏获得纯品。实验中涉及如下装置(部分夹持和加热装置省略):

下列说法错误的是( )
A、图中所示两处冷凝管中冷凝水方向均为从a口进b口出 B、气体吸收装置的作用是吸收HBr等有毒气体 C、浓硫酸的作用是作反应物、催化剂等 D、洗涤时,经“水洗→碱洗( 溶液)→水洗”可除去大部分杂质2. 溴乙烷是有机合成的重要原料,实验室中可由乙醇与氢溴酸反应制备,路线如下。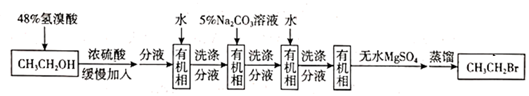
下列说法错误的是( )
A、萃取振荡时,分液漏 斗,下口应倾斜向上 B、用5% Na2CO3溶液洗涤分液时,有机相在分液漏斗的下层 C、无水 MgSO4的作用是除去有机相中残存的少量水 D、蒸馏除去残余反应物乙醇时,乙醇先蒸馏出体系3. 下列实验设计正确的是( ) A、图1:用于实验室制取乙酸乙酯 B、图2:用于甲醇还原氧化铜,并证明产物中有水 C、图3:用于检验溴乙烷发生消去反应后的产物 D、图4:用于除去甲烷中的丙烯4. 下列方法能得到纯度较高的溴乙烷的是( )A、乙炔与溴化氢发生加成反应 B、乙烷与溴单质发生取代反应 C、乙烯与溴单质发生加成反应 D、乙烯与溴化氢发生加成反应5. 实验室以乙醇为原料制备少量1,2—二溴乙烷的相关装置如图所示。下列说法正确的是( )
A、图1:用于实验室制取乙酸乙酯 B、图2:用于甲醇还原氧化铜,并证明产物中有水 C、图3:用于检验溴乙烷发生消去反应后的产物 D、图4:用于除去甲烷中的丙烯4. 下列方法能得到纯度较高的溴乙烷的是( )A、乙炔与溴化氢发生加成反应 B、乙烷与溴单质发生取代反应 C、乙烯与溴单质发生加成反应 D、乙烯与溴化氢发生加成反应5. 实验室以乙醇为原料制备少量1,2—二溴乙烷的相关装置如图所示。下列说法正确的是( ) A、用装置甲制取乙烯,加热混合液使温度缓慢上升至170℃ B、用装置乙净化乙烯,瓶中盛放的试剂可以是KMnO4酸性溶液 C、用装置丙制备1,2—二溴乙烷,冰水浴、液溴液面上加少量水等措施均可减少Br2的挥发 D、用装置丁净化尾气,可除去尾气中的Br2和未反应的乙烯气体6. 某小组用图1图2所示装置进行溴乙烷性质的探究。在图1试管中加入5mL溴乙烷和10mL 6mol/L NaOH水溶液,振荡,水浴加热。将溴乙烷与NaOH乙醇溶液反应产生的气体通入图2装置。下列说法正确的是( )
A、用装置甲制取乙烯,加热混合液使温度缓慢上升至170℃ B、用装置乙净化乙烯,瓶中盛放的试剂可以是KMnO4酸性溶液 C、用装置丙制备1,2—二溴乙烷,冰水浴、液溴液面上加少量水等措施均可减少Br2的挥发 D、用装置丁净化尾气,可除去尾气中的Br2和未反应的乙烯气体6. 某小组用图1图2所示装置进行溴乙烷性质的探究。在图1试管中加入5mL溴乙烷和10mL 6mol/L NaOH水溶液,振荡,水浴加热。将溴乙烷与NaOH乙醇溶液反应产生的气体通入图2装置。下列说法正确的是( ) A、图1图2装置中分别发生的是消去反应和取代反应 B、图1试管中物质充分反应后,可观察到液体出现分层 C、图2中试管A的作用是除去气体中混有的溴乙烷 D、图2若无试管A,可将B中试剂改为溴的四氯化碳溶液7. 实验室可利用如下反应制备一定量1-溴丁烷(难溶于水,密度为1.3g/cm3):CH3CH2CH2CH2OH+NaBr+H2SO4 CH3CH2CH2CH2Br+NaHSO4+H2O,反应后混合物经水洗、干燥、蒸馏等操作可得到精制产品.部分操作装置如图所示:
A、图1图2装置中分别发生的是消去反应和取代反应 B、图1试管中物质充分反应后,可观察到液体出现分层 C、图2中试管A的作用是除去气体中混有的溴乙烷 D、图2若无试管A,可将B中试剂改为溴的四氯化碳溶液7. 实验室可利用如下反应制备一定量1-溴丁烷(难溶于水,密度为1.3g/cm3):CH3CH2CH2CH2OH+NaBr+H2SO4 CH3CH2CH2CH2Br+NaHSO4+H2O,反应后混合物经水洗、干燥、蒸馏等操作可得到精制产品.部分操作装置如图所示:
下列说法中正确的是( )
A、图中I、II处仪器分别为直形冷凝管、球形冷凝管 B、水洗应在装昼③中进行操作,其中水溶液应从下口放出 C、水洗的主要目的是除去没有反应完的1-丁醇 D、可利用酸性KMnO4溶液检验蒸馏后所得产品中是否含有1-丁醇8. 某有机物的结构简式为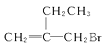 。下列关于该物质的说法中正确的是( ) A、该物质在NaOH的醇溶液中加热可转化为醇类 B、该物质能和AgNO3溶液反应产生AgBr沉淀 C、该物质可以发生消去反应 D、该物质可与溴的四氯化碳溶液发生加成反应9. 下列化学方程式正确的是( )A、甲苯与浓硝酸反应制TNT:
。下列关于该物质的说法中正确的是( ) A、该物质在NaOH的醇溶液中加热可转化为醇类 B、该物质能和AgNO3溶液反应产生AgBr沉淀 C、该物质可以发生消去反应 D、该物质可与溴的四氯化碳溶液发生加成反应9. 下列化学方程式正确的是( )A、甲苯与浓硝酸反应制TNT: + HNO3
+ HNO3  + H2O
B、BrCH2CH2COOH与NaOH醇溶液共热:BrCH2CH2COOH+NaOH CH2=CHCOOH + NaBr + H2O
C、向苯酚钠溶液中通入少量二氧化碳:2
+ H2O
B、BrCH2CH2COOH与NaOH醇溶液共热:BrCH2CH2COOH+NaOH CH2=CHCOOH + NaBr + H2O
C、向苯酚钠溶液中通入少量二氧化碳:2  + CO2 + H2O→2
+ CO2 + H2O→2  + Na2CO3
D、乙醇与浓氢溴酸反应:CH3CH2OH + HBr CH3CH2Br + H2O
+ Na2CO3
D、乙醇与浓氢溴酸反应:CH3CH2OH + HBr CH3CH2Br + H2O
二、非选择题
-
10. 实验室制备1,2﹣二溴乙烷的反应原理如下:
CH3CH2OH→CH2=CH2
CH2=CH2+B2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
用少量的溴和足量的乙醇制备1,2﹣二溴乙烷的装置如下图所示
有关数据列表如下:
乙醇
1,2﹣二溴乙烷
乙醚
状态
无色液体
无色液体
无色液体
密度/g•cm﹣3
0.79
2.2
0.71
沸点/℃
78.5
132
34.6
熔点/℃
﹣130
9
﹣116
回答下列问题:
 (1)、在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是;(填正确选项前的字母)
(1)、在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是;(填正确选项前的字母)a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)、在装置C中应加入 , 其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)、判断该制各反应已经结束的最简单方法是;(4)、将1,2﹣二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层(填“上”、“下”);(5)、若产物中有少量未反应的Br2 , 最好用洗涤除去;(填正确选项前的字母)a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)、若产物中有少量副产物乙醚.可用的方法除去;(7)、反应过程中应用冷水冷却装置D,其主要目的是;但又不能过度冷却(如用冰水),其原因是 .11. 实验室制备1,2-二溴乙烷的反应原理如下:
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:

有关数据列表如下:
乙醇
1,2-二溴乙烷
乙醚
状态
色液体
无色液体
无色液体
密度/g·cm-3
0.79
2.2
0.71
沸点/℃
78.5
132
34.6
熔点/℃
-130
9
-116
回答下列问题:
(1)、在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是;(填正确选项前的字母)a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)、在装置C中应加入 , 其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)、判断该制各反应已经结束的最简单方法是;(4)、将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层(填“上”、“下”);(5)、若产物中有少量未反应的Br2 , 最好用洗涤除去;(填正确选项前的字母)a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)、若产物中有少量副产物乙醚.可用的方法除去;(7)、反应过程中应用冷水冷却装置D,其主要目的是;但又不能过度冷却(如用冰水),其原因是 。12. 醇与氢卤酸反应是制备卤代烃的重要方法。实验室中制备溴乙烷(C2H5Br)通常采用以下方法:①检查装置的气密性;
②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③塞上带有长导管的塞子,长导管的另一端插入装有冰水混合物的试管中,加热反应物(如图所示)。该反应体系可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。用此装置也可制备一些其它的卤代烃,如:1-溴丁烷等。有关数据列表如下:
乙醇
溴乙烷
正丁醇
1-溴丁烷
密度/g·cm-3
0.7893
1.4604
0.8098
1.2758
沸点/℃
78.5
38.4
117.2
101.6
 (1)、该方法制备溴乙烷(C2H5Br)涉及的化学方程式:
(1)、该方法制备溴乙烷(C2H5Br)涉及的化学方程式:①NaBr+H2SO4(浓)NaHSO4+HBr;
②
(2)、图中试管内放入冰水混合物的目的是。(3)、制备操作中,加入的浓硫酸必需进行稀释,其目的除了要减少HBr的挥发外,还有(填字母)。a.减少副产物烯和醚的生成 b.水是反应的催化剂
c.减小硫酸溶液的密度 d.减少Br2的生成
(4)、欲除去溴乙烷中的少量杂质Br2 , 下列试剂中最适合的是(填字母)。a.H2O b.NaOH溶液 c.CCl4 d.Na2SO3溶液
(5)、在制备溴乙烷时,可采用边反应边蒸出产物的方法,其原因是:。但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是:。13. 醇与氢卤酸反应是制备卤代烃的重要方法。实验室中制备溴乙烷(C2H5Br)通常采用以下方法:①检查装置的气密性;
②在圆底烧瓶中加入10 mL 95%乙醇、28 mL 78%浓硫酸,然后加入研细的13 g溴化钠和几粒碎瓷片;
③塞上带有长导管的塞子,长导管的另一端插入装有冰水混合物的试管中,加热反应物(如图所示)。

该反应体系可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚:Br-被浓硫酸氧化为Br2等。用此装置也可制备一些其它的卤代烃,如:1-溴丁烷等。有关数据列表如下:
乙醇
溴乙烷
正丁醇
1-溴丁烷
密度/g·cm-3
0.7893
1.4604
0.8098
1.2758
沸点/℃
78.5
38.4
117.2
101.6
(1)、该方法制备溴乙烷(C2H5Br)的涉及的化学方程式:①NaBr+H2SO4(浓) NaHSO4+HBr ;②。(2)、图中的试管放入冰水混合物的目的是。(3)、制备操作中,加入的浓硫酸必需进行稀释,其目的除了要减少HBr的挥发外,还有。a.减少副产物烯和醚的生成 b.减少Br2的生成 c.减小硫酸溶液的密度 d.水是反应的催化剂
(4)、欲除去溴代烷中的少量杂质Br2 , 下列试剂中最适合的是(填字母)。a.H2O b.NaOH溶液 c.CCl4 d.Na2SO3溶液
(5)、在制备溴乙烷时,会采用边反应边蒸出产物的方法,其原因是。但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是。14. 醇与氢卤酸反应是制备卤代烃的重要方法。已知:溴乙烷及1-溴丁烷均难溶于水且二者在氢氧化钠作用下会发生水解反应。实验室制备溴乙烷和 1溴丁烷的反应如下:NaBr+H2SO 4 =HBr+NaHSO4 ①
R—OH+HBr→ R—Br+H2O②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br- 被浓硫酸氧化为 Br2等。有关数据列表如下:

请回答下列问题:
(1)、在蒸馏过程中,仪器选择及安装都正确的是(填标号)。 (2)、醇的水溶性(填“大于”、“等于”或“小于”)相应的溴代烃。(3)、将 1溴丁烷粗产品置于分液漏斗中加水,振荡后静置,水在(填“上层”“下层”或“不分层”)。(4)、制备操作中,加入的浓硫酸必须进行稀释,其目的是(填字母)。
(2)、醇的水溶性(填“大于”、“等于”或“小于”)相应的溴代烃。(3)、将 1溴丁烷粗产品置于分液漏斗中加水,振荡后静置,水在(填“上层”“下层”或“不分层”)。(4)、制备操作中,加入的浓硫酸必须进行稀释,其目的是(填字母)。a.水是反应的催化剂 b.减少 Br2 的生成
c.减少 HBr 的挥发 d.减少副产物烯和醚的生成
(5)、欲除去溴乙烷中的少量杂质 Br 2 ,下列物质中最适合的是(填字母)。a.NaI b.KCl c.NaOH d.NaHSO 3
(6)、在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于;但在制备 1溴丁烷时却不能边反应边蒸出产物,其原因是。15. 化学实验小组欲在实验室制备溴乙烷(图甲)和1﹣溴丁烷(图乙),涉及化学反应如下:
NaBr+H2SO4═HBr+NaHSO4 ①
C2H5﹣OH+HBr⇌C2H5﹣Br+H2O ②
CH3CH2CH2CH2﹣OH+HBr⇌CH3CH2CH2CH2﹣Br+H2O ③
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br﹣被浓硫酸氧化为Br2等。有关数据列表如下;
乙醇
溴乙烷
正丁醇
1﹣溴丁烷
密度/g•cm﹣3
0.7893
1.4604
0.8098
1.2758
沸点/℃
78.5
38.4
117.2
111.6
请回答下列问题:
(1)、图乙中仪器A的名称为。(2)、乙醇的沸点高于溴乙烷的沸点,其原因是。(3)、将1﹣溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在(填“上层”、“下层”或“不分层”)。(4)、制备操作中,加入的浓硫酸必需进行稀释,其目的是_____。(填字母)A、减少副产物烯和醚的生成 B、减少Br2的生成 C、减少HBr的挥发 D、水是反应的催化剂(5)、欲除去溴代烷中的少量杂质Br2 , 下列物质中最适合的是_____。(填字母)A、NaI B、NaOH C、NaHSO3 D、KCl(6)、制备溴乙烷(图甲)时,采用边反应边蒸出产物的方法,其有利于;但制备1﹣溴丁烷(图乙)时却不能边反应边蒸出产物,其原因是。16. 溴乙烷是有机合成中的重要原料。实验室制备溴乙烷(C2H5Br,沸点38.4℃)的装置如图所示,其实验步骤为:①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;②向仪器a中加入10mL 95%乙醇、28mL 92%浓硫酸,然后加入适量溴化钠和几粒碎瓷片;③在45~50℃加热2h,使其充分反应。回答下列问题: (1)、仪器a的名称是。(2)、在大烧杯中加入冰水的目的是。(3)、加入碎瓷片的作用是。(4)、为了更好的控制温度,选择常用的加热方式为。(5)、反应时若温度过高,可看到有红棕色气体产生,该气体分子式为 , 生成的无色刺激性气味气体的分子式为。(6)、U形管内可观察到的现象是。(7)、反应结束后,U形管内粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可以选择下列试剂中的________(填序号)。A、Na2SO3溶液 B、H2O C、NaOH溶液 D、苯(8)、检验溴乙烷中溴元素的实验步骤是:取少量溴乙烷于试管中,加入NaOH溶液,加热煮沸一段时间,冷却,。17. 实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH→CH2=CH2 CH2=CH2+Br2→BrCH2CH2Br
(1)、仪器a的名称是。(2)、在大烧杯中加入冰水的目的是。(3)、加入碎瓷片的作用是。(4)、为了更好的控制温度,选择常用的加热方式为。(5)、反应时若温度过高,可看到有红棕色气体产生,该气体分子式为 , 生成的无色刺激性气味气体的分子式为。(6)、U形管内可观察到的现象是。(7)、反应结束后,U形管内粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可以选择下列试剂中的________(填序号)。A、Na2SO3溶液 B、H2O C、NaOH溶液 D、苯(8)、检验溴乙烷中溴元素的实验步骤是:取少量溴乙烷于试管中,加入NaOH溶液,加热煮沸一段时间,冷却,。17. 实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH→CH2=CH2 CH2=CH2+Br2→BrCH2CH2Br可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:

有关数据列表如下:

回答下列问题:
(1)、在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是;(填正确选项前的字母)
a.引发反应
b.加快反应速度
c.防止乙醇挥发
d.减少副产物乙醚生成
(2)、在装置C中应加入 , 其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)a.水
b.浓硫酸
c.氢氧化钠溶液
d.饱和碳酸氢钠溶液
(3)、判断该制备反应已经结束的最简单方法是;(4)、将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层(填“上”或“下”);(5)、连接有长玻璃导管的装置B的作用是;(6)、若产物中有少量副产物乙醚,可用的方法除去;(7)、反应过程中应用冷水冷却装置D,其主要目的是;但又不能过度冷却(如用冰水),其原因是。18.(1)、苯、四氯化碳、乙醇、汽油是常见的有机溶剂,能与水互溶的是 , 不溶于水,且密度比水小的是。(2)、写出下列反应的化学方程式并注明反应类型① 用乙烷制备氯乙烷(C2H5Cl) , ;
② 乙烯与水反应制乙醇 , ;
③ 苯制取溴苯 , 。
19. 1,2-二溴乙烷在农业、医药上有多种用途,也可用作汽油抗震液中铅的消除剂。用30mL浓硫酸、15mL95%乙醇和12.00g液溴制备1,2-二溴乙烷的原理和装置如下(加热及夹持装置略)。第一步用乙醇制乙烯:(加热时,浓硫酸可使乙醇炭化);
第二步将乙烯通入液溴: (反应放热)。

回答下列问题:
(1)、装置A用于制备乙烯,仪器a的名称为。(2)、装置B是安全瓶,可监测实验进行时D中是否发生堵塞,若发生堵塞,装置B的玻璃管中可能出现的现象是。(3)、装置C中盛装的是NaOH溶液,装置C作用是 。如果没有装置C装置D中还可能发生反应的化学方程式为;装置C与D之间可增加一个盛装品红溶液的试剂瓶,目的是。(4)、装置D中试管和烧杯内水的作用分别是、。(5)、反应结束后,将粗产物依次用10%的氢氧化钠溶液和水洗涤,选用以下实验仪器(填编号)经(填实验操作名称)分离。再加入无水氧化钙干燥,静置一段时间后经过(填实验操作名称)分离氯化钙,最终选用以下实验仪器(填编号)经(填实验操作名称)得到产品。 20. 已知:CH3CH2OH+NaBr+H2SO4(浓) CH3CH2Br+NaHSO4 +H2O。
20. 已知:CH3CH2OH+NaBr+H2SO4(浓) CH3CH2Br+NaHSO4 +H2O。实验室制备溴乙烷(沸点为38.4℃)的装置和步骤如下:
①按下图所示连接仪器,检查装置的气密性,然后向U形管和大烧杯里加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小火加热,使其充分反应。

试回答下列问题:
(1)、反应时若温度过高可看到有红棕色气体产生,该气体的化学式为。(2)、为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是。(3)、反应结束后,U形管中粗制的溴乙烷呈棕黄色。将U形管中的混合物倒入分液漏斗中,静置,待液体分层后,分液,取(填“上层”或“下层”)液体。为了除去其中的杂质,可选择下列试剂中的(填序号)。A.Na2SO3溶液 B.H2O C.NaOH溶液 D.CCl4
(4)、要进一步制得纯净的C2H5Br,可再用水洗,然后加入无水CaCl2干燥,再进行(填操作名称)。(5)、下列几项实验步骤,可用于检验溴乙烷中的溴元素,其正确的操作顺序是:取少量溴乙烷,然后(填序号)。①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却
21. 实验室用 CH3CH2OH 分两步制备 1,2-二溴乙烷。现用少量的溴和足量的乙醇制备 1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
物质名称
乙醇
1,2-二溴乙烷
乙醚
状态
无色液体
无色液体
无色液体
密度/(g·cm -3)
0.79
2.2
0.71
沸点/℃
78.5
132
34.6
熔点/℃
-130
9
-116
回答下列问题:
(1)、装置A 中发生的化学方程式为 , 反应类型为 , 在此制备实验中,要尽可能迅速地把反应温度提高到 170 ℃左右,其最主要目的是 (填字母)。a.引发反应 b.防止乙醇挥发 c.减少副产物乙醚生成 d.加快反应速率
(2)、装置B 的作用是 , 在装置C 中应加入 (填字母),其目的是吸收反应中可能生成的酸性气体。a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(3)、装置D 中实验现象为 。(4)、将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 (填“上”或“下”)层。(5)、反应过程中应用冷水冷却装置 D,其主要目的是 ;不用冰水原因 。(6)、若制得的产物中混有乙醚,得到纯净的产物的操作是。22. 实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
有关数据列表如下:
乙醇
1,2-二溴乙烷
乙醚
状态
无色液体
无色液体
无色液体
密度/g · cm-3
0.79
2.2
0.71
沸点/℃
78.5
132
34.6
熔点/℃
-130
9
-116
回答下列问题:
(1)、写出由乙醇制备乙烯的化学方程式 , 乙烯制备1,2-二溴乙烷的化学方程式。(2)、在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是;(填正确选项前的字母)a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)、在装置A中除了浓硫酸和乙醇外,还应加入 , 其目的是装置A中生成副产物乙醚的化学反应方程式 。(4)、实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放 ,a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液 d.品红和酸性KMnO4
(5)、将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层(填“上”、“下”);若产物中有少量副产物乙醚。可用的方法除去。23. 实验室制取少量溴乙烷的装置如图所示。根据题意完成下列填空:
 (1)、圆底烧瓶中加入的反应物是溴化钠、和1:1的硫酸。配制体积比1:1的硫酸所用的定量仪器为(选填编号)。
(1)、圆底烧瓶中加入的反应物是溴化钠、和1:1的硫酸。配制体积比1:1的硫酸所用的定量仪器为(选填编号)。a.天平 b.量筒 c.容量瓶 d.滴定管
(2)、写出加热时烧瓶中发生的主要反应的化学方程式。(3)、将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是。试管A中的物质分为三层(如图所示),产物在第层。(4)、试管A中除了产物和水之外,还可能存在、(写出化学式)。(5)、用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是(选填编号)。a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是。
(6)、实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:。24. 醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:NaBr+H2SO4=HBr+NaHSO4①
R—OH+HBr
 R—Br+H2O②
R—Br+H2O②可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:

请回答下列问题:
(1)、溴乙烷和1溴丁烷的制备实验中,下列仪器最不可能用到的是(填字母)。a.圆底烧瓶
b.量筒
c.锥形瓶
d.布氏漏斗
(2)、溴代烃的水溶性(填“大于”、“等于”或“小于”)相应的醇,其原因是。(3)、将1溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在(填“上层”“下层”或“不分层”)。(4)、制备操作中,加入的浓硫酸必须进行稀释,其目的是(填字母)。a.减少副产物烯和醚的生成
b.减少Br2的生成
c.减少HBr的挥发
d.水是反应的催化剂
(5)、欲除去溴乙烷中的少量杂质Br2 , 下列物质中最适合的是(填字母)。a.NaI
b.NaOH
c.NaHSO3
d.KCl
(6)、在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于;但在制备1溴丁烷时却不能边反应边蒸出产物,其原因是。25. 现通过以下步骤由 制备
制备 
 (1)、写出A,B的结构简式:A , B。(2)、从左到右依次填写每步反应所属的反应类型(a.取代反应;b.加成反应;c.消去反应。只填字母代号)。(3)、写出反应A→B所需的试剂和条件:。(4)、写出④和⑤的化学方程式 , 。26. 某兴趣小组在实验室用乙醇、浓硫酸和溴化钠和水混合反应来制备溴乙烷,并探究溴乙烷的性质。有关数据见下表:
(1)、写出A,B的结构简式:A , B。(2)、从左到右依次填写每步反应所属的反应类型(a.取代反应;b.加成反应;c.消去反应。只填字母代号)。(3)、写出反应A→B所需的试剂和条件:。(4)、写出④和⑤的化学方程式 , 。26. 某兴趣小组在实验室用乙醇、浓硫酸和溴化钠和水混合反应来制备溴乙烷,并探究溴乙烷的性质。有关数据见下表:乙醇
溴乙烷
液溴
相对分子质量
46
109
160
状态
无色液体
无色液体
深红色液体
密度/(g·cm3)
0.79
1.44
3.1
沸点/℃
78.5
38.4
59
 (1)、I. 溴乙烷的制备
(1)、I. 溴乙烷的制备反应原理如下,实验装置如上图(加热装置、夹持装置均省略):
H2SO4+NaBr NaHSO4+HBr↑ CH3CH2OH+HBr CH3CH2Br+H2O
图甲中A 仪器的名称 , 图中B 冷凝管的作用为。
(2)、若图甲中A 加热温度过高或浓硫酸的浓度过大,均会使 C 中收集到的粗产品呈橙色,原因是A 中发生了副反应生成了;F 连接导管通入稀NaOH 溶液中,其目的主要是吸收等尾气防止污染空气(3)、II. 溴乙烷性质的探究用如图实验装置验证溴乙烷的性质:
在乙中试管内加入 10mL6mol·L -1NaOH 溶液和 2mL 溴乙烷,振荡、静置,液体分层,水浴加热。该过程中的化学方程式为。
(4)、若将乙中试管里的 NaOH 溶液换成NaOH 乙醇溶液,为证明产物为乙烯,将生成的气体通入如图丙装置。a 试管中的水的作用是;若无 a 试管,将生成的气体直接通入 b 试管中,则 b中的试剂可以为 。27. 如图是实验室制备溴乙烷的装置(已知溴乙烷的沸点38.4℃)。步骤如下:
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。
请回答下列问题:
(1)、已知烧瓶中制备溴乙烷时包含两个反应,写出反应②:①NaBr+H2SO4=HBr+NaHSO4
②
(2)、溴乙烷的水溶性(填“大于”“等于”或“小于)乙醇的水溶性,其原因是。(3)、反应时若温度过高,会有多种有机副产物生成,写出相应的化学方程式(任写一个)(4)、反应结束后,U形管中制得的溴乙烷呈棕黄色。为了除去产品中的杂质,可选择下列试剂中的填序号)。A.H2O B.Na2SO3溶液 C.CCl4 D.NaOH溶液
除杂所需的主要玻璃仪器是(填仪器名称)
(5)、检验溴乙烷中溴元素:取少量溴乙烷,然后(按正确的操作顺序填序号)。①加热:②加入AgNO3溶液:③加入稀HNO3酸化; ④冷却;⑤加入NaOH溶液
28. 已知:实验室用少量的溴和足量的乙醇、浓硫酸制备1,2﹣二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。有关数据列表如下:
乙醇
1,2﹣二溴乙烷
乙醚
状态
无色液体
无色液体
无色液体
密度/g•cm﹣3
0.79
2.2
0.71
沸点/℃
78.5
132
34.6
熔点/℃
-130
9
-116
回答下列问题:
(1)、用少量的溴和足量的乙醇、浓硫酸制备1,2﹣二溴乙烷的需分两步进行,第一步需要在冰水浴下混合浓硫酸和乙醇,混合时加入试剂的顺序是 , 使用冰水浴降温的目的是 , 第二步反应的化学方程式。(2)、在此实验中,要在A中加入 , 防止 , 反应温度提高到170℃左右,其最主要目的是(填正确选项前的字母)。a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)、装置B的作用是 , 在装置C中应加入 , 其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母)。a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)、判断D中反应结束的方法是 , 将D中1,2﹣二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层(填“上”、“下”)。(5)、若产物中有少量副产物乙醚,可用的方法除去。(6)、反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是。29. 滴液漏斗已知:R﹣OH+HX→R﹣X+H2O如图是实验室用乙醇与浓硫酸和溴化钠反应制备溴乙烷的装置,图中省去了加热装置.有关数据见表:

乙醇、溴乙烷、溴有关参数
乙醇
溴乙烷
溴
状态
无色液体
无色液体
深红棕色液体
密度/g•cm﹣3
0.79
1.44
3.1
沸点/℃
78.5
38.4
59
(1)、制备操作中,加入的浓硫酸必需进行稀释,其目的是 .a减少副产物烯和醚的生成 b.减少Br2的生成c减少HBr的挥发 d.水是反应的催化剂
(2)、加热的目的是(从速率和限度两方面回答);应采取的加热方式是 .(3)、为除去产品中的一种主要杂质,最好选择下列溶液来洗涤产品.A、氢氧化钠 B、碘化钠 C、亚硫酸钠(4)、第(3)步的实验所需要的主要玻璃仪器是 .