高考二轮复习知识点:探究碳酸钠与碳酸氢钠的性质
试卷更新日期:2023-08-02 类型:二轮复习
一、选择题
-
1. 下列“类比”结果不正确的是( )A、 的热稳定性比 的弱,则 的热稳定性比 的弱 B、 的分子构型为V形,则二甲醚的分子骨架( )构型为V形 C、 的溶解度比 的大,则 的溶解度比 的大 D、将丙三醇加入新制 中溶液呈绛蓝色,则将葡萄糖溶液加入新制 中溶液也呈绛蓝色2. 下列说法错误的是( )A、 会破坏铝表面的氧化膜 B、 的热稳定性比 强 C、 具有氧化性,其稀溶液可用于消毒 D、钢铁在潮湿空气中生锈主要是发生了电化学腐蚀3. 化学与生活密切相关,下列说法错误的是()A、碳酸钠可用于去除餐具的油污 B、漂白粉可用于生活用水的消毒 C、氢氧化铝可用于中和过多的胃酸 D、碳酸钡可用于胃肠X射线造影检查4. 常温下,用如图1所示装置,分别向溶液和溶液中逐滴滴加的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图2所示。下列说法正确的是( )
 A、X曲线为溶液的滴定曲线 B、b点溶液的pH大于c点溶液的pH C、c点的溶液中: D、a、d两点水的电离程度:a>d5. 配制pH约为10的NaHCO3和Na2CO3的混合溶液,其中NaHCO3和Na2CO3的浓度分别为0.06mol·L-1和0.04mol·L-1。下列关于该溶液的说法不正确的是( )A、c(CO)+c(HCO)+c(H2CO3)=0.10mol·L-1 B、2c(CO)+c(HCO)<c(Na+) C、向其中滴加少量稀盐酸时(保持温度不变),CO+H2OHCO+OH-的平衡常数增大 D、向其中滴加少量NaOH溶液时,的值增大6. 在给定条件下,下列选项所示的物质间转化不能一步实现的是( )A、 B、 C、 D、7. 用如图实验装置进行相应实验,能达到实验目的的是( )
A、X曲线为溶液的滴定曲线 B、b点溶液的pH大于c点溶液的pH C、c点的溶液中: D、a、d两点水的电离程度:a>d5. 配制pH约为10的NaHCO3和Na2CO3的混合溶液,其中NaHCO3和Na2CO3的浓度分别为0.06mol·L-1和0.04mol·L-1。下列关于该溶液的说法不正确的是( )A、c(CO)+c(HCO)+c(H2CO3)=0.10mol·L-1 B、2c(CO)+c(HCO)<c(Na+) C、向其中滴加少量稀盐酸时(保持温度不变),CO+H2OHCO+OH-的平衡常数增大 D、向其中滴加少量NaOH溶液时,的值增大6. 在给定条件下,下列选项所示的物质间转化不能一步实现的是( )A、 B、 C、 D、7. 用如图实验装置进行相应实验,能达到实验目的的是( )A
B
C
D




验证C的非金属性强于Si
比较Fe2+和Cr3+还原性强弱
比较碳酸钠与碳酸氢钠的热稳定性
制备氢氧化铁胶体
A、A B、B C、C D、D8. 关于相同物质的量浓度的NaHCO3溶液和Na2CO3溶液,下列说法错误的是( )A、溶液中所含离子的种类相同 B、溶液的pH相同 C、都能与盐酸反应放出CO2气体 D、都能使澄清石灰水变浑浊9. 下列实验操作可达到实验目的的是( )A、用长颈漏斗可分离乙酸乙酯和饱和碳酸钠溶液 B、将NaOH溶液滴加到FeCl3溶液中可制备Fe(OH)3胶体 C、用浓盐酸和MnO2反应制备纯净的Cl2 , 气体产物先通过浓硫酸再通过饱和食盐水 D、除去Na2CO3固体中的NaHCO3 , 可将固体加热至恒重10. 根据下列实验现象,所得结论正确的是( )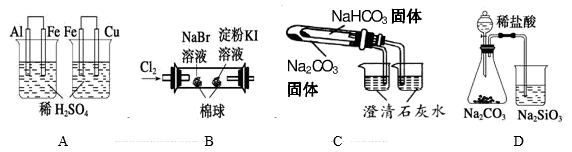
实验
实验现象
结论
A
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡
氧化性:Al3+>Fe2+>Cu2+
B
左边棉花变为橙色,右边棉花变为蓝色
氧化性:Cl2>Br2>I2
C
右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化
热稳定性:Na2CO3>NaHCO3
D
锥形瓶中有气体产生,烧杯中液体变浑浊
非金属性:Cl>C>Si
A、A B、B C、C D、D11. 某同学为探究NaHCO3的性质进行如下实验:常温下测得0.10mol· NaHCO3溶液的pH为8.4;取NaHCO3溶液向其中滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列分析正确的是( )A、反应的离子方程式:HCO3-+Ca2+→CaCO3↓+H+ B、加入CaCl2促进了HCO3-的电离,没有影响HCO3-的水解 C、反应的离子方程式:2HCO3-+Ca2+→CaCO3↓+H2CO3 D、反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+c(Cl-)12. 通过测定混合气中O2含量可计算已变质的Na2O2 (含Na2CO3) 纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是( )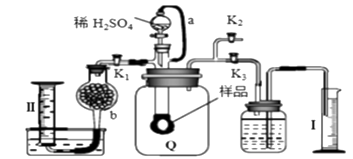 A、干燥管b中装入碱石灰 B、Q气球中产生的气体主要成分O2、CO2 C、测定气体总体积必须关闭K1、K2 , 打开K3 D、读完气体总体积后,关闭K3 , 缓缓打开K1;可观察到Q气球慢慢缩小13. 下列有关物质性质与用途具有对应关系的是( )A、Si的熔点高,可用作半导体材料 B、SO2具有氧化性,可用于漂白纸浆 C、Na2CO3溶液呈碱性,可用于洗涤油污 D、Al2O3硬度很大,可用于制造耐火材料14. 下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )A、取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 B、取a克混合物充分加热,减重b克 C、取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 D、取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体15. 化学实验操作是进行科学实验的基础。下列操作符合规范能达到实验目的的是
A、干燥管b中装入碱石灰 B、Q气球中产生的气体主要成分O2、CO2 C、测定气体总体积必须关闭K1、K2 , 打开K3 D、读完气体总体积后,关闭K3 , 缓缓打开K1;可观察到Q气球慢慢缩小13. 下列有关物质性质与用途具有对应关系的是( )A、Si的熔点高,可用作半导体材料 B、SO2具有氧化性,可用于漂白纸浆 C、Na2CO3溶液呈碱性,可用于洗涤油污 D、Al2O3硬度很大,可用于制造耐火材料14. 下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )A、取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 B、取a克混合物充分加热,减重b克 C、取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 D、取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体15. 化学实验操作是进行科学实验的基础。下列操作符合规范能达到实验目的的是



A.比较Na2CO3、NaHCO3的稳定性
B.排空气法收集CO2
C.钠的燃烧
D.溶液滴加
A、A B、B C、C D、D16. 向1LNaOH溶液中通入一定量的气体,充分反应后,再向所得溶液中逐滴加入的盐酸,产生的体积与所加盐酸体积之间关系如图所示。下列判断正确的是 A、通入的在标准状况下的体积为448mL B、原NaOH溶液的浓度为 C、所得溶液的溶质成分的物质的量之比为 D、所得溶液的溶质成分的物质的量之比为17. 和广泛地应用于生产和生活中。下列有关和的说法中正确的是A、可以用澄清石灰水来鉴别溶液和溶液 B、固体中含少量杂质,可通过加热的方法除去 C、等质量的、分别与足量盐酸反应,前者产生多 D、向等物质的量浓度的和溶液中滴加等体积的酚酞溶液,溶液的红色较深
A、通入的在标准状况下的体积为448mL B、原NaOH溶液的浓度为 C、所得溶液的溶质成分的物质的量之比为 D、所得溶液的溶质成分的物质的量之比为17. 和广泛地应用于生产和生活中。下列有关和的说法中正确的是A、可以用澄清石灰水来鉴别溶液和溶液 B、固体中含少量杂质,可通过加热的方法除去 C、等质量的、分别与足量盐酸反应,前者产生多 D、向等物质的量浓度的和溶液中滴加等体积的酚酞溶液,溶液的红色较深二、非选择题
-
18. 关注物质的宏观组成和微观构成,是研究物质性质及其转化的基本出发点。(1)、从物质分类看,Na2CO3和NaHCO3均属于(选填序号),因此具有某些相似的化学性质。
a.氧化物 b. 酸 c. 碱 d. 盐
(2)、探究Na2CO3和NaHCO3的相互转化。【实验1】 加热碳酸氢钠固体,装置如下图所示。

①利用上述装置可实现NaHCO3向 Na2CO3发生转化,试管中发生反应的化学方程式为。
【实验2】 分别向滴有2滴酚酞的NaHCO3和Na2CO3溶液中滴加稀盐酸,实验记录如下:
实验内容
实验现象

实验2-1
溶液浅红色褪去,立即产生大量气泡。
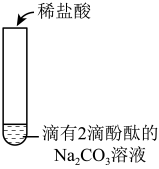
实验2-2
开始时,溶液的红色没有明显变化,也没有明显的气泡产生。继续滴加盐酸,当溶液的红色明显变浅时,气泡的数量也逐渐增多。当溶液的颜色变为浅红色,继续滴加盐酸,溶液的浅红色褪去,有大量气泡出现。
②实验2-1中,反应的离子方程式是
③实验2-2中,实现碳酸钠向碳酸氢钠转化的现象是。
④通过上述实验,从物质组成上分析Na2CO3转化为NaHCO3 , 加入盐酸的作用是;碳酸也可实现上述转化,写出将CO2通入Na2CO3溶液中发生反应的化学方程式:。
(3)、探究NaCl转化为NaHCO3。资料i:
物质
NaCl
NaHCO3
NH4HCO3
NH4Cl
20℃时的溶解度(g/100gH 2O)
36.0
9.6
21.7
37.2
资料ii:氨气(NH3)可与水发生反应,生成一水合氨(NH3∙H2O),一水合氨属于一种碱。
①向饱和NaCl溶液中通入足量CO2 , 无NaHCO3生成,原因是。
②向饱和NaCl溶液中先通入NH3 , 再通入CO2 , 在溶液中可析出NaHCO3晶体,该反应的化学方程式 , 通入NH3的作用是。
19. 学习小组探究碳酸钠和碳酸氢钠性质(1)、分别取和如图:Ⅰ中浅红色褪去,且立即产生大量气泡;Ⅱ中开始无气泡,溶液颜色由红色变为浅红色,最后出现大量气泡.

①浓度相同时,碱性(填“>”或“<”)。
②Ⅱ的反应过程出现的证据是 , 其离子反应的方程式。
(2)、用固体配制溶液。①用到的玻璃仪器有:量筒、烧杯、玻璃棒、胶头滴管和。
②计算需要固体的质量是g。
③下列情况中,会使所配溶液浓度偏高的是(填字母)。
a.转移时,没有洗涤烧杯和玻璃棒
b.定容时,眼睛俯视刻度线
c.摇匀后,发现液面低于刻度线,继续加水至液面与刻度线相切
(3)、我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献.下图为联合制碱法的主要过程(部分物质已略去)。已知:ⅰ.极易溶于水并生成碱,与酸反应生成盐,如。
ⅱ.有关物质的溶解度
物质
溶解度/g
36.0
21.7
9.6
37.2
沉淀池中主要沉淀物(化学式),发生反应的化学方程式为。
20. Na2CO3和NaHCO3都是重要的化工原料,在生产和生活中有着广泛的应用。(1)、Na2CO3俗称 , 往Na2CO3溶液中滴加酚酞,溶液呈色。(2)、用洁净的铂丝蘸取Na2CO3溶液置于酒精灯火焰上灼烧,火焰呈色。(3)、实验室中需0.2mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3的质量分别是____(填字母)。A、1000mL;21.2g B、950mL;20.14g C、500mL; 21.2g D、500mL; 10.6g(4)、胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的NaHCO3能治疗胃酸过多,请写出其反应的离子方程式:。(5)、除去Na2CO3粉末中混有的少量NaHCO3的方法是 , 化学方程式为。21. 应用分类的方法可以发现物质及其变化的规律,预测物质的性质及可能发生的变化。某小同学通过实验探究Na2CO3和NaHCO3的性质,请你与他们一起完成实验探究过程,并回答问题。(1)、[观察]Na2CO3和 NaHCO3均为色的固体,
(2)、从物质的类别来看, Na2CO3和NaHCO3均属于化合物中的类,能溶于水,可与部分、、盐等类别的物质发生反应。(3)、[实验过程]编号
实验内容
实验数据或者现象
实验I
利用传感器探究两种物质分别溶水时的温度变化


实验II
探究两种物质得到热稳定性

一段时间后,A中无明显现象,B中…
实验III
探究两种物质分别与盐酸反应

A中开始无大量气泡,一段时间后产生大量气泡;B中立即产生大量气泡。
实验II试管B中的现象为。
(4)、[分析与解释]实验I所得实验数据证明,溶解时吸收热量的物质是。
(5)、实验II中的现象证明,Na2CO3的热稳定性(填“强”或“弱”)于NaHCO3(6)、实验III中的现象证明,Na2CO3盐酸反应是分步进行的,发生反应的离子方程式为:第一步:CO+ H+=HCO;第二步: 。
22. Na2CO3可用于纺织、制肥皂、造纸、制玻璃等,NaHCO3可用于制药、焙制糕点等,两者都是白色固体;某实验小组通过以下实验来探究Na2CO3和NaHCO3两种物质的性质。(1)、称取两种固体各2g,分别放入两个小烧杯中,再各滴加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴加2滴酚酞试液。①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论。
②同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3的烧杯中出现的现象:I.溶液温度升高;II.(填字母序号)。
a.滴入酚酞后呈浅红色 b.滴入酚酞后呈红色
(2)、“套管实验”的实验装置如图所示,请分析实验原理,并回答下列问题: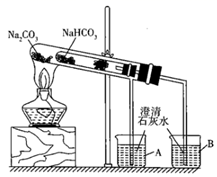
①整个实验过程中,能观察到烧杯B中的现象是;
②实验结束时的操作是。
③写出实验过程中试管中发生反应的化学方程式:。
④该实验可证明NaHCO3的热稳定性(填“强于”“弱于”或“等于”)Na2CO3;证明热稳定性的实验装置中,能否将NaHCO3、Na2CO3的位置互换?(填“能”或“不能”)。
⑤能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是。

A.将Na2CO3和NaHCO3配制成同浓度的溶液,用pH试纸测定pH值并做比较
B.两支试管中均盛有3mL6mol/L稀盐酸,将少量等质量的Na2CO3、NaHCO3粉末同时倒入试管中,比较反应快慢(如图)。
C.分别在这两种物质的溶液中,加入少量Ca(OH)2溶液
⑥下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是。
A.取a g混合物充分加热,减重b g
B.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体
C.取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g
D.取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g固体
23. X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色试验均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
已知:NaHCO3+NaOH=Na2CO3+H2O;
请回答:
(1)、X生成Z的化学方程式是。(2)、X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置III中产生白色沉淀,装置V中可收集到一种无色气体。
①装置II中物质的化学式是。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置V中气体,所需仪器装置是__(从图中选择必要装置,填写编号)。
(3)、向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是。(4)、为测定X和Z混合物中Z的质量分数,某课外小组取ag混合物充分加热,质量减少bg,则混合物中Z的质量分数是(用含a、b的代数式表示)。24. 某小组研究Na2CO3和NaHCO3的性质,实验如下。(1)、(实验一)序号
操作
现象
Na2CO3
NaHCO3
①
在两支试管中加入1g Na2CO3或1g NaHCO3 , 再加入5mL水,振荡;将温度计分别插入其中
温度由17.6℃变为23.2℃;放置至室温时,试管内无固体
温度由17.6℃变为17.2℃;放置至室温时,试管内有少量固体残留
②
室温时,分别向①所得溶液中滴入2滴酚酞溶液
溶液变红
溶液微红
室温下,Na2CO3的溶解度大于NaHCO3的实验证据是。
(2)、根据两试管中的温度变化情况,可得出的结论是。(3)、该实验不能说明Na2CO3溶液的碱性强于NaHCO3溶液,理由是。(4)、(实验二)测量下述实验过程的pH变化,实验操作及实验现象如下。
资料:pH越小,c(OH-)越小,溶液碱性越弱。
实验操作
实验现象

Ⅰ.②和③中均产生白色沉淀。
Ⅱ.

澄清石灰水显碱性,用电离方程式表示其原因是。
(5)、白色沉淀是。(6)、加入4mL Na2CO3溶液或4mLNaHCO3溶液时,产生的白色沉淀的质量相等。写出推理过程:。25.(1)、小苏打的化学式:。(2)、写出乙醛的结构简式:。(3)、甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃。已知室温下1g甲硅烷自燃生成SiO2固体和液态水放出热量44.6kJ,则其热化学方程式为。26. 某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。 (1)、只根据图Ⅰ所示实验,不能够达到实验目的的原因。(2)、图Ⅱ、Ⅲ所示实验均能鉴别这两种物质,其反应的化学方程式为。(3)、若用实验Ⅱ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是(填化学式)。27. 对比分析钠及其化合物的特点,请完成下列空白。
(1)、只根据图Ⅰ所示实验,不能够达到实验目的的原因。(2)、图Ⅱ、Ⅲ所示实验均能鉴别这两种物质,其反应的化学方程式为。(3)、若用实验Ⅱ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是(填化学式)。27. 对比分析钠及其化合物的特点,请完成下列空白。 (1)、图所示转化关系中属于氧化还原反应的有个。反应⑤和⑧离子方程式分别为、。(2)、日常生活中常用到苏打和小苏打,鉴别它们的方法有多种。例如:
(1)、图所示转化关系中属于氧化还原反应的有个。反应⑤和⑧离子方程式分别为、。(2)、日常生活中常用到苏打和小苏打,鉴别它们的方法有多种。例如:
方法①:如图所示装置,这是根据它们具有不同的稳定性加以鉴别的。实验过程中,当试管B中盛放的澄清溶液出现白色浑浊时,试管A中发生反应的化学方程式是。
方法②:取等物质的量的苏打和小苏打分别于试管中,再分别加入足量盐酸充分反应,比较相同条件下收集到的气体的体积。请写出相关反应的离子方程式: 、。
28. 现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl3固体 ⑥稀NaOH溶液 ⑦硝酸亚铁溶液。(1)、上述物质中属于电解质的物质序号为 。(2)、有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是。(3)、加入盐酸、NaOH溶液均能发生化学反应的物质序号为。(4)、能导电的物质序号为。(5)、④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表示)。(6)、实验室用⑤制备胶体的化学方程式为。如果将1molFeCl3全部制成胶体,制得的胶体(选填“带负电”“电中性”“带正电”),胶粒数目NA(选填“大于”“等于”“小于”)。29. 纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。(1)、工业上“侯氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。生产纯碱的工艺流程示意图如下:
请回答下列问题:
①析出的NaHCO3晶体中可能含有少量氯离子杂质,检验该晶体中是否含有氯离子杂质的操作方法是。
②该工艺流程中可回收再利用的物质是。
③若制得的纯碱中只含有杂质NaCl。测定该纯碱的纯度,下列方案中可行的是(填字母)。
a. 向m克纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g
b. 向m克纯碱样品中加入足量稀盐酸,用碱石灰(主要成分是CaO和NaOH)吸收产生的气体,碱石灰增重b g
c. 向m克纯碱样品中加入足量AgNO3溶液,产生的沉淀经过滤、洗涤、干燥,称其质量为b g
(2)、将0.84 g NaHCO3和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.10 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是___________(填字母)。A、 B、
B、 C、
C、 D、
D、 (3)、若称取10.5 g纯净的NaHCO3固体,加热一段时间后,剩余固体的质量为8.02 g。如果把剩余的固体全部加入到100 mL 2 mol·L-1的盐酸中充分反应。求溶液中剩余的盐酸的物质的量浓度(设溶液的体积变化及盐酸的挥发忽略不计)。30. 如图所示实验为“套管实验”,小试管内塞有沾有白色无水硫酸铜粉末的棉花球。
(3)、若称取10.5 g纯净的NaHCO3固体,加热一段时间后,剩余固体的质量为8.02 g。如果把剩余的固体全部加入到100 mL 2 mol·L-1的盐酸中充分反应。求溶液中剩余的盐酸的物质的量浓度(设溶液的体积变化及盐酸的挥发忽略不计)。30. 如图所示实验为“套管实验”,小试管内塞有沾有白色无水硫酸铜粉末的棉花球。 (1)、点燃酒精灯加热,能观察到的实验现象是:棉花团变色,(填A或B)中的石灰水变浑浊(2)、由上述实验你能得出的结论是:Na2CO3的热稳定性(填大于或小于) NaHCO3(3)、写出碳酸氢钠受热分解的化学方程式31. 现有下列4种物质:①浓H2SO4、②NO2、③NH4Cl、④NaHCO3。其中,可以使蔗糖变黑的是(填序号);与水发生反应由红棕变为无色的是(填序号);加热分解,遇冷又化合的是(填序号);加热分解生产无色无味气体的反应方程式是。32. A,B,C是中学化学常见的三种物质,它们之间的相互转化关系如图所示(部分反应条件及产物略去)。
(1)、点燃酒精灯加热,能观察到的实验现象是:棉花团变色,(填A或B)中的石灰水变浑浊(2)、由上述实验你能得出的结论是:Na2CO3的热稳定性(填大于或小于) NaHCO3(3)、写出碳酸氢钠受热分解的化学方程式31. 现有下列4种物质:①浓H2SO4、②NO2、③NH4Cl、④NaHCO3。其中,可以使蔗糖变黑的是(填序号);与水发生反应由红棕变为无色的是(填序号);加热分解,遇冷又化合的是(填序号);加热分解生产无色无味气体的反应方程式是。32. A,B,C是中学化学常见的三种物质,它们之间的相互转化关系如图所示(部分反应条件及产物略去)。 (1)、若A是一种淡黄色单质固体,则B→C的化学方程式为。(2)、若A是一种黑色单质固体,将一定量C缓慢通入NaOH溶液中,充分反应,测得最后溶液的显碱性,此时溶液的溶质如果是单一成分,可能是、;如果是多种成分,可能是、。(3)、若A是一种活泼金属,C是淡黄色固体,试用化学方程式表示该物质C的一个重要应用。 将C长期露置于空气中,最后将变成物质D,D的化学式为。现有D和NaHCO3的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为。33. 现有一定量含有Na2O杂质的Na2O2试样,用如图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)
(1)、若A是一种淡黄色单质固体,则B→C的化学方程式为。(2)、若A是一种黑色单质固体,将一定量C缓慢通入NaOH溶液中,充分反应,测得最后溶液的显碱性,此时溶液的溶质如果是单一成分,可能是、;如果是多种成分,可能是、。(3)、若A是一种活泼金属,C是淡黄色固体,试用化学方程式表示该物质C的一个重要应用。 将C长期露置于空气中,最后将变成物质D,D的化学式为。现有D和NaHCO3的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为。33. 现有一定量含有Na2O杂质的Na2O2试样,用如图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)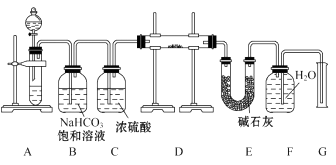
回答下列问题:
(1)、装置A中液体试剂选用(2)、装置B的作用是 , 装置C的作用是 , 装置E中碱石灰的作用是。(3)、装置D中发生反应的化学方程式是。(4)、若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为。34. 某同学在实验室研究Na2CO3和NaHCO3的性质及相互转化.(1)、分别向浓度均为0.1mol/LNa2CO3及NaHCO3溶液中滴加几滴酚酞试剂:①Na2CO3溶液由无色变为红色,其原因是 .
②NaHCO3溶液也由无色变为红色,其原因是 .
③比较两份溶液的颜色,红色较浅的是(填化学式).
(2)、研究NaHCO3与CaCl2的反应.实验序号
实验操作
实验现象
实验1
向2mL 0.001mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液
无明显变化.用激光笔照射,没有出现光亮的通路.
实验2
向2mL 0.1mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液
略显白色均匀的浑浊,用激光笔照射,出现光亮的通路.
①实验1中没有出现白色浑浊的原因是 .
②实验2中形成的分散系属于 .
③用离子方程式表示实验2中发生的反应 .
(3)、在不引入其他杂质的前提下,实现Na2CO3与NaHCO3之间的转化,请在图中标出所用的试剂、用量或物质的浓度(反应前后溶液体积的变化可忽略). 35. 某课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下4组实验,如图Ⅰ~Ⅳ所示.
35. 某课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下4组实验,如图Ⅰ~Ⅳ所示. (1)、Ⅱ所示的实验,若固体质量相同且稀盐酸足量时,气球鼓起较小的是(填化学式).(2)、Ⅲ、Ⅳ所示的实验均能鉴别这两种物质,相关反应的化学方程式是、 . 与Ⅲ相比,IV的优点是(填选项序号).
(1)、Ⅱ所示的实验,若固体质量相同且稀盐酸足量时,气球鼓起较小的是(填化学式).(2)、Ⅲ、Ⅳ所示的实验均能鉴别这两种物质,相关反应的化学方程式是、 . 与Ⅲ相比,IV的优点是(填选项序号).a.Ⅳ比Ⅲ复杂 b.Ⅳ比Ⅲ安全
c.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)、若用Ⅳ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体应该是 .