高考二轮复习知识点:铁及其化合物的性质实验
试卷更新日期:2023-08-02 类型:二轮复习
一、选择题
-
1. 某实验小组要定量探究铁锈蚀的因素,设计如图所示实验装置,检查气密性,将5 g铁粉和2 g碳粉加入三颈烧瓶,时刻,加入2 mL饱和氯化钠溶液后,再将一只装有5 mL稀盐酸的注射器插到烧瓶上,采集数据。下列说法错误的是
 A、铁发生锈蚀的反应是放热反应 B、温度降低是因为反应速率减慢了 C、BC段压强减小是因为铁和氧气直接反应生成了氧化铁 D、压强变大是因为发生了铁的析氢腐蚀2. 下列做法或实验(图中部分夹持略),不能达到目的的是( )
A、铁发生锈蚀的反应是放热反应 B、温度降低是因为反应速率减慢了 C、BC段压强减小是因为铁和氧气直接反应生成了氧化铁 D、压强变大是因为发生了铁的析氢腐蚀2. 下列做法或实验(图中部分夹持略),不能达到目的的是( )防止铁管道被腐蚀
检验产生的SO2
模拟侯氏制碱法:a先通入NH3 , b中再通入CO2 , c放蘸有稀硫酸的脱脂棉
测量气体体积时,减少误差




A
B
C
D
A、A B、B C、C D、D3. 某小组对FeCl3溶液与Cu粉混合后再加KSCN溶液的实验进行如下研究。①向2mL 0.1mol/L FeCl3溶液中加入过量Cu粉,充分反应后,溶液变蓝。2天后,溶液变为浅蓝色,有白色不溶物生成。
②取①中浅蓝色的上层清液,滴加KSCN溶液,溶液变红,出现白色浑浊。振荡后白色浑浊物增多,红色褪去。经检验,白色不溶物是CuSCN。
③向2mL 0.1mol/LCuSO4溶液中滴加KSCN溶液,未观察到白色浑浊。放置24小时后,出现白色不溶物。
已知:CuCl和CuSCN均为白色不溶固体
下列说法不正确的是( )
A、①中产生白色不溶物的可能原因是Cu+Cu2++2Cl-=2CuCl↓ B、由③可知②中白色浑浊不是Cu2+与SCN-直接反应生成的 C、②中红色褪去的原因是Fe3+被完全消耗了 D、实验表明:Ksp(CuSCN)<Ksp(CuCl)4. 室温下,通过下列实验探究FeCl3水解反应[FeCl3(黄色)+3H2O⇌Fe(OH)3(红褐色)+3HCl]的条件。实验序号
实验操作
实验现象
1
将FeCl3溶液加热片刻
溶液颜色变深
2
向FeCl3 溶液中通入少量HCl气体
溶液颜色变浅
3
向FeCl3溶液中加入少量(NH4)2SO4固体
溶液颜色变浅
4
向FeCl3溶液中加入少量NaHCO3固体
产生红褐色沉淀,溶液中出现大量气泡
下列有关说法正确的是( )
A、实验1得到的溶液中有c(Cl-)>c(Fe3+)>c(OH-)>c(H+) B、实验2中FeCl3水解反应的化学平衡常数变小 C、实验3得到的溶液中有3c(Fe3+)+c(H+)=c(NH3·H2O)+c(Cl-)+c(OH-) D、实验4中反应的离子方程式为Fe3++ +H2O=Fe(OH)3↓+CO2↑5. 下列关于物质的性质和应用的说法正确的是( )A、绿矾的化学式为 FeSO4·7H2O,可用作补血剂 B、从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝 C、泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 D、用 Na2S 作还原剂,除去水中的 Cu2+和 Hg2+6. 硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是( )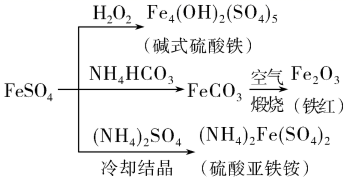 A、碱式硫酸铁水解能产生 Fe(OH)3胶体,可用作净水剂 B、为防止 NH4HCO3分解,生产FeCO3需在较低温度下进行 C、可用铁氰化钾溶液检验 是否被氧化 D、 溶解度受温度的影响较大7. 高铁酸钾( )是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数 δ(X)随pH的变化如图所示[已知 ]。下列说法正确的是( )
A、碱式硫酸铁水解能产生 Fe(OH)3胶体,可用作净水剂 B、为防止 NH4HCO3分解,生产FeCO3需在较低温度下进行 C、可用铁氰化钾溶液检验 是否被氧化 D、 溶解度受温度的影响较大7. 高铁酸钾( )是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数 δ(X)随pH的变化如图所示[已知 ]。下列说法正确的是( )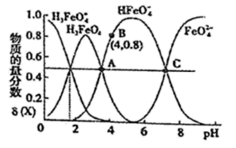 A、K2FeO4、H2FeO4都属于强电解质 B、25℃, 的平衡常数K>100 C、A、C 两点对应溶液中水的电离程度: C <A D、由 B 点数据可知,H2FeO4的第一步电离常数8. 下列有关 溶液的叙述中,正确的是( )A、蒸干该溶液可以得到无水 固体 B、往该溶液中加入少量锌粉,可置换出铁单质 C、该溶液中, 、 、 、 可以大量共存 D、向该溶液中加入 溶液,反应的离子方程式为9. 研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是( )
A、K2FeO4、H2FeO4都属于强电解质 B、25℃, 的平衡常数K>100 C、A、C 两点对应溶液中水的电离程度: C <A D、由 B 点数据可知,H2FeO4的第一步电离常数8. 下列有关 溶液的叙述中,正确的是( )A、蒸干该溶液可以得到无水 固体 B、往该溶液中加入少量锌粉,可置换出铁单质 C、该溶液中, 、 、 、 可以大量共存 D、向该溶液中加入 溶液,反应的离子方程式为9. 研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是( ) A、反应总过程是放热的 B、Fe+作为催化剂改变了反应途径,提高了反应速率 C、Fe++N2O→FeO++N2、FeO++CO→Fe++CO2 两步反应均为放热反应 D、若反应在恒容密闭容器中进行,温度越高,反应速率一定越快10. 如图所示,硫酸铁与M、N、P、Q反应产生不同的现象。则各符号对应的试剂错误的是( )
A、反应总过程是放热的 B、Fe+作为催化剂改变了反应途径,提高了反应速率 C、Fe++N2O→FeO++N2、FeO++CO→Fe++CO2 两步反应均为放热反应 D、若反应在恒容密闭容器中进行,温度越高,反应速率一定越快10. 如图所示,硫酸铁与M、N、P、Q反应产生不同的现象。则各符号对应的试剂错误的是( ) A、M:硫氰化钾溶液 B、N:铁粉 C、P:氢氧化钡溶液 D、Q:氨水11. 亚硝酸亚铁Fe(NO2)2易分解,若分解产物之一是红色粉末Fe2O3 , 则另一分解产物可能是( )A、NO B、N2O3 C、NO2 D、N2O512. 下列实验中,依据实验操作及现象得出的结论正确的是( )
A、M:硫氰化钾溶液 B、N:铁粉 C、P:氢氧化钡溶液 D、Q:氨水11. 亚硝酸亚铁Fe(NO2)2易分解,若分解产物之一是红色粉末Fe2O3 , 则另一分解产物可能是( )A、NO B、N2O3 C、NO2 D、N2O512. 下列实验中,依据实验操作及现象得出的结论正确的是( )选项
操 作
现 象
结 论
A
向 3mL0.1mol/L 的 AgNO3 溶液中先加 入 4—5 滴 0.1mol/L 的 NaCl 溶液,再滴加 4—5 滴 0.1mol/L 的 NaI 溶液
先出现白色沉 淀后出现黄色 沉淀
Ksp(AgCl)>Ksp(AgI)
B
将某气体通入品红溶液
品红溶液褪色
该气体是 SO2
C
用 pH 计测定等浓度的 Na2CO3 和NaClO 溶液的 pH
后者 pH比前者 的小
非金属性:Cl>C
D
将铜粉加入 1.0 mol/L Fe2(SO4)3 溶液中
溶液变蓝
氧化性Fe3+>Cu2+
A、A B、B C、C D、D13. 铁及其化合物与生产生活密切相关。下列说法错误的是( )A、可用铁制槽车装运浓H2SO4 B、不锈钢就是铁碳合金 C、FeCl3可以用作净水剂 D、铁可用于制作磁性材料14. 下图所示的实验或操作中,能达到实验目的的是( )



制备氢氧化亚铁
测定纯碱样品中碳酸钠的质量分数(杂质不与酸作用)
排水法收集H2
钾的焰色试验
A
B
C
D
A、A B、B C、C D、D15. 科学探究与创新意识是重要的化学学科核心素养。下列实验操作与类比均合理的一项是( )选项
实验操作
类比
A
电解CuSO4溶液可以得到Cu单质
电解Al2(SO4)3溶液可以制备Al单质
B
Fe在常温下遇到浓硫酸钝化
Mg在常温下遇到浓硫酸也会纯化
C
CCl4可以萃取碘水中的I2
CCl4可以萃取溴水中的Br2
D
往NaHCO3溶液中滴入酚酞溶液,溶液变红
NaHSO4溶液也能使酚酞溶液变红
A、A B、B C、C D、D16. 下列有关实验装置的说法正确的是( ) A、用图甲装置可测定溶液的浓度 B、用图乙装置可探究温度对平衡体系的影响 C、用图丙装置可制得消毒剂同时减少的逸出 D、用图丁装置可验证铁钉发生了析氢腐蚀
A、用图甲装置可测定溶液的浓度 B、用图乙装置可探究温度对平衡体系的影响 C、用图丙装置可制得消毒剂同时减少的逸出 D、用图丁装置可验证铁钉发生了析氢腐蚀二、多选题
-
17. Fe为过渡金属元素,在工业生产中具有重要的用途。已知NO能被溶液吸收生成配合物 , 该配合物的中心离子的最外层电子数与配体提供的电子总数之和为26。下列有关说法正确的是A、该配合物的化学式为 B、1 mol该配合物与足量溶液反应可生成1 mol沉淀 C、该配合物中所含非金属元素均位于元素周期表p区 D、该配合物中阳离子呈正八面体结构,阴离子呈正四面体结构
三、非选择题
-
18. 某班同学用如下实验探究Fe2+、Fe3+的性质.回答下列问题:(1)、分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L 的溶液.在FeCl2溶液中需加入少量铁屑,其目的是 .(2)、甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化.FeCl2溶液与氯水反应的离子方程式为 .(3)、乙组同学认为甲组的实验不够严谨,该组同学在2mL FeCl2溶液中先加入0.5mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是 .(4)、丙组同学取10mL 0.1mol•L﹣1KI溶液,加入6mL 0.1mol•L﹣1 FeCl3溶液混合.分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红.
实验②检验的离子是(填离子符号);实验①和③说明:在I﹣过量的情况下,溶液中仍含有(填离子符号),由此可以证明该氧化还原反应为 .
(5)、丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是 , 生成沉淀的原因是(用平衡移动原理解释).19.用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.
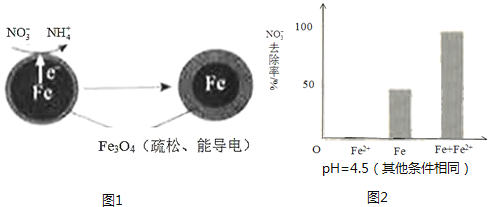 (1)、Fe还原水体中NO3﹣的反应原理如图1所示.
(1)、Fe还原水体中NO3﹣的反应原理如图1所示.①作负极的物质是 .
②正极的电极反应式是 .
(2)、将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如下:
初始pH
pH=2.5
pH=4.5
NO3﹣的去除率
接近100%
<50%
24小时pH
接近中性
接近中性
铁的最终物质形态


pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)、实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: .
(4)、其他条件与(2)相同,经1小时测定NO3﹣的去除率和pH,结果如表:初始pH
pH=2.5
pH=4.5
NO3﹣的去除率
约10%
约3%
1小时pH
接近中性
接近中性
与(2)中数据对比,解释(2)中初始pH不同时,NO3﹣去除率和铁的最终物质形态不同的原因: .
20. 绿矾(FeSO4·7H2O)是一种重要的食品和饲料添加剂。某化学兴趣小组用废铁屑为原科与稀硫酸反应制备绿矾。(1)、将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,除去废铁屑上的油污,过滤,然后将废铁屑用水洗涤2~3遍,其中加热的作用是。(2)、向洗涤过的废铁屑中加入适量稀硫酸,控制温度在50~80℃之间至反应完全(铁屑有剩余),发生反应的离子方程式为。如果加入过量的稀硫酸是否可以,说出你的理由。(3)、趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶,待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,干燥,得到绿矾。请分析用少量冰水洗涤晶体的目的。(4)、为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,质量为m1。将样品装入石英玻璃管中,再次将装置A称重,质量为m2.按下图连接好装置进行实验。
操作步骤如下:
a.打开K1和K2 , 缓缓通入N2;
b.点燃酒精灯,加热:
c.熄灭酒精灯;
d.冷却到室温;
e.关闭K1和K2;
f.称量A。
重复上述操作步骤,直至A恒重(固体为FeSO4),质量为m3。
①仪器B的名称是。整个过程中持续通入N2的目的是。
②根据实验记录,计算绿矾化学式中结晶水数目x=(列式表示)。若实验时按b、a次序操作,则x(填“偏大”、“偏小”或“无影响”)。
21. 硫酸亚铁晶体 在医药上作补血剂。工业上用废铁生产 的一种流程如下图所示: (1)、步骤 I 中除铁和硫酸、铁锈和硫酸反应外, 还有一个反应的化学方程式为:步骤 I 加入稀硫酸的量不能过量的原因是;步骤 II 加入稀硫酸的目的是。(2)、证明步骤 (1)滤液中只含有 的方法: 取样, 先滴加 溶液, 无明显现象, 再滴加; 该过程的现象为:。(3)、步骤 III 从硫酸亚铁溶液中获得硫酸亚铁晶体 的实验操作为、、过滤、冰水洗涤、烘干。烘干操作需在低温条件下进行, 原因是。(4)、取 隔绝空气加热至不同温度, 剩余固体的质量变化如下图所示。
(1)、步骤 I 中除铁和硫酸、铁锈和硫酸反应外, 还有一个反应的化学方程式为:步骤 I 加入稀硫酸的量不能过量的原因是;步骤 II 加入稀硫酸的目的是。(2)、证明步骤 (1)滤液中只含有 的方法: 取样, 先滴加 溶液, 无明显现象, 再滴加; 该过程的现象为:。(3)、步骤 III 从硫酸亚铁溶液中获得硫酸亚铁晶体 的实验操作为、、过滤、冰水洗涤、烘干。烘干操作需在低温条件下进行, 原因是。(4)、取 隔绝空气加热至不同温度, 剩余固体的质量变化如下图所示。
分析数据, 写出 残留物的化学式; 时固体物质发生反应的化学方程式是 , 做出这一判断的依据是。
22. 某实验小组制备高铁酸钾(K2FeO4),并探究其性质。已知:K2FeO4为紫色固体,微溶于KOH溶液中呈紫色溶液;具有强氧化性,在酸性或中性溶液中快速产生O2 , 在碱性溶液中较稳定。
(1)、Ⅰ.制备K2FeO4(夹持装置略)
装置A为氯气发生装置,装置C中得到紫色固体和溶液。请写出C中由Cl2参加反应生成高铁酸钾的化学方程式。
(2)、将装置C中所得混合物进行抽滤,请选择合适的操作并排序。a.倾析法转移溶液
b.转移固体至漏斗
c.使用玻璃砂漏斗
d.开大抽气装置水龙头
e.关闭抽气装置水龙头
f.断开抽气泵和吸滤瓶之间的橡皮管
g.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸
h.用蒸馏水润湿滤纸,微开水龙头,使滤纸与漏斗瓷板紧贴
(3)、Ⅱ.探究K2FeO4的性质取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2 , 设计以下方案:
①用KOH溶液充分洗涤装置C中所得固体
②再用KOH溶液将固体K2FeO4溶出,得到紫色溶液a取少量a,滴加盐酸,有Cl2产生。该方案可证明K2FeO4氧化了Cl- , ①中用KOH溶液洗涤的目的是。
(4)、资料表明,酸性溶液中的氧化性FeO>MnO。验证实验如下:将溶液a滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象可证明氧化性FeO>MnO。请说明理由。(5)、Ⅲ.K2FeO4产品纯度的测定准确称取3.00gK2FeO4样品于锥形瓶中,加入足量KOH溶液和50.00mL0.4200mol•L-1Na3AsO3溶液,充分反应后加入稀硫酸酸化,用0.1000mol•L-1KBrO3标准溶液滴定剩余的Na3AsO3溶液,恰好完全反应时消耗KBrO3标准溶液的体积为20.00mL。(K2FeO4摩尔质量为198gmol•L-1)
已知测定过程中发生的反应有:
FeO+AsO+H2O→Fe(OH)3+AsO+OH-(未配平)
AsO+BrO→AsO+Br-(未配平)
样品中K2FeO4的质量分数为(保留三位有效数字,杂质不参与化学反应)。
23. 工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3)制备镍并回收副产物黄铵铁矾[(NH4)2Fe6(SO4)4(OH)12]的工艺流程如下。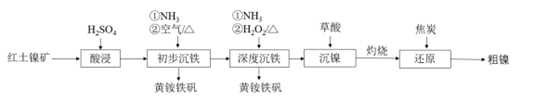 (1)、“初步沉铁”中,向酸浸后的溶液中通入NH3调节溶液的pH至1.5左右,溶液温度保持80℃左右,鼓入空气,一段时间后沉淀出黄铵铁矾。鼓入的“空气”的作用是。(2)、“深度沉铁”中,通入NH3调节溶液pH,溶液温度保持65℃左右,加入H2O2溶液,反应1h后黄铵铁矾沉淀趋于完全。
(1)、“初步沉铁”中,向酸浸后的溶液中通入NH3调节溶液的pH至1.5左右,溶液温度保持80℃左右,鼓入空气,一段时间后沉淀出黄铵铁矾。鼓入的“空气”的作用是。(2)、“深度沉铁”中,通入NH3调节溶液pH,溶液温度保持65℃左右,加入H2O2溶液,反应1h后黄铵铁矾沉淀趋于完全。①溶液中Fe3+转化为黄铵铁矾的离子方程式为。
②溶液中c(H2O2)随时间t的变化关系如图所示,反应开始10~20 min内c(H2O2)迅速减小,其原因是。
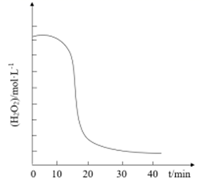 (3)、“深度沉铁”时溶液保持的温度比“初步沉铁”时溶液保持的温度低,其原因是。(4)、已知几种金属离子的氢氧化物开始沉淀和沉淀完全时的pH如下表所示(金属离子的起始浓度0.1mol·L-1)。
(3)、“深度沉铁”时溶液保持的温度比“初步沉铁”时溶液保持的温度低,其原因是。(4)、已知几种金属离子的氢氧化物开始沉淀和沉淀完全时的pH如下表所示(金属离子的起始浓度0.1mol·L-1)。金属离子的氢氧化物
Ni(OH)2
Fe(OH)3
黄铵铁矾
开始沉淀pH
7.1
2.7
1.3
沉淀完全pH
9.2
3.7
2.3
“深度沉铁”中通入NH3调节溶液pH的范围是。
24. 草酸( )及其化合物广泛分布于动植物体中。Ⅰ.某实验小组分别用水煮检验法和灼烧检验法对菠菜中的铁元素(主要以难溶的 形式存在)进行检测。实验如下:
a.水煮检验法:

b.灼烧检验法:
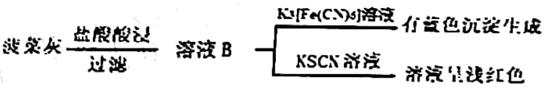 (1)、灼烧菠菜时应将其放在(填仪器名称)中加热。(2)、溶液A中未能检测出 的可能原因是;(3)、取溶液B,先滴加 溶液、再滴加 溶液。溶液呈红色;用离子方程式表示 的作用:。(4)、甲同学取少量溶液B,滴加酸性 溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有 。乙同学认为甲同学的实验方法不严谨,理由是。(5)、Ⅱ.利用草酸制备草酸亚铁晶体( )的流程及组分测定方法如下:
(1)、灼烧菠菜时应将其放在(填仪器名称)中加热。(2)、溶液A中未能检测出 的可能原因是;(3)、取溶液B,先滴加 溶液、再滴加 溶液。溶液呈红色;用离子方程式表示 的作用:。(4)、甲同学取少量溶液B,滴加酸性 溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有 。乙同学认为甲同学的实验方法不严谨,理由是。(5)、Ⅱ.利用草酸制备草酸亚铁晶体( )的流程及组分测定方法如下:
已知:几种物质的溶解度( )如下:
20℃
48
75
37
60℃
101
88
38
趁热过滤的原因是:。
(6)、氧化还原滴定法常用于测定草酸亚铁晶体的摩尔质量(M),称取ag草酸亚铁晶体置于锥形瓶中,用稀硫酸将其溶解,再用 的高锰酸钾标准液滴定,滴定时,眼睛应注视。到达滴定终点时,消耗高锰酸钾 ,则 。(已知: )25. 草酸亚铁晶体( )常用于晒制蓝图。某研究性学习小组对其进行了系列探究。(1)、I.纯净的草酸亚铁晶体热分解产物的探究气体产物成分的探究,小组成员采用如下装置(可重复选用)进行实验:

①E中盛装碱石灰的仪器名称为。
②按照气流从左到右的方向,上述装置的接口顺序为 尾气处理装置。
③实验前先通入一段时间 ,其目的是。
④实验证明气体产物中含有 ,依据的实验现象为。
(2)、 受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时, 晶体受热分解的化学方程式。 (3)、晒制蓝图时,以 溶液为显色剂,写出 与 溶液反应的化学方程式。(4)、Ⅱ.草酸亚铁晶体样品纯度的测定
(3)、晒制蓝图时,以 溶液为显色剂,写出 与 溶液反应的化学方程式。(4)、Ⅱ.草酸亚铁晶体样品纯度的测定工业制得的草酸亚铁晶体中常含有 杂质测定其纯度的步骤如下:
步骤1:称取 草酸亚铁晶体样品溶于稀 中,配成 溶液;
步骤2:取上述溶液 ,用 ,标准液滴定至终点消耗标准液 ;
步骤3:向反应后溶液中加入适量锌粉充分反应后加入适量稀 ,再用 标准液滴定至终点,消耗标准液
①步骤2中滴定终点的现象为 , 步骤3中加入锌粉的目的是。
②草酸亚铁晶体样品的纯度为(写出计算表达式)。
26. 硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是一种稳定的还原剂,常用作分析化学中的滴定剂。某课题组采用下列方案制备该晶体,并对其热稳定性进行了如下实验。(1)、Ⅰ.硫酸亚铁铵晶体的制备:铁粉 FeSO4溶液 结晶 硫酸亚铁铵晶体
硫酸浓度过大,反应过快同时会使FeSO4溶液中混有(填离子符号)。
(2)、利用FeSO4溶液与(NH4)2SO4晶体制备该晶体的化学方程式。(3)、Ⅱ.硫酸亚铁铵晶体的热分解产物探究:该小组同学选用如图所示部分装置进行实验(夹持装备略)。查阅资料:隔绝空气加热至500℃硫酸亚铁铵能完全分解,产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。
点燃A处的酒精灯之前,先打开弹簧夹,通一段时间N2 , 其目的是。
(4)、选用上述部分必要的装置完成下列相应实验,填写横线上的内容。检验可能产物
装置连接顺序
装置作用
实验现象
实验结论
H2O、NH3
ACBGD
①B的作用
②C中;
D中。
有H2O、NH3
SO2、SO3
③
④E中HCl的作用
E中没有明显现象,F中溶液褪色
⑤
(5)、为证明热分解完全后残留的固体仅为Fe2O3 , 而不含FeO或Fe3O4 , 需要选用的试剂有(选下列字母);简述利用所选试剂进行实验证明的方案。A.稀硫酸 B.稀硝酸 C.KSCN溶液 D.H2O2溶液 E.K3[Fe(CN)6]溶液
27. 一种利用H2C2O4(草酸)作助溶剂,酸浸提取硫酸烧渣(主要含Fe2O3、FeO、SiO2等)制备铁红并回收副产物硫酸铵的工艺流程如图:
已知:H2C2O4可沉淀Ca2+、Fe2+等金属离子,可与Fe3+生成[Fe(C2O4)3]3- , 在硫酸作用下可热分解生成CO和CO2。
(1)、用50%的硫酸“酸浸”时,反应液的温度、H2C2O4的加入量对铁浸取率的影响分别如图1、图2所示:
①“硫酸烧渣”中Fe2O3与H2SO4反应的化学方程式为。
②图1中,反应液的温度高于95℃时,铁浸取率开始降低,其原因是。
③图2中,H2C2O4加入量在5~20%时,铁浸取率随加入量的增大而增大,其原因是;H2C2O4加入量超过20%时,铁浸取率反而开始降低,其原因是。
(2)、“沉铁”时发生的主要反应的离子方程式为。(3)、由“过滤1”的滤渣制备铁红的“操作X”为。28. 氧化铝陶瓷常用于厚膜集成电路,制备氧化铝陶瓷的工艺流程如图所示,回答下列问题。 (1)、“氧化”步骤发生的离子方程式为: , 使用双氧水作氧化剂优点为:。(2)、“热分解”得到的产物除了氧化铝外,还有 NH3、N2、SO2、SO3、H2O 生成,则氧化 产物和还原产物的物质的量之比为。(3)、铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,“热分解”步骤中,其各温度段内受热“失重计算值( 失重计算值(%)= )如表所示:
(1)、“氧化”步骤发生的离子方程式为: , 使用双氧水作氧化剂优点为:。(2)、“热分解”得到的产物除了氧化铝外,还有 NH3、N2、SO2、SO3、H2O 生成,则氧化 产物和还原产物的物质的量之比为。(3)、铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,“热分解”步骤中,其各温度段内受热“失重计算值( 失重计算值(%)= )如表所示:温度区间(℃)
18→190
190→430
430→505
505→900
失重计算值(%)
39.20
7.80
13.00
26.00
通过上述数据经粗略计算可判断,在温度区间铵明矾基本上失去了全部结晶水。
(4)、“结晶”步骤中常采用的操作是(5)、该流程中常使用过量的工业硫酸铵,利用硫酸铵水解使溶液显酸性抑制硫酸铝水解, 这样做的目的是:。(6)、通常认为金属离子浓度等于 1×10-5mol/L 即可认为沉淀完全,试计算常温下“中和”步 骤中需要调节溶液 pH=(保留一位小数,已知:Ksp[Fe(OH)3 ]=8.0×10-38 , lg5=0.7)。29. 如图所示装置工作时均与H2有关. (1)、图1所示装置中阳极的电极反应式为 .(2)、图2所示装置中,通入H2一极的电极反应式为 .(3)、某同学按图3所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和H2 . 该结论(填“严密”或“不严密”),你的理由是(用离子方程式表示).30. 某小组同学在实验室中研究+2和+3价铁的硝酸盐的化学性质.
(1)、图1所示装置中阳极的电极反应式为 .(2)、图2所示装置中,通入H2一极的电极反应式为 .(3)、某同学按图3所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和H2 . 该结论(填“严密”或“不严密”),你的理由是(用离子方程式表示).30. 某小组同学在实验室中研究+2和+3价铁的硝酸盐的化学性质.
(1)、他们测硝酸亚铁溶液的pH常温下小于7,用离子方程式解释其原因是(2)、甲同学欲配制硝酸亚铁溶液,为防止水解,称量一定量硝酸亚铁晶体溶于pH=1的稀硝酸中,溶液呈深棕色,液面上方有红棕色气体,放置一段时间,溶液最终呈黄色.(已知:Fe2+能与NO结合形成深棕色的[Fe(NO)]2+:Fe2++NO⇌〔Fe(NO)]2+)
①液面上方红棕色气体是
②经检验黄色溶液中有Fe3+ . 检验Fe3+的操作是
③最初溶液中生成[Fe(NO)]2+使溶液呈深棕色,最终溶液变黄色的原因是
(3)、操作步骤及现象
i:往溶液中缓慢通入SO2 , 液面上方有红棕色气体,溶液黄色无明显变化
ii:继续通入足量的SO2 , 溶液变为深棕色,一段时间后,溶液变为浅绿色
31. 在常温下,与水并不起反应,但在高温下,与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原性铁粉和棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“与水蒸气的反应实验”。请回答下列问题: (1)、仪器A的作用是。(2)、硬质玻璃管B中发生反应的化学方程式为。(3)、实验中先点燃酒精灯a再点燃酒精喷灯,可能的原因是。(4)、无水硫酸铜粉末变蓝色,黑色氧化铜变红说明铁跟水蒸气反应生成的气体为(填化学式)。(5)、某同学利用反应后的固体物质进行如下实验:
(1)、仪器A的作用是。(2)、硬质玻璃管B中发生反应的化学方程式为。(3)、实验中先点燃酒精灯a再点燃酒精喷灯,可能的原因是。(4)、无水硫酸铜粉末变蓝色,黑色氧化铜变红说明铁跟水蒸气反应生成的气体为(填化学式)。(5)、某同学利用反应后的固体物质进行如下实验:
①某同学发现实验中加入过量新制氯水,放置一段时间后,深红色会逐渐褪去,褪色后的溶液中继续滴加溶液,又出现红色,则褪色的原因可能是。
②该同学想用高锰酸钾酸性溶液检验淡黄色溶液中是否含有离子,写出检验反应的离子方程式。
③该同学想用淡黄色溶液制溶液,可加入过量的 , 写出该反应离子反应方程式。
(6)、以物质的类别为横坐标,化合价为纵坐标绘制的图象叫价类图。如下图是铁的价类图,Y物质为 , 写出Y在潮湿的空气中转化为图中同类别物质的化学方程式。 32. 甲、乙同学对及其化合物的相关性质与用途进行探究。
32. 甲、乙同学对及其化合物的相关性质与用途进行探究。 (1)、实验I:甲、乙两同学分别用下图装置进行粉与水蒸气反应的实验。
(1)、实验I:甲、乙两同学分别用下图装置进行粉与水蒸气反应的实验。①证明生成的气体是氢气,依据的现象是。
②该反应的化学方程式是。
(2)、实验Ⅱ:甲、乙同学分别对各自实验Ⅰ反应后的黑色固体进行研究。冷却后取试管A中的固体加入过量稀 , 充分反应后将溶液分成两份,进行如下操作。已知:操作过程
现象及结论
甲同学
乙同学

试管B中固体全部溶解,得到溶液M
试管B固体全部溶解,同时有大量气泡产生,得到溶液N
试管C溶液变红
试管C溶液没有变红,用离子方程式解释原因:。
若试管D开始有红褐色和灰绿色沉淀生成,最终全部变为红褐色。则溶液M中存在的阳离子有:。
试管D实验现象是;产生该现象发生的氧化还原反应的化学方程式:。
(3)、查阅资料:认识的重要用途。资料:纳米级可用于以太阳光为热源分解水制 , 过程如下图所示。下列说法中正确的是____。 A、过程I的反应: B、过程Ⅱ的反应: C、过程I和过程Ⅱ都发生了氧化还原反应 D、纳米级在光解水制过程中起催化作用33. 某小组同学分别探究FeCl2溶液、FeCl3溶液的性质。(1)、I.探究FeCl2溶液的性质。
A、过程I的反应: B、过程Ⅱ的反应: C、过程I和过程Ⅱ都发生了氧化还原反应 D、纳米级在光解水制过程中起催化作用33. 某小组同学分别探究FeCl2溶液、FeCl3溶液的性质。(1)、I.探究FeCl2溶液的性质。从物质类别角度判断FeCl2属于 ,因此可以与某些碱反应。
(2)、预测FeCl2具有氧化性,因此可以与Zn反应,此时Zn体现性。(3)、预测FeCl2具有还原性,预测依据是 , 因此可以与酸性KMnO4溶液反应。(4)、进行如下实验操作:
序号
操作
i
滴加NaOH溶液
ii
加入少量锌粉
iii
滴加酸性KMnO4溶液
①i中的现象是 , 用化学方程式表示产生该现象的原因:、。
②ii中反应的离子方程式是。
③iii中的现象是。
(5)、某同学认为iii中现象并不能证明Fe2+具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象、② , 为证实该反应中Fe2+确实被氧化,需要在反应后的溶液中加入试剂 , 观察到现象。(6)、II.探究FeCl3溶液的性质。小组同学进行如下实验操作并观察到对应现象:
操作



现象
溶液由棕黄色变为浅绿色
无明显现象
溶液变为红色, 而后红色褪去
iv中反应的离子方程式是。
(7)、vi 中滴加氯水过程中,氯水反应的离子方程式是。(8)、III.小组同学探究vi中褪色原因,提出两种假设: a.铁离子被转化,b. SCN被转化。分别向褪色后的溶液中滴加0.1 mol/L FeCl3溶液和KSCN溶液各1滴,观察到现象,得出结论:假设b成立。
(9)、进一步预测SCN-可能被转化为SO , 通过实验验证了该预测,写出实验操作及现象。34. 某兴趣小组用如下实验探究、的性质。回答下列问题:(1)、分别取一定量、固体,均配制成的溶液。①除图中已有的仪器外,配制过程中还缺少的一种玻璃仪器是。

②若在定容时俯视,所得溶液的浓度将(填“偏大”或“偏小”或“不变”)。
③得到的溶液中要加入还原铁粉,其目的是。(用离子方程式表示)
(2)、甲同学取溶液,滴入几滴氯水和1滴KSCN溶液,溶液变红。说明可将氧化,写出与反应的化学方程式。(3)、乙同学认为甲的实验不够严谨,应在溶液中先加入0.5mL煤油,再于煤油液面下依次加入几滴氯水和1滴KSCN溶液。则该实验中煤油的作用是。(4)、丙同学取2mL配制的溶液,向其中加入溶液,充分振荡后将所得溶液分为两等份进行如下实验:①向第一份溶液中加几滴淀粉溶液,观察到溶液变蓝,说明有(填化学式)生成;
②向第二份溶液中加几滴铁氰化钾溶液,生成蓝色沉淀,说明有生成。
结合①②可知该反应的离子方程式为。
(5)、丁同学向盛有溶液的试管中加入几滴酸化的溶液,溶液变黄,将反应的离子方程式补充完整_=__。
发现一段时间后有能使带火星木条复燃的无色气体产生,则在该反应过程起的作用是。
35. 铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。(1)、工业上用溶液腐蚀铜来制作印刷电路板,写出该化学反应的离子方程式。(2)、现配制溶液,配制过程中除量筒、胶头滴管、烧杯外,还需要的玻璃仪器是。(3)、将已配制好的溶液滴入沸水中并煮沸一段时间,可得到红褐色液体,则此液体具有的性质是(填字母)。a.光通过该液体时形成光亮的“通路”
b.向该液体中加入溶液,无沉淀产生
c.将该液体进行过滤,可得到红褐色固体
d.该液体中分散质粒子直径在1~100nm之间
(4)、以铝土矿、硫铁矿烧渣为配料(主要成分为、 , 含少量、等)制备无机高分子絮凝剂聚合碱式氯化铝铁的流程如图。
①“滤渣1”的主要成分为(填化学式),为检验“过滤1”后的溶液中是否含有 , 可选用的化学试剂是。
②步骤Ⅳ加入双氧水的目的是 , 发生反应的离子方程式为。
③测定聚合碱式氯化铝铁|可表示为中的比值的步骤如下:
步骤1:准确称取产品5.710g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.350g固体。
步骤2:另准确称取相同质量样品,溶于足量溶液讨滤,充分洗涤,将滤渣灼烧全质量不再变化,得到固体0.800g。则产品中(填最简整数比)。
-