高考二轮复习知识点:中和滴定1
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 一定条件下,乙酸酐醇解反应可进行完全,利用此反应定量测定有机醇中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入样品,充分反应后,加适量水使剩余乙酸酐完全水解:。
③加指示剂并用甲醇标准溶液滴定至终点,消耗标准溶液。
④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用-甲醇标准溶液滴定至终点,消耗标准溶液。根据上述实验原理,下列说法正确的是
A、可以用乙酸代替乙酸酐进行上述实验 B、若因甲醇挥发造成标准溶液浓度发生变化,将导致测定结果偏小 C、步骤③滴定时,不慎将锥形瓶内溶液溅出,将导致测定结果偏小 D、步骤④中,若加水量不足,将导致测定结果偏大2. 一定条件下,乙酸酐醇解反应可进行完全,利用此反应定量测定有机醇中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入样品,充分反应后,加适量水使剩余乙酸酐完全水解:。
③加指示剂并用甲醇标准溶液滴定至终点,消耗标准溶液。
④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用甲醇标准溶液滴定至终点,消耗标准溶液。对于上述实验,下列做法正确的是
A、进行容量瓶检漏时,倒置一次即可 B、滴入半滴标准溶液,锥形瓶中溶液变色,即可判定达滴定终点 C、滴定读数时,应单手持滴定管上端并保持其自然垂直 D、滴定读数时,应双手一上一下持滴定管3. 常温下,用浓度为的标准溶液滴定浓度均为的和的混合溶液,滴定过程中溶液的随()的变化曲线如图所示。下列说法错误的是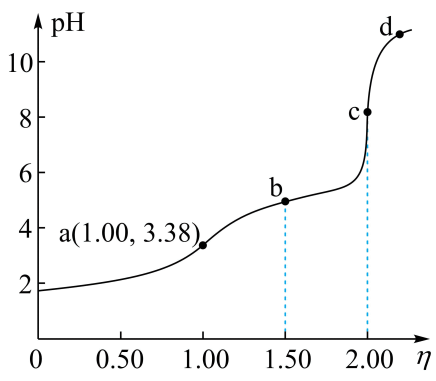 A、约为 B、点a: C、点b: D、水的电离程度:4. 某水样中含一定浓度的CO、HCO和其他不与酸碱反应的离子。取10.00mL水样,用0.01000mol•L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。
A、约为 B、点a: C、点b: D、水的电离程度:4. 某水样中含一定浓度的CO、HCO和其他不与酸碱反应的离子。取10.00mL水样,用0.01000mol•L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。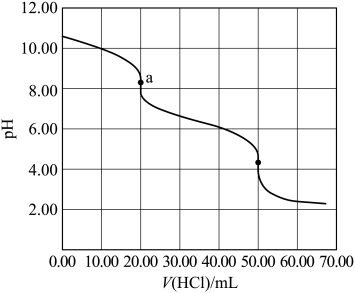
下列说法正确的是( )
A、该水样中c(CO)=0.01mol•L-1 B、a点处c(H2CO3)+c(H+)=c(OH-) C、当V(HCl)≤20.00mL时,溶液中c(HCO)基本保持不变 D、曲线上任意一点存在c(CO)+c(HCO)+c(H2CO3)=0.03mol•L-15. 常温下,向浓度为0.01mol·L-1的H3AsO3溶液中滴加NaOH溶液,溶液中含砷微粒的物质的量分数与溶液pH的关系如图所示。关于该过程的说法错误的是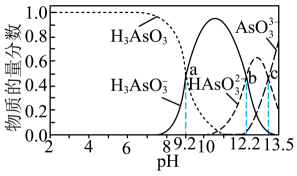 A、pH为7.35~7.45的溶液中含砷元素的主要微粒是H3AsO3 B、Ka1(H3AsO3)的数量级是10-10 C、当pH=13时,溶液中的=-0.8 D、c点,c(Na+)>c()+3c()+2c()6. 25 ℃时,将HCl气体缓慢通入0.10 mol·L-1的氨水中,溶液的pH、体系中粒子浓度的对数值(lgc)与反应物的物质的量之比的关系如图所示。若忽略溶液体积变化,下列有关说法错误的是
A、pH为7.35~7.45的溶液中含砷元素的主要微粒是H3AsO3 B、Ka1(H3AsO3)的数量级是10-10 C、当pH=13时,溶液中的=-0.8 D、c点,c(Na+)>c()+3c()+2c()6. 25 ℃时,将HCl气体缓慢通入0.10 mol·L-1的氨水中,溶液的pH、体系中粒子浓度的对数值(lgc)与反应物的物质的量之比的关系如图所示。若忽略溶液体积变化,下列有关说法错误的是 A、25 ° C时, NH3·H2O的电离平衡常数为10-4.75 B、P1所示溶液:c(Cl-) < 0.05 mol·L-1 C、P2所示溶液:c()= 100c( NH3·H2O ) D、P3所示溶液:c(Cl- )>c() >c(H+)>c(OH-)7. 室温下,用标准液0.01mol·L-1NaOH溶液滴定20.00mL0.01mol·L-1H2C2O4(二元弱酸)溶液,在滴定过程中有关说法正确的是A、当标准液滴到10.00mL时,溶液中存在[Na+]=[] B、滴定终点时,水电离的氢离子浓度为10-7mol·L-1 C、pH=2的H2C2O4溶液中水电离的[H+]大于0.01mol·L-1NaOH溶液中水电离的[H+] D、滴定过程中始终存在[Na+]+[H+]=[]+2[]+[OH-]8. 常温下用的HCl溶液滴定同浓度20.00mL某一元碱MOH溶液并绘制滴定曲线如图所示。下列说法正确的是( )
A、25 ° C时, NH3·H2O的电离平衡常数为10-4.75 B、P1所示溶液:c(Cl-) < 0.05 mol·L-1 C、P2所示溶液:c()= 100c( NH3·H2O ) D、P3所示溶液:c(Cl- )>c() >c(H+)>c(OH-)7. 室温下,用标准液0.01mol·L-1NaOH溶液滴定20.00mL0.01mol·L-1H2C2O4(二元弱酸)溶液,在滴定过程中有关说法正确的是A、当标准液滴到10.00mL时,溶液中存在[Na+]=[] B、滴定终点时,水电离的氢离子浓度为10-7mol·L-1 C、pH=2的H2C2O4溶液中水电离的[H+]大于0.01mol·L-1NaOH溶液中水电离的[H+] D、滴定过程中始终存在[Na+]+[H+]=[]+2[]+[OH-]8. 常温下用的HCl溶液滴定同浓度20.00mL某一元碱MOH溶液并绘制滴定曲线如图所示。下列说法正确的是( ) A、水的电离程度:X>Y>Z B、X点: C、Y点: D、对Z点溶液加热,一定增大9. 向的溶液中逐滴滴加等浓度的NaOH溶液,所得溶液中、、三种微粒的物质的量分数()与溶液pH的关系如图a所示;向的草酸钠溶液中逐滴滴加等浓度的溶液,形成的与变化如图b所示。下列有关说法中错误的是(已知)
A、水的电离程度:X>Y>Z B、X点: C、Y点: D、对Z点溶液加热,一定增大9. 向的溶液中逐滴滴加等浓度的NaOH溶液,所得溶液中、、三种微粒的物质的量分数()与溶液pH的关系如图a所示;向的草酸钠溶液中逐滴滴加等浓度的溶液,形成的与变化如图b所示。下列有关说法中错误的是(已知) A、图b中当溶液时, B、向草酸钠溶液中加入等体积溶液后,溶液中为 C、的溶液的pH>2.5 D、向的溶液中逐滴滴加等浓度的溶液,所得溶液中、、三种微粒的物质的量分数()与溶液pH的关系与图a相同10. 向的溶液中逐滴滴加等浓度的NaOH溶液,所得溶液中、、三种微粒的物质的量分数()与溶液pH的关系如图a所示;向的草酸钠溶液中逐滴滴加等浓度的溶液,形成的与变化如图b所示。下列有关说法中错误的是(已知)
A、图b中当溶液时, B、向草酸钠溶液中加入等体积溶液后,溶液中为 C、的溶液的pH>2.5 D、向的溶液中逐滴滴加等浓度的溶液,所得溶液中、、三种微粒的物质的量分数()与溶液pH的关系与图a相同10. 向的溶液中逐滴滴加等浓度的NaOH溶液,所得溶液中、、三种微粒的物质的量分数()与溶液pH的关系如图a所示;向的草酸钠溶液中逐滴滴加等浓度的溶液,形成的与变化如图b所示。下列有关说法中错误的是(已知) A、向的溶液中逐滴滴加等浓度的溶液,所得溶液中、、三种微粒的物质的量分数()与溶液pH的关系与图a相同 B、的溶液的 C、向草酸钠溶液中加入等体积溶液后,溶液中为 D、图b中当溶液时,11. 常温下,将NaOH溶液滴加到20mL等浓度的某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如下图所示[已知:p=-lg]。下列叙述错误的是
A、向的溶液中逐滴滴加等浓度的溶液,所得溶液中、、三种微粒的物质的量分数()与溶液pH的关系与图a相同 B、的溶液的 C、向草酸钠溶液中加入等体积溶液后,溶液中为 D、图b中当溶液时,11. 常温下,将NaOH溶液滴加到20mL等浓度的某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如下图所示[已知:p=-lg]。下列叙述错误的是 A、m点对应的NaOH溶液体积小于10 mL B、Ka(HA)为10-4.76 C、l点所示溶液中:c(Na+)<c(A-)+c(HA) D、各点水的电离程度关系:n>m>l12. 常温下,用0.10mol/LNaOH溶液分别滴定20.00mL浓度均为0.10mol/L的CH3COOH溶液和HCN溶液所得滴定曲线如图所示。下列说法正确的是
A、m点对应的NaOH溶液体积小于10 mL B、Ka(HA)为10-4.76 C、l点所示溶液中:c(Na+)<c(A-)+c(HA) D、各点水的电离程度关系:n>m>l12. 常温下,用0.10mol/LNaOH溶液分别滴定20.00mL浓度均为0.10mol/L的CH3COOH溶液和HCN溶液所得滴定曲线如图所示。下列说法正确的是 A、两种一元弱酸的电离常数: B、溶液中水的电离程度:③>②>① C、时, D、滴定时均可选用甲基橙作指示剂,指示滴定终点13. 已知丙二酸(HOOCCH2COOH,简记为H2A)是二元弱酸。常温下,向20.0 mL0.1 mol·L-1丙二酸溶液中滴加同浓度的NaOH溶液V mL,体系中含碳粒子的物质的量分布系数(δ)与pH的关系如图所示。已知:丙二酸在体系中物质的量分布系数为δ(H2A)= 。
A、两种一元弱酸的电离常数: B、溶液中水的电离程度:③>②>① C、时, D、滴定时均可选用甲基橙作指示剂,指示滴定终点13. 已知丙二酸(HOOCCH2COOH,简记为H2A)是二元弱酸。常温下,向20.0 mL0.1 mol·L-1丙二酸溶液中滴加同浓度的NaOH溶液V mL,体系中含碳粒子的物质的量分布系数(δ)与pH的关系如图所示。已知:丙二酸在体系中物质的量分布系数为δ(H2A)= 。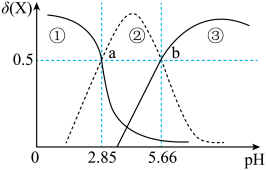
下列叙述正确的是
A、V=20.0时,c(HA-)>c(H2A)>c(A2- ) B、b点对应的溶液温度为滴定过程中的最高值 C、V=40.0时,c(H2A)+c(HA- )+c(A2-)=0.1 mol ·L-1 D、常温下,H2A+A2-2HA-的平衡常数K= 102.8114. 测定食醋中总酸度有以下步骤:①将食醋精确稀释到原来的10倍;②用烧碱固体配制100mL浓度约为0.1mol•L-1的溶液;③用邻苯二甲酸氢钾固体标定步骤②所得溶液;④用移液管取20.00mL待测液;⑤用已知浓度NaOH溶液滴定。以下对应步骤中的操作及选用仪器正确的是A、 步骤①
B、
步骤①
B、 步骤②
C、
步骤②
C、 步骤③
D、
步骤③
D、 步骤⑤
15. 常温下,向的二元酸溶液中逐滴加入等浓度的溶液,溶液的与离子浓度变化的关系如图所示,下列说法正确的是
步骤⑤
15. 常温下,向的二元酸溶液中逐滴加入等浓度的溶液,溶液的与离子浓度变化的关系如图所示,下列说法正确的是 A、曲线I表示与的关系 B、滴入溶液至中性: C、的平衡常数 D、时,混合溶液呈碱性16. 25℃时,用溶液滴定某二元弱酸 , 滴定过程中溶液的pH及、、的物质的量浓度变化如图所示,下列说法错误的是
A、曲线I表示与的关系 B、滴入溶液至中性: C、的平衡常数 D、时,混合溶液呈碱性16. 25℃时,用溶液滴定某二元弱酸 , 滴定过程中溶液的pH及、、的物质的量浓度变化如图所示,下列说法错误的是 A、的 B、Y点: C、X点、Z点水的电离程度:Z>X D、当时,17. 常温下,向一元弱碱BOH溶液中滴加一元强酸稀溶液,已知在一元弱碱BOH溶液中存在: c(BOH) +c(B+) =0.1 mol·L-1 , 溶液中c( BOH)和c(B+)的负对数pc的大小与pOH[ pOH= - lge( OH-)]的关系如图所示。下列有关叙述错误的是( )
A、的 B、Y点: C、X点、Z点水的电离程度:Z>X D、当时,17. 常温下,向一元弱碱BOH溶液中滴加一元强酸稀溶液,已知在一元弱碱BOH溶液中存在: c(BOH) +c(B+) =0.1 mol·L-1 , 溶液中c( BOH)和c(B+)的负对数pc的大小与pOH[ pOH= - lge( OH-)]的关系如图所示。下列有关叙述错误的是( ) A、常温下,当溶液的pOH =5.75时,溶液的pH =8.25 B、常温下,一元弱碱BOH的电离平衡常数约为10-5 C、a点对应的溶液中,一元弱碱BOH的电离程度大于B+的水解程度 D、当溶液的pOH =5.75时,c(OH-) <c (H+)< c(B+) <c( BOH)18. 常温下,向25.00mL0.1mol/LNaOH溶液中逐滴加入0.1mol/LHA,溶液的pH随加入的HA溶液体积的变化曲线如图所示(HA是一种弱酸,溶液混合后体积的变化忽略不计),下列说法正确的是( )
A、常温下,当溶液的pOH =5.75时,溶液的pH =8.25 B、常温下,一元弱碱BOH的电离平衡常数约为10-5 C、a点对应的溶液中,一元弱碱BOH的电离程度大于B+的水解程度 D、当溶液的pOH =5.75时,c(OH-) <c (H+)< c(B+) <c( BOH)18. 常温下,向25.00mL0.1mol/LNaOH溶液中逐滴加入0.1mol/LHA,溶液的pH随加入的HA溶液体积的变化曲线如图所示(HA是一种弱酸,溶液混合后体积的变化忽略不计),下列说法正确的是( ) A、由水电离产生H+的浓度c(H+): A>B B、溶液中存在:c(H+)+c(Na+) =c(OH-)+c(A-) C、从A到C,都存在:c(Na+)>c(A-)>c(OH-)>c(H+) D、在D点:c(Na+)=2c(HA)+2c(A-)19. 室温下,分别用0.1000mol•L-1的NaOH标准液滴定浓度均为0.1mol•L-1的三种酸HX、HY、和HZ,滴定曲线如图所示,下列说法错误的是
A、由水电离产生H+的浓度c(H+): A>B B、溶液中存在:c(H+)+c(Na+) =c(OH-)+c(A-) C、从A到C,都存在:c(Na+)>c(A-)>c(OH-)>c(H+) D、在D点:c(Na+)=2c(HA)+2c(A-)19. 室温下,分别用0.1000mol•L-1的NaOH标准液滴定浓度均为0.1mol•L-1的三种酸HX、HY、和HZ,滴定曲线如图所示,下列说法错误的是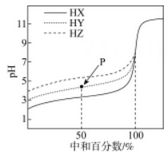 A、三种酸的酸性强弱:HX>HY>HZ B、等浓度、等体积的HY溶液和NaY溶液混合,混合液显酸性 C、用NaOH标准液滴定HZ溶液时,选用酚酞作指示剂 D、滴定HX的曲线中,当中和百分数为50%时,溶液中存在c(X-)<c(Na+)20. 25℃时,取浓度均为0.1 mol·L−1的醋酸溶液和氨水各20 mL,分别用0.1 mol·L−1 氢氧化钠溶液和0.1 mol·L−1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是
A、三种酸的酸性强弱:HX>HY>HZ B、等浓度、等体积的HY溶液和NaY溶液混合,混合液显酸性 C、用NaOH标准液滴定HZ溶液时,选用酚酞作指示剂 D、滴定HX的曲线中,当中和百分数为50%时,溶液中存在c(X-)<c(Na+)20. 25℃时,取浓度均为0.1 mol·L−1的醋酸溶液和氨水各20 mL,分别用0.1 mol·L−1 氢氧化钠溶液和0.1 mol·L−1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是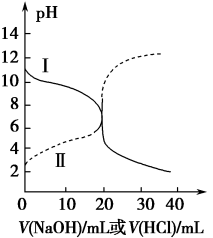 A、曲线I,滴加10 mL溶液时:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O) B、曲线I,滴加20 mL溶液时:两溶液恰好完全反应,此时溶液的pH<7 C、曲线II,滴加溶液体积在10~20 mL之间时存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) D、曲线II,滴加30 mL溶液时:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)21. 常温时,采用甲基橙和酚酞双指示剂,用盐酸滴定Na2CO3溶液,溶液中lgc(H2CO3)、lgc(HCO)、lgc(H+)、lgc(OH-)随溶液pH的变化及滴定曲线如图所示,下列说法错误的是( )
A、曲线I,滴加10 mL溶液时:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O) B、曲线I,滴加20 mL溶液时:两溶液恰好完全反应,此时溶液的pH<7 C、曲线II,滴加溶液体积在10~20 mL之间时存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) D、曲线II,滴加30 mL溶液时:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)21. 常温时,采用甲基橙和酚酞双指示剂,用盐酸滴定Na2CO3溶液,溶液中lgc(H2CO3)、lgc(HCO)、lgc(H+)、lgc(OH-)随溶液pH的变化及滴定曲线如图所示,下列说法错误的是( ) A、整个滴定过程中可先用酚酞再用甲基橙作指示剂 B、n点的pH为m点和q点pH的平均值 C、r点溶液中c(OH-)=c(H+)+c(HCO)+2c(H2CO3) D、r点到k点对应的变化过程中,溶液中水的电离程度先减小后增大22. 已知pOH=-lgc(OH-)。向20mL0.1mol·L-1的氨水中滴加未知浓度的稀H2SO4测得混合溶液的温度、pOH随加入稀硫酸体积的变化如下图所示,下列说法错误的是( )
A、整个滴定过程中可先用酚酞再用甲基橙作指示剂 B、n点的pH为m点和q点pH的平均值 C、r点溶液中c(OH-)=c(H+)+c(HCO)+2c(H2CO3) D、r点到k点对应的变化过程中,溶液中水的电离程度先减小后增大22. 已知pOH=-lgc(OH-)。向20mL0.1mol·L-1的氨水中滴加未知浓度的稀H2SO4测得混合溶液的温度、pOH随加入稀硫酸体积的变化如下图所示,下列说法错误的是( ) A、a点时溶液中存在:c(NH3·H2O)+2c(OH-)=c()+2c(H+) B、a、b、c三点对应的水解平衡常数:Kh(b)>Kh(a)>Kh(c) C、当溶液中pH=pOH时,水的电离程度最大 D、稀H2SO4的物质的量浓度为0.05mol·L-1
A、a点时溶液中存在:c(NH3·H2O)+2c(OH-)=c()+2c(H+) B、a、b、c三点对应的水解平衡常数:Kh(b)>Kh(a)>Kh(c) C、当溶液中pH=pOH时,水的电离程度最大 D、稀H2SO4的物质的量浓度为0.05mol·L-1二、多选题
-
23. 常温下,用NaOH溶液滴定H3PO3溶液(已知H3PO3为二元弱酸),溶液中pc(H2PO)和-lg或pc(HPO)和-lg的关系如图所示。(已知pc=-lgc)。下列说法正确的是
 A、L2表示pc(HPO)和-lg的关系 B、H3PO3的电离常数Ka2(H3PO3)的数量级为10-6 C、等浓度等体积的H3PO3溶液与NaOH溶液充分混合,c(HPO)>c(H3PO3) D、c(H3PO3)=c(HPO)时,溶液显碱性24. 常温下,向一定浓度溶液中加入KOH固体,保持溶液体积和温度不变,测得pH与[X为、、]的变化关系如图所示。下列说法正确的是
A、L2表示pc(HPO)和-lg的关系 B、H3PO3的电离常数Ka2(H3PO3)的数量级为10-6 C、等浓度等体积的H3PO3溶液与NaOH溶液充分混合,c(HPO)>c(H3PO3) D、c(H3PO3)=c(HPO)时,溶液显碱性24. 常温下,向一定浓度溶液中加入KOH固体,保持溶液体积和温度不变,测得pH与[X为、、]的变化关系如图所示。下列说法正确的是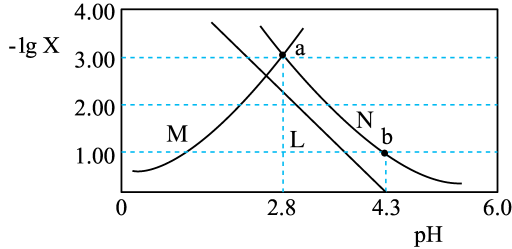 A、曲线M表示 B、常温下, C、a点溶液中: D、b点溶液中:
A、曲线M表示 B、常温下, C、a点溶液中: D、b点溶液中:三、非选择题
-
25. 作为绿色氧化剂应用广泛,氢醌法制备原理及装置如下:

已知:、等杂质易使催化剂中毒。回答下列问题:
(1)、A中反应的离子方程式为。(2)、装置B应为(填序号)。 (3)、检查装置气密性并加入药品,所有活塞处于关闭状态。开始制备时,打开活塞 , 控温。一段时间后,仅保持活塞b打开,抽出残留气体。随后关闭活塞b,打开活塞 , 继续反应一段时间。关闭电源和活塞,过滤三颈烧瓶中混合物,加水萃取,分液,减压蒸馏,得产品。(4)、装置F的作用为。(5)、反应过程中,控温的原因为。(6)、氢醌法制备总反应的化学方程式为。(7)、取产品,加蒸馏水定容至摇匀,取于锥形瓶中,用酸性标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为、、。假设其他杂质不干扰结果,产品中质量分数为。26. 在两个相同的特制容器中分别加入20 mL 0.4 mol⋅L的溶液和40 mL 0.2 mol⋅L的溶液,再分别用0.4 mol⋅L的盐酸滴定,利用pH计和压力传感器检测,得到如下曲线。下列说法正确的是
(3)、检查装置气密性并加入药品,所有活塞处于关闭状态。开始制备时,打开活塞 , 控温。一段时间后,仅保持活塞b打开,抽出残留气体。随后关闭活塞b,打开活塞 , 继续反应一段时间。关闭电源和活塞,过滤三颈烧瓶中混合物,加水萃取,分液,减压蒸馏,得产品。(4)、装置F的作用为。(5)、反应过程中,控温的原因为。(6)、氢醌法制备总反应的化学方程式为。(7)、取产品,加蒸馏水定容至摇匀,取于锥形瓶中,用酸性标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为、、。假设其他杂质不干扰结果,产品中质量分数为。26. 在两个相同的特制容器中分别加入20 mL 0.4 mol⋅L的溶液和40 mL 0.2 mol⋅L的溶液,再分别用0.4 mol⋅L的盐酸滴定,利用pH计和压力传感器检测,得到如下曲线。下列说法正确的是
A.图中乙、丙线表示向溶液中滴加盐酸
B.根据图分析,d点可用甲基橙作指示剂指示滴定终点
C.溶液和溶液中均满足
D.当滴加盐酸的体积为 mL时,a点所发生反应的离子方程式为
(1)、装置乙的作用是。(2)、装置丙中制备次氯酸钠为放热反应,该反应需要控制温度在40℃以下,写出一种(除搅拌外)控制该反应温度的操作方法。(3)、Ⅱ.探究相关性质为了进一步研究消毒液的性质,兴趣小组向盛有2 mL 84消毒液的试管中,逐滴加入10%的双氧水,发现有大量的气泡产生,对此作出以下猜测。
猜测1:双氧水与消毒液发生反应产生氧气。猜测2:……
猜测1中反应的化学方程式为。猜测2可能为。
(4)、为了验证猜想,某探究小组设计用如图装置进行实验,所选药品有:10%的双氧水、一定浓度的84消毒液、二氧化锰等。该小组通过实验得出猜测1正确,请依据此装置和所给的药品推测该探究小组的实验设计是。 27. 重铬酸钾作为实验室重要的基准物质,通常用来标定某些物质的浓度。实验室模拟固体碱熔氧化法制备K2Cr2O7步骤如下:
27. 重铬酸钾作为实验室重要的基准物质,通常用来标定某些物质的浓度。实验室模拟固体碱熔氧化法制备K2Cr2O7步骤如下:I、制备阶段
①氧化焙烧:在熔融碱中,用强氧化剂氯酸钾氧化Cr2O3 , 得到易溶于水的铬酸盐;
②熔块提取:用水浸取熔体,过滤,将滤液酸化;
③复分解结晶:向酸化后的滤液中加入细小KCl晶体,抽滤、干燥、得粗产品重铬酸钾。
II、纯度分析
称取1.000g的粗产品,配制成100mL溶液,取25.00mL用硫酸酸化,加入适量KI和指示剂,用Na2S2O3标准溶液滴定至亮绿色。
回答下列问题:
(1)、在氧化焙烧时,用进行熔融(填仪器名称),下列仪器在纯度分析中用不到的是(填序号)。 (2)、步骤①中使用的碱为苛性钠,写出该步反应的化学方程式。(3)、步骤②中加入强酸酸化的目的是。(4)、步骤③中加入细小KCl晶体能得到重铬酸钾,原理为2KCl+Na2Cr2O7=2NaCl+K2Cr2O7该反应能发生的原因是。(5)、纯度分析中选择的指示剂是 , 写出酸性重铬酸钾与KI反应的离子方程式。滴定原理是I2+2=2I-+ , 若滴定终点消耗0.2000mol/LNa2S2O3标准溶液22.50mL,则该产品纯度为%(保留两位小数)。28. 三氯化铬是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室可利用下面装置模拟制取三氯化铬(、为气流控制开关)。
(2)、步骤①中使用的碱为苛性钠,写出该步反应的化学方程式。(3)、步骤②中加入强酸酸化的目的是。(4)、步骤③中加入细小KCl晶体能得到重铬酸钾,原理为2KCl+Na2Cr2O7=2NaCl+K2Cr2O7该反应能发生的原因是。(5)、纯度分析中选择的指示剂是 , 写出酸性重铬酸钾与KI反应的离子方程式。滴定原理是I2+2=2I-+ , 若滴定终点消耗0.2000mol/LNa2S2O3标准溶液22.50mL,则该产品纯度为%(保留两位小数)。28. 三氯化铬是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室可利用下面装置模拟制取三氯化铬(、为气流控制开关)。
原理:
已知:气体有毒,遇水发生水解产生两种酸性气体
(1)、实验装置合理的连接顺序为a—(填仪器接口字母标号)。(2)、步骤如下:i.连接装置,检查装置气密性,装入药品并通;
ii.加热反应管至400℃;
iii.控制开关,加热 , 温度保持在50℃~60℃之间;
iv.加热石英管继续升温至650℃,直到E中反应基本完成,切断管式炉的电源;
v.停止A装置水浴加热,……;
vi.装置冷却后,结束制备实验。
①步骤i中,开关、的状态分别为。
②补全步骤v的操作: , 其目的是。
(3)、从安全的角度考虑,整套装置的不足是。(4)、装置D中反应的离子方程式为。(5)、取三氯化铬样品0.300g,配制成250mL溶液。移取25.00mL于碘量瓶中,加热至沸腾后,加适量溶液,生成绿色沉淀。冷却后,加足量30% , 小火加热至绿色沉淀完全溶解。冷却后,加入酸化,再加入足量KI溶液,加塞摇匀充分反应后,铬元素只以存在,暗处静置5min后,加入指示剂,用标准溶液滴定至终点,消耗标准溶液21.00mL(杂质不参加反应)。
已知:;
①绿色沉淀完全溶解后,继续加热一段时间再进行后续操作,目的是。
②样品中无水三氯化铬的质量分数为(结果保留三位有效数字)。
③若将碘量瓶换为锥形瓶,则样品中无水三氯化铬质量分数的测量结果(填“偏高”、“偏低”或“无影响”)。
29. 四氯化钛( , 熔点:-25℃,沸点:136 ℃)是制备海绵钛和钛白的主要原料,其实验室制备原理是 , 某同学利用如下装置制备并验证产物CO。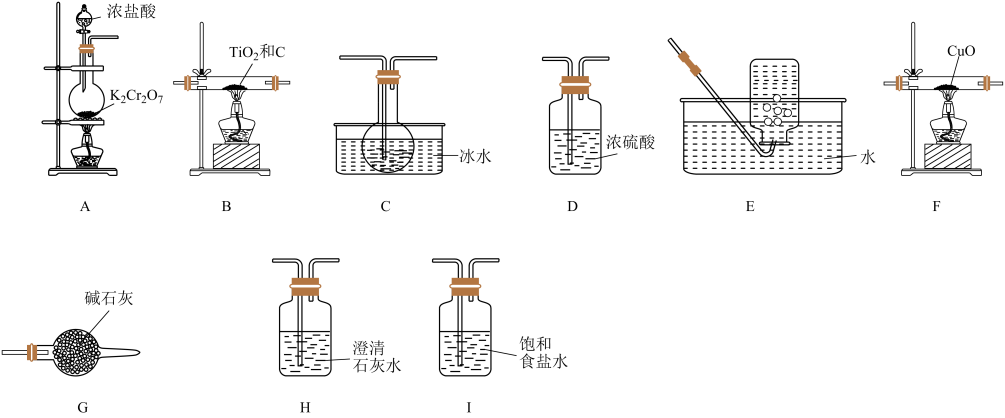
已知:遇潮湿空气会发生反应:。
回答下列问题:
(1)、写出装置A中制备的化学反应方程式(注:反应中被还原为)。(2)、按气流方向从左至右,上述装置的连接顺序为A, , G,F,H,E。(3)、装置A中盛放浓盐酸的仪器名称为 , 装置G中盛放的碱石灰的作用是。(4)、能证明有CO生成的实验现象是。(5)、产品中含量测定:取10.0 g 产品于烧瓶中,向安全漏斗(如下图所示)中加入足量蒸馏水后,立即夹紧弹簧夹,充分反应后将安全漏斗及烧瓶中混合物中液体转移到容量瓶中配成500 mL溶液,取20 mL所配溶液放入锥形瓶中,滴加几滴的溶液作指示剂,用的溶液滴定至终点,消耗溶液32.00 mL。已知:是一种深红色固体;常温下, , 。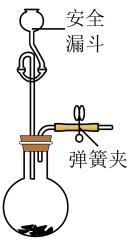
①安全漏斗中的水在本实验中的作用除加水外,还有;
②该沉淀滴定终点的判断方法是;
③该产品纯度为%。
30. 二氯异氰尿酸钠(NaC3N3O3Cl2 , 摩尔质量为220g/mol)是一种高效广谱杀菌消毒剂,它常温下为白色固体,难溶于冷水。其制备原理为: , 请选择下列部分装置制备二氯异氰尿酸钠并探究其性质。
请回答下列问题:
(1)、选择合适装置,按气流从左至右,导管连接顺序为(填小写字母)。(2)、将D中试剂换成氯酸钾后发生反应的化学方程式为。(3)、仪器X中的试剂是。(4)、实验时,先向A中通入氯气,生成高浓度的NaClO溶液后,再加入氰尿酸溶液。在加入氰尿酸溶液后还要继续通入一定量的氯气,其原因是。(5)、反应结束后,A中浊液经过滤、、得到粗产品mg。(6)、粗产品中NaC3N3O3Cl2含量测定。将mg粗产品溶于无氧蒸馏水中配制成100mL溶液,取10.00mL所配制溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min。用c mol/L Na2S2O3标准溶液进行滴定,加入淀粉指示剂,滴定至终点,消耗溶液。(假设杂质不与反应,涉及的反应为:C3N3O3Cl+3H++4I- = C3H3N3O3+2I2+2Cl- , )①滴定终点现象是。
②则NaC3N3O3Cl2的含量为。(用含m,c,V的代数式表示)
31. 二氯化二硫是一种金黄色油状液体(沸点138℃),用作除草剂、橡胶硫化剂等。制备装置如图(夹持和加热装置略)。
已知:遇水发生反应;热稳定性差;能被氧化为;硫黄的熔点为113℃,沸点为445℃,
回答下列问题:
(1)、电子式为。(2)、制备的实验步骤如下:步骤1:检查装置气密性,加入硫黄,通氮气;
步骤2:一段时间后加热A中三颈烧瓶至110℃~115℃,使硫黄熔化;
步骤3:改通氯气,于115℃~125℃氯化一段时间后改通氮气;
步骤4:......;
步骤5:停止加热,持续通氮气至冷却。
①步骤1开始时需打开关闭(填“”、“”或“”)。通氮气的目的是;步骤4是。
②证明有生成的现象是。反应过程应控制的量,原因是;装置C可选择(填标号)。
 (3)、为测定产物纯度,实验操作如下:
(3)、为测定产物纯度,实验操作如下:Ⅰ.实验前称重B装置为 , 实验后称重为(均不包含冰盐水),取出产品备用,剩余产品进行后续实验;
Ⅱ.撤掉装置A、C和B中冰盐水,重新更换足量的NaOH溶液,直接连接装置B、D;
Ⅲ.打开、、 , 并不断向B中通入水蒸气、将和全部赶出;
Ⅳ.实验结束后,取下锥形瓶,滴加几滴酚酞,用盐酸标准溶液滴定剩余的溶液,消耗盐酸;
Ⅴ.不加样品,做空白对照实验,消耗盐酸。
①产品中的纯度为(写出表达式)。
②下列操作可能会导致测定结果偏高的是(填标号)。
a.水蒸气的通入时间较短
b.操作Ⅳ滴定后仰视滴定管读数
c.操作Ⅴ滴定前滴定管尖嘴处有气泡,滴定后无气泡
32. 硫化锂(Li2S)易潮解,在加热条件下易被空气中的氧化,是一种潜在的锂电池的电解质材料。实验室用粗锌(含少量铜、FeS)和稀硫酸反应制备 , 并用制得的去还原硫酸锂制备硫化锂,反应原理: , 实验装置如图所示。请回答下列问题: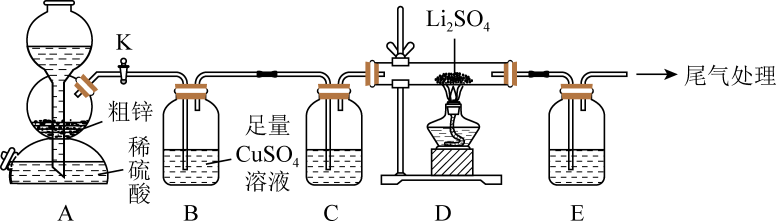 (1)、选择A装置实现随制随停,还适用于下列试剂制备对应气体的是(填标号)。
(1)、选择A装置实现随制随停,还适用于下列试剂制备对应气体的是(填标号)。a.70%硫酸、亚硫酸钠 b.:稀盐酸、大理石
c.:浓氨水、生石灰 d.:浓盐酸、
(2)、C和E装置中盛装的试剂相同,均可选择(填名称),E装置的作用是。(3)、B装置中发生反应的离子方程式为。(4)、得到的产品中往往含有一定量的杂质,某小组同学对产品中的杂质进行探究。①提出猜想:
猜想一:产品中含杂质
猜想二:产品中含杂质
猜想三:产品中含杂质S
依据所学知识,猜想三不成立,理由是。
②化学小组为验证猜想:
限选试剂:稀盐酸、稀硫酸、蒸馏水、品红溶液、双氧水、氯化钡溶液、硝酸钡溶液
实验
操作与现象
结论
I
取少量样品溶于水,
样品中不含
II
在实验I反应后的溶液中,
样品中含
(5)、测定产品纯度的方法:取wg样品加入足量稀硫酸,充分反应后,煮沸溶液,冷却后滴加酚酞溶液作指示剂,用NaOH标准溶液滴定,消耗NaOH标准溶液。①煮沸的目的是。
②样品的纯度为。
33. 实验室以次氯酸盐和铁盐为原料制备少量的操作步骤如下:(1)、Ⅰ.制备NaClO强碱性饱和溶液:①将20mLNaOH溶液加入仪器b中,冷水浴冷却,通入搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止(装置如下图所示)。

②将所得饱和NaClO倒入烧杯并置于冷水浴中,分几次加入20gNaOH固体并不断搅拌,过滤,得NaClO强碱性饱和溶液。
甲装置中a管的作用是。
(2)、写出甲装置中反应的化学方程式。(3)、石灰乳的作用是。(4)、反应过程中用冷水浴冷却的原因是。(5)、Ⅱ.合成①称取5.05g(相对分子质量为404)固体,在冷水浴中分批加入Ⅰ中所得滤液,并不断搅拌,反应1小时后溶液呈深紫红色(即)。
②离心分离除去水解得到的胶体,留上层清液(深紫红色)。
③向②的上层清液中缓慢加入KOH饱和溶液50.00mL,冰水浴保持5min,过滤,得(相对分子质量为198)粗产品。
④将粗产品重结晶,并用异丙醇洗涤,低温烘干,得纯产品2.13g。
合成的离子方程式为。
(6)、用异丙醇洗涤的目的是。(7)、的产率为(保留至0.1%)。34. 硫化锌(ZnS)是一种半导体材料,某小组在实验室制备硫化锌:。回答下列问题: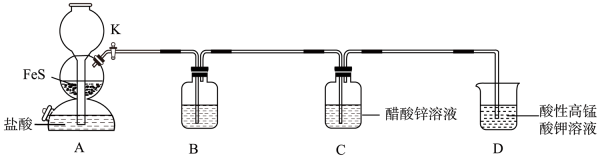 (1)、装置A中发生反应的化学方程式为。(2)、装置B中盛装的试剂可能是(填标号)。
(1)、装置A中发生反应的化学方程式为。(2)、装置B中盛装的试剂可能是(填标号)。a.NaOH溶液 b.饱和NaHS溶液 c.新制氯水
(3)、装置A能控制反应的发生和停止,装置C中完全反应后,停止装置A中反应的操作是。(4)、当装置D中0.01mol完全反应时,转移0.08mol电子,则该反应中氧化产物与还原产物的物质的量之比为。(5)、实验完毕后,从装置C中得到较纯净的ZnS的操作是(填标号)、洗涤、干燥。 (6)、测定ZnS产品纯度。
(6)、测定ZnS产品纯度。准确称取mg产品(杂质不含Zn元素)溶于足量盐酸,加热至不产生气泡,稀释成250mL溶液,准确量取25.00mL稀释后的溶液于锥形瓶中,调节pH在1.5~3,用二苯胺作指示剂,用的亚铁氰化钾{}标准溶液滴定至终点,消耗标准溶液VmL。
已知:滴定反应为。
①加热的目的是。
②该产品中ZnS的质量分数为(用含m、c、V的代数式表示)%。
③如果其他操作均正确,滴定前俯视读数,滴定终点时仰视读数,那么测得结果(填“偏高”、“偏低”或“无影响”)。
35. 锡酸钠晶体(Na2SnO3•3H2O)在电镀、媒染等工业应用广泛,碲(52Te)被誉为“国防与尖端技术的维生素”。以锡碲渣废料(主要成分为SnO、TeO,还含有少量Fe、Pb、As等元素的氧化物)为原料,制备锡酸钠晶体和碲的工艺流程如下图:
已知:①水碎液中溶质主要成分为Na2SnO3、Na2TeO3、Na3AsO4和Na2PbO2;
②碱性条件下,锡酸钠在水中的溶解度随温度的升高而减小。
回答下列问题:
(1)、“碱浸”时,TeO发生反应的化学方程式为。(2)、“除砷”时,若要使0.002 mol·L-1AsO沉淀完全(离子浓度不大于10-6 mol·L-1),则需要加入等体积的Ba(OH)2溶液的物质的量浓度至少为。(已知常温下Ksp[Ba3(AsO4)2]=10-24)。(3)、“除铅”时,加入Na2S所发生反应的离子方程式为。(4)、“除碲”时,相同时间内不同的反应温度对Te的脱除率的影响关系如图2,70℃后随温度升高Te的脱除率下降的原因可能是。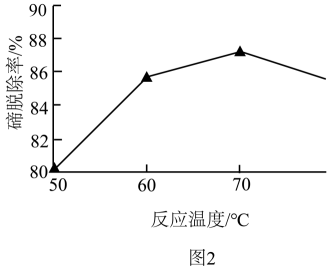 (5)、“溶析结晶”的操作是 , 洗涤,干燥,得到锡酸钠晶体。(6)、“还原”反应中还原剂与氧化剂的物质的量之比为;(7)、所得碲产品中碲的纯度测定步骤如下:
(5)、“溶析结晶”的操作是 , 洗涤,干燥,得到锡酸钠晶体。(6)、“还原”反应中还原剂与氧化剂的物质的量之比为;(7)、所得碲产品中碲的纯度测定步骤如下:①取4.0 g碲产品,加入酸使其转化为亚碲酸(H2TeO3),将其配制成100 mL溶液,取20.00 mL于锥形瓶中。
②往锥形瓶中加入20.00 mL0.1 mol·L-1酸性K2Cr2O7溶液,充分反应使亚碲酸转化为碲酸(H6TeO6)。
③用0.1 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定剩余的酸性K2Cr2O7溶液,滴入几滴试亚铁灵指示剂至终点显红色,进行三次平行实验,平均消耗12.00 mL硫酸亚铁铵标准溶液。
计算所得碲产品中碲的纯度为。