高考二轮复习知识点:气体的收集
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 完成下述实验,装置或试剂不正确的是( )
实验室制
实验室收集
验证易溶于水且溶液呈碱性
除去中混有的少量
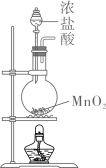
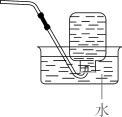
 A、 B、 C、 D、2. 下列实验操作规范的是( )
A、 B、 C、 D、2. 下列实验操作规范的是( )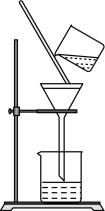
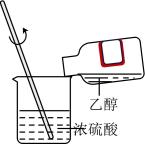
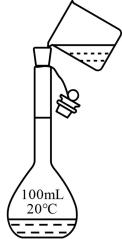
A.过滤
B.排空气法收集
C.混合浓硫酸和乙醇
D.溶液的转移
A、A B、B C、C D、D3. 实验室用 和浓盐酸反应生成 后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是( )A、 B、
B、 C、
C、 D、
D、 4. 实验室制备下列气体所选试剂、制备装置及收集方法均正确的是( )
4. 实验室制备下列气体所选试剂、制备装置及收集方法均正确的是( )
气体
试剂
制备装置
收集方法
A
O2
KMnO4
a
d
B
H2
Zn+稀H2SO4
b
e
C
NO
Cu+稀HNO3
b
c
D
CO2
CaCO3+稀H2SO4
b
c
A、A B、B C、C D、D5. 在实验室釆用如图装置制备气体,合理的是( )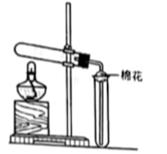
化学试剂
制备的气体
A
B
(浓)
C
D
(浓)
A、A B、B C、C6. 在实验室中用浓盐酸与MnO2共热制取Cl2。下列收集Cl2的装置正确的是A、 B、
B、 C、
C、 D、
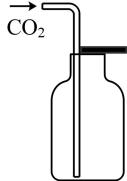
D、 7. 如图是制取和收集某气体的实验装置,该装置可用于
7. 如图是制取和收集某气体的实验装置,该装置可用于 A、用浓硫酸和氯化钠制取 B、用浓氨水和生石灰制取 C、用浓硝酸与铜制取 D、用双氧水和二氧化锰制取8. 实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )
A、用浓硫酸和氯化钠制取 B、用浓氨水和生石灰制取 C、用浓硝酸与铜制取 D、用双氧水和二氧化锰制取8. 实验是化学研究的基础。下列关于各实验装置的叙述正确的是( ) A、装置①常用于分离互不相溶的液体混合物 B、装置②可用于吸收NH3或HCl气体,并防止倒吸 C、装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢 D、装置③可用于收集H2、CO2、Cl2、NH3等气体9. 下列装置能达到实验目的的是( )
A、装置①常用于分离互不相溶的液体混合物 B、装置②可用于吸收NH3或HCl气体,并防止倒吸 C、装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢 D、装置③可用于收集H2、CO2、Cl2、NH3等气体9. 下列装置能达到实验目的的是( ) A、利用甲装置配制一定物质的量浓度的稀硫酸 B、利用乙装置制备并收集少量二氧化氮气体 C、利用丙装置由工业酒精制取无水酒精 D、利用丁装置从氯化镁溶液中获得无水10. 下列实验装置或实验操作正确,且能完成相应实验的是( )
A、利用甲装置配制一定物质的量浓度的稀硫酸 B、利用乙装置制备并收集少量二氧化氮气体 C、利用丙装置由工业酒精制取无水酒精 D、利用丁装置从氯化镁溶液中获得无水10. 下列实验装置或实验操作正确,且能完成相应实验的是( ) A、按照图甲中序号所示顺序向试管中加入试剂,制取乙酸乙酯 B、利用图乙所示装置收集NO气体 C、将通入图丙所示装置中进行尾气吸收 D、利用图丁装置验证碳酸钠和碳酸氢钠的稳定性11. 在实验室采用如图装置制备气体,合理的是( )
A、按照图甲中序号所示顺序向试管中加入试剂,制取乙酸乙酯 B、利用图乙所示装置收集NO气体 C、将通入图丙所示装置中进行尾气吸收 D、利用图丁装置验证碳酸钠和碳酸氢钠的稳定性11. 在实验室采用如图装置制备气体,合理的是( )
选项
化学试剂
制备的气体
A
C2H5OH+ H2SO4 (浓)
C2H4
B
MnO2+HCl(浓)
Cl2
C
MnO2 + H2O2
O2
D
CaO+氨水(浓)
NH3
A、A B、B C、C D、D12. 利用下列装置(夹持装置省略)进行实验,能达到实验目的的是( )



A.检验1-溴丙烷和氢氧化钠的醇溶液反应生成丙烯
B.观察铁的吸氧腐蚀
C.收集氨气
D.仪器中液体体积为
A、A B、B C、C D、D13. 实验室制备干燥氯气的装置如图所示,有关实验操作或叙述错误的是( ) A、该实验无需在烧瓶中添加沸石防止暴沸 B、用该装置可收集到纯净的氯气 C、a、b两种溶液分别为饱和食盐水和浓硫酸 D、尾气吸收装置中生成的盐有NaCl、NaClO14. 下列实验装置能达到目的的是( )A、实验室制乙酸乙酯
A、该实验无需在烧瓶中添加沸石防止暴沸 B、用该装置可收集到纯净的氯气 C、a、b两种溶液分别为饱和食盐水和浓硫酸 D、尾气吸收装置中生成的盐有NaCl、NaClO14. 下列实验装置能达到目的的是( )A、实验室制乙酸乙酯 B、比较Ksp( AgCl)和Ksp(AgI )的大小
B、比较Ksp( AgCl)和Ksp(AgI )的大小  C、制备并收集干燥的NH3
C、制备并收集干燥的NH3  D、制取和收集少量CO2、NO和O2
D、制取和收集少量CO2、NO和O2  15. 用下列仪器或装置(图中部分夹持略)进行相应实验,可以达到实验目的的是( )
15. 用下列仪器或装置(图中部分夹持略)进行相应实验,可以达到实验目的的是( )验证溴乙烷消去反应的气体产物为乙烯
实验室制乙酸乙酯
收集NO2气体
酸性:碳酸>苯酚




A
B
C
D
A、A B、B C、C D、D16. 关于下列各实验装置的叙述,不正确的是( ) A、装置①可用于实验室制取少量NH3或O2 B、可用从a处加水的方法检验装置②的气密性 C、实验室可用装置③收集H2、NH3 D、利用装置④制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜17. 实验室收集下列气体的方法肯定与 相同的是()A、
A、装置①可用于实验室制取少量NH3或O2 B、可用从a处加水的方法检验装置②的气密性 C、实验室可用装置③收集H2、NH3 D、利用装置④制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜17. 实验室收集下列气体的方法肯定与 相同的是()A、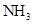 B、
B、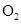 C、HCl
D、CH2=CH2
18. 关于下列各实验装置图的叙述中,正确的是( )
C、HCl
D、CH2=CH2
18. 关于下列各实验装置图的叙述中,正确的是( ) A、装置①可用于分离苯和溴苯的混合物 B、装置②可用于吸收HCl或NH3气体 C、装置③可用于分解NH4Cl制备NH3 D、装置④b口进气可收集CO2或NO气体19. 如图是制取和收集某气体的实验装置,可用于( )
A、装置①可用于分离苯和溴苯的混合物 B、装置②可用于吸收HCl或NH3气体 C、装置③可用于分解NH4Cl制备NH3 D、装置④b口进气可收集CO2或NO气体19. 如图是制取和收集某气体的实验装置,可用于( ) A、用Zn粒与稀HCl反应制H2 B、用大理石与稀HCl反应制CO2 C、用Cu与稀HNO3反应制NO D、用MnO2与浓HCl反应制Cl220.
A、用Zn粒与稀HCl反应制H2 B、用大理石与稀HCl反应制CO2 C、用Cu与稀HNO3反应制NO D、用MnO2与浓HCl反应制Cl220.用右图所示装置进行如下实验,能达到实验目的是( )
 A、瓶中盛满水,从B口进气,用排水法收集NO2 B、瓶中盛适量浓硫酸,从A口进气来干燥NH3 C、从B口进气,用排空气法收集CO2 D、瓶中装满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积
A、瓶中盛满水,从B口进气,用排水法收集NO2 B、瓶中盛适量浓硫酸,从A口进气来干燥NH3 C、从B口进气,用排空气法收集CO2 D、瓶中装满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积二、多选题
-
21. 下述实验方案能达到实验目的的是( )
选项
A
B
C
D
方案




目的
收集乙烯并验证它与溴水发生加成反应
探究苯分子中是否含有碳碳双键
在强光照条件下制取纯净的一氯甲烷
实验室制备乙酸乙酯
A、A B、B C、C D、D三、非选择题
-
22. 选择完成下列实验的装置。
 (1)、加热MnO2和浓盐酸的混合物制Cl2 , 用(填序号,下同)。(2)、从盐水中获得食盐,用。(3)、实验室收集SO2 , 用。23. 氮化钙有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、新型陶瓷工业等领域。部分理化性质如下表:
(1)、加热MnO2和浓盐酸的混合物制Cl2 , 用(填序号,下同)。(2)、从盐水中获得食盐,用。(3)、实验室收集SO2 , 用。23. 氮化钙有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、新型陶瓷工业等领域。部分理化性质如下表:性质
颜色、状态
熔点
特性
具体描述
常温下为棕色固体
1195
空气中会被氧化,遇水强烈水解,产生刺激性气味气体
工业上利用单质钙在氮气流中,控制温度450℃,可制得氮化钙。实验室模拟工业制备氮化钙,并对氮化钙纯度进行测定,实验方案如下:
(1)、Ⅰ.制备:
A处产生 , 请写出A中反应的化学方程式。工业上一般采用(填具体做法)制取。
(2)、装置的连接顺序为A→(注:以上所有装置都能用到)。(3)、实验开始时,先启动A处反应,一段时间后再点燃B处酒精灯,其原因是。(4)、制备过程中D处导管必须始终插入水中,目的是①便于观察的流速;②。(5)、Ⅱ.纯度测定(已知摩尔质量为 , 所含的杂质不与水反应,氨气极易溶于水,不溶于煤油。)方案一:称取氮化钙样品2.4g,按图1所示装置进行实验,发现B装置增重0.51g。

该样品中氮化钙的质量分数为。
方案二:取与方案一同质量的样品,改用图2装置进行纯度测定,倾斜Y型管,将蒸馏水倒入样品管中,充分反应后测量气体体积。
方案二测得的氮化钙纯度为95%左右,试分析方案一测得的氮化钙纯度偏低的原因。
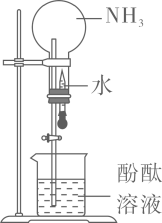
24. 某课外活动小组在实验室制备氨气、验证氨气的某些性质。(1)、氨气的制备
①图中三套装置中能制备干燥NH3的是(填“甲”或“乙”或“丙”)。
②上述方案中制备NH3的化学方程式是。
③检验NH3是否收集满的方法是。
(2)、氨气性质的探究
用图中装置进行实验,一段时间后,A中硬质玻璃管内黑色粉末变为红色,B中固体变蓝色,C中出气导管处收集到一种无色无味的气体单质。
①仪器B的名称;
②A中硬质玻璃管内发生反应的化学方程式。
③洗气瓶中浓硫酸的作用为。
④有同学提出,A中红色产物中可能含有Cu2O(已知:Cu2O+2H+=Cu2++Cu+H2O),请设计实验方案验证:。
25. 硫代硫酸铵是一种快速定影剂。某实验小组采用如下方法制备溶液,并模拟胶片定影过程探究定影原理。已知:硫代硫酸盐露置在空气中容易被氧化。 (1)、Ⅰ.制备(图中夹持和加热装置省略)
(1)、Ⅰ.制备(图中夹持和加热装置省略)仪器A的名称是。
(2)、反应开始前通入一段时间的目的是。(3)、将混合溶液加热后冷却片刻,观察到有大量菱片状沉淀析出。从反应后的浊液中获得的一系列操作是、、一定条件下脱水干燥。(4)、Ⅱ.制备溶液将缓慢倾入溶液中,搅拌后发生反应: , 列式计算说明该反应进行较为完全的原因:。已知:该反应温度下,、;一般认为时反应进行较完全,时反应难以进行。
(5)、经实验得到的溶液中可能含有少量 , 为验证的存在,选择相应试剂完成如下实验。限选试剂:稀硫酸、稀盐酸、稀硝酸、溶液、溶液。实验操作
实验现象
原因解释
ⅰ.取少量待测溶液于试管中,滴加过量的。
溶液出现黄色浑浊,有刺激性气味气体产生。
用离子方程式解释实验现象:
ⅱ.静置,取上层清液滴加适量。
。
待测液中含有。
Ⅲ.定影原理探究
(6)、具有络合能力,能和形成 , 因此溶液能够溶解胶片中未曝光的使胶片快速成像。用离子方程式解释溶解的原因:。26. 氨气在工农业生产中有重要应用。某化学小组同学利用以下装置制备氨气,并探究氨气的性质(夹持仪器略)。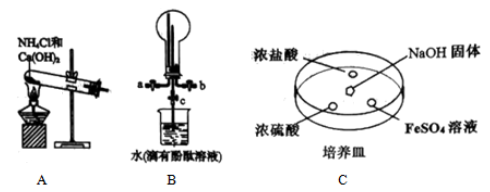 (1)、实验室用装置A制备氨气的化学方程式为。(2)、用装置B收集氨气时,进气口是(选填“a”或“b”)。打开装置B中的活塞c,烧瓶内产生了红色喷泉,则说明氨具有的性质是 , 。(3)、向C中固体上滴几滴浓氨水,迅速盖上玻璃片,浓盐酸液滴附近会出现白烟,发生反应的化学方程式为 , 检验白烟中阴离子的方法是。液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应有和。27. 某同学用如图装置进行铜与浓硫酸反应的实验(加热和夹持装置已略去):
(1)、实验室用装置A制备氨气的化学方程式为。(2)、用装置B收集氨气时,进气口是(选填“a”或“b”)。打开装置B中的活塞c,烧瓶内产生了红色喷泉,则说明氨具有的性质是 , 。(3)、向C中固体上滴几滴浓氨水,迅速盖上玻璃片,浓盐酸液滴附近会出现白烟,发生反应的化学方程式为 , 检验白烟中阴离子的方法是。液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应有和。27. 某同学用如图装置进行铜与浓硫酸反应的实验(加热和夹持装置已略去):
实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A;
③将铜丝上提离开液面,停止加热。
(1)、A中发生反应的化学方程式为。(2)、若仪器B的作用是收集反应产生的SO2 , 请在虚线框中将该装置补充完整。(3)、证明仪器B中SO2气体已经收集满的现象是。(4)、下列有关该实验说法不正确的是____。A、浓硫酸与铜的反应中,浓硫酸只表现酸性 B、上下移动A中铜丝可控制生成SO2的量 C、实验后为避免仪器A中残留SO2泄漏,可将导管通入盛有NaOH溶液的烧杯中,打开旋塞E,缓缓从E向A中鼓入足量空气 D、如果铜丝足量,仪器A中的硫酸可反应完全28.(1)、用下图所示装置(省略夹持和净化装置)来完成某些气体的制取、收集及尾气处理,表中提供的物质合理的选项是。
选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓盐酸
KMnO4
Cl2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓硫酸
Na2SO3
SO2
NaOH溶液
(2)、实验室里,常用加热固体混合物的方法制取气体NH3 , 请写出其化学方程式:。29. 请选择合适的实验用品和化学试剂,用下图所示装置(C中盛放的是过氧化钠固体)进行实验,证明过氧化钠可以用作呼吸面具和潜水艇中的供氧剂。 (1)、仪器C的名称是。(2)、若分液漏斗中盛放的试剂是盐酸,为了除去混合气体中的氯化氢,装置B中盛放的试剂是。(3)、C中可能发生的化学反应的化学方程式为。(4)、D中盛放的试剂作用是。(5)、检验F中收集到的气体的方法是。30. 选择装置,完成实验。
(1)、仪器C的名称是。(2)、若分液漏斗中盛放的试剂是盐酸,为了除去混合气体中的氯化氢,装置B中盛放的试剂是。(3)、C中可能发生的化学反应的化学方程式为。(4)、D中盛放的试剂作用是。(5)、检验F中收集到的气体的方法是。30. 选择装置,完成实验。 (1)、用自来水制备蒸馏水,选用(填序号,下同)。(2)、从食盐水中获取氯化钠,选用。(3)、用NH4Cl和Ca(OH)2制取NH3 , 选用。31. 某校化学兴趣小组,在实验室里模拟用N2和H2合成氨,反应的化学方程式为N2+3H2 2NH3。现用未经干燥的N2和H2按体积比V(N2):V(H2)=1:3充分混合后,按如图所示的装置进行有关实验。
(1)、用自来水制备蒸馏水,选用(填序号,下同)。(2)、从食盐水中获取氯化钠,选用。(3)、用NH4Cl和Ca(OH)2制取NH3 , 选用。31. 某校化学兴趣小组,在实验室里模拟用N2和H2合成氨,反应的化学方程式为N2+3H2 2NH3。现用未经干燥的N2和H2按体积比V(N2):V(H2)=1:3充分混合后,按如图所示的装置进行有关实验。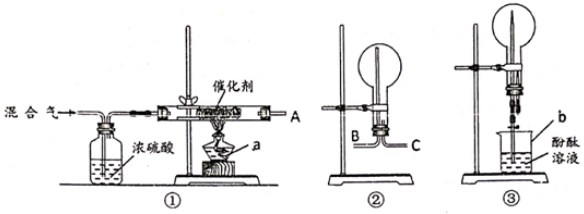
请回答下列问题:
(1)、装置①中浓硫酸的作用是 。(2)、若用装置②收集反应生成的气体,A应连接装置中的(填“B”或“C”);(3)、收集满气体后,再用装置③进行实验,当烧瓶中的液面逐渐上升,溶液呈色。(4)、实验结束时,溶液几乎充满了烧瓶,则溶液的物质的量浓度为mol/L(气体为标准状况下的体积)32. 科学研究发现,三种金属或两种金属可以组成准晶体。某准晶体样品M可能由铁、铜和铝中的三种或两种组成。(实验目的)探究 金属的成分
(1)、(提出假设)猜想1:M的成分是铁和铜;猜想2:M的成分是铁和铝;
猜想3:M的成分是;
猜想4:M的成分是铁、铜和铝
(2)、(设计实验)取两份质量均为m g的M样品,按图1和图2装置分别进行实验:实验前后条件都是常温、常压,待样品M充分反应后,按图1、图2实验方案完成实验并测得气体体积分别为V1L和V2L(所测定的气体体积已折合成标准状况)。
完成实验目的和猜想填空内容。
若该实验需要0.50mol/LNaOH溶液240mL,用规格仪器配制时应称量g NaOH(用托盘天平),若称量的NaOH固体中混有Na2O杂质会导致所配溶液浓度(填“偏大”、“偏小”或“无影响”)
(3)、进行实验1前,B瓶中的水没有装满,使测得的气体体积 (填“偏大”、“偏小”或“无影响”),实验2中的导管a的作用为并能防止因加入液体而排出锥形瓶内部分空气,导致测定的气体体积偏大。(4)、若V1≠0,则推测上述猜想 (填“1”、“2”、“3”或“4”)一定不成立,若猜想3成立,则V1V2(填“>”、“<”或“=”)。(5)、若V1<V2≠0,则M样品中铁的质量为g(用含V1和V2式子表示)33. 某化学课外小组所做实验的示意图如图所示:图中“→”表示气体流向,M是一种纯净而干燥的气体,Y为另一种气体,E内有红棕色气体产生,实验所用物质只能由下列物质中选取:Na2CO3、Na2O2、NaCl、Na2O、CaCl2、(NH4)2CO3、碱石灰等固体及蒸馏水。据此实验,完成下列填空: (1)、A中所用装置的主要仪器和药品是。(2)、B中所选的干燥剂是 , 其作用是。(3)、C中发生的主要反应的化学方程式:。(4)、制取Y气体的D装置所用的主要仪器是。制取Y气体的化学方程式是。(5)、F中发生反应的化学方程式为。34. 现有A,B,C,D,E,F六种装置,如图所示。(胶塞、导管可自由选用)。已知:实验室可用下列反应制取氧气2KClO3 2KCl+3O2↑
(1)、A中所用装置的主要仪器和药品是。(2)、B中所选的干燥剂是 , 其作用是。(3)、C中发生的主要反应的化学方程式:。(4)、制取Y气体的D装置所用的主要仪器是。制取Y气体的化学方程式是。(5)、F中发生反应的化学方程式为。34. 现有A,B,C,D,E,F六种装置,如图所示。(胶塞、导管可自由选用)。已知:实验室可用下列反应制取氧气2KClO3 2KCl+3O2↑
 (1)、写出仪器名称:① , ②。(2)、实验室制取并收集氧气时,应选择和相连接。(3)、做木炭还原氧化铜并检验生成气体的实验时,应选择和相连接,检验生成气体时使用的试剂是 , 检验气体时观察到的实验现象是。(4)、制取氢气并做还原氧化铜的实验时,应选择和装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是。35. 如下图所示的装置中,A是氯气发生装置,C、D 为气体净化装置(C中装有饱和食盐水;D 中装有浓硫酸),E 是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液。
(1)、写出仪器名称:① , ②。(2)、实验室制取并收集氧气时,应选择和相连接。(3)、做木炭还原氧化铜并检验生成气体的实验时,应选择和相连接,检验生成气体时使用的试剂是 , 检验气体时观察到的实验现象是。(4)、制取氢气并做还原氧化铜的实验时,应选择和装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是。35. 如下图所示的装置中,A是氯气发生装置,C、D 为气体净化装置(C中装有饱和食盐水;D 中装有浓硫酸),E 是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液。
试回答:
(1)、仪器A的名称是;(2)、C装置的作用是;(3)、D 装置的作用是;(4)、E中发生化学反应的方程式为:;(5)、烧杯G 中发生反应的化学方程式为:。
-