高考二轮复习知识点:物质的检验和鉴别1
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 鉴别浓度均为的、三种溶液,仅用下列一种方法不可行的是A、测定溶液 B、滴加酚酞试剂 C、滴加溶液 D、滴加饱和溶液2. 某白色粉末样品,可能含有、、和 . 取少量样品进行如下实验:
①溶于水,得到无色透明溶液
②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出.离心分离.
③取②的上层清液,向其中滴加溶液有沉淀生成.
该样品中确定存在的是( )
A、 B、 C、 D、3. 为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的 溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是( )A、加入 溶液产生沉淀 B、加入淀粉碘化钾溶液无蓝色出现 C、加入 溶液无红色出现 D、加入 溶液无蓝色沉淀生成4. 一次性鉴别等浓度的 、 、 三种溶液,下列方法不可行的是( )A、测定 B、焰色试验 C、滴加 溶液 D、滴加饱和 溶液,微热5. 下列“类比”结果不正确的是( )A、 的热稳定性比 的弱,则 的热稳定性比 的弱 B、 的分子构型为V形,则二甲醚的分子骨架( )构型为V形 C、 的溶解度比 的大,则 的溶解度比 的大 D、将丙三醇加入新制 中溶液呈绛蓝色,则将葡萄糖溶液加入新制 中溶液也呈绛蓝色6. 黄色固体X,可能含有漂白粉、 、 、 、 之中的几种或全部。将X与足量的水作用,得到深棕色固体混合物Y和无色碱性溶液Z。下列结论合理的是( )A、X中含 ,可能含有 B、X中含有漂白粉和 C、X中含有 ,Y中含有 D、用 酸化溶液Z,若有黄绿色气体放出,说明X中含有7. 只用水不能鉴别( )A、苯和 B、晶体和晶体 C、和硫粉 D、乙酸乙酯和乙酸丁酯8. 以下实验设计能达到实验目的的是( )实验目的
实验设计
A
制备无水
加热蒸发与稀盐酸反应后的溶液
B
除去固体中的
将固体充分加热至恒重
C
鉴别NaBr和KI溶液
分别加新制氯水后,用萃取
D
重结晶提纯苯甲酸
将粗品水溶、过滤、蒸发、结晶
A、A B、B C、C D、D9. 下列试剂不能用来鉴别SO2和H2S的是A、新制氯水 B、品红溶液 C、氢氧化钠溶液 D、硫酸铜溶液10. 某固体样品可能含有NaNO3、NaHCO3、Na2SO3和Na2SO4。取少量样品进行如下实验:步骤①:将样品溶于水,得到澄清溶液;步骤②:向①的溶液中滴加过量稀盐酸,有气泡产生;步骤③:取②的上层清液,向其中滴加BaCl2溶液,有沉淀生成。下列说法中正确的是A、该固体样品中一定含有Na2SO4 B、该固体样品中一定含有NaHCO3 C、该固体样品不可能只含有Na2SO3 D、步骤②的试管口产生的气体一定是无色的11. 可以检验Na2SO3固体部分变质的试剂是A、Ba(NO3)2溶液 B、BaCl2溶液 C、BaCl2溶液、稀硝酸 D、BaCl2溶液、稀盐酸12. 某固体混合物可能由、、、、中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积)。关于该固体混合物,下列说法正确的是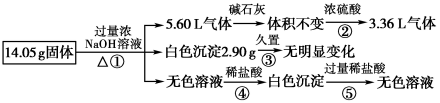 A、一定含有Al,其质量为 B、一定含有和 , 且物质的量相等 C、一定不含 , 可能含有和 D、一定含有和13. 实验室检验溶液中是否存在下列离子的方法正确的是( )
A、一定含有Al,其质量为 B、一定含有和 , 且物质的量相等 C、一定不含 , 可能含有和 D、一定含有和13. 实验室检验溶液中是否存在下列离子的方法正确的是( )离子
方法
A
I-
滴加淀粉溶液
B
SO
依次加入氯化钡溶液、稀盐酸
C
Fe2+
滴加K3[Fe(CN)6]
D
Al3+
逐滴加入氨水至过量
A、A B、B C、C D、D14. 检验下列溶液是否变质,所选试剂或试纸肯定合理的是( )选项
A
B
C
D
溶液
Na2SO3溶液
FeSO4溶液
KI溶液
NaOH溶液
所选试剂或试纸
BaCl2溶液
KSCN溶液
AgNO3溶液
广泛pH试纸
A、A B、B C、C D、D15. 下列方法可行的是( )A、用核磁共振氢谱鉴别2-溴丁烷的一对对映异构体 B、选用氨水鉴别Fe2+、Mg2+ , Al3+和Ag+ C、向含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热一段时间,除去过量的Cl2即可得到纯净的FeCl3溶液 D、除去NaCl中的少量MgCl2杂质,可将固体先用足量饱和食盐水充分溶解后再过滤,重复操作几次16. 某100mL溶液可能含有K+、、Al3+、、、Cl-中的若干种,取该溶液进行连续实验,实验过程如下图所示(所加试剂均过量,气体全部逸出):下列说法错误的是( ) A、原溶液中一定含有、 , 无Al3+ B、原溶液中一定存在K+ , 可能存在Cl- C、是否存在K+只有通过焰色反应才能确定 D、若原溶液中不存在Cl- , 则c(K+)=0.1mol·L-117. 下列方案设计、现象和结论有错误的是( )
A、原溶液中一定含有、 , 无Al3+ B、原溶液中一定存在K+ , 可能存在Cl- C、是否存在K+只有通过焰色反应才能确定 D、若原溶液中不存在Cl- , 则c(K+)=0.1mol·L-117. 下列方案设计、现象和结论有错误的是( )目的
方案设计
现象和结论
A
检验阿司匹林中是否存在水杨酸
取样品,加入蒸馏水和乙醇振荡,再加入两滴氯化铁溶液
溶液变紫色,说明存在水杨酸
B
检验含氟化钠的牙膏中的
向稀溶液中加过量含氟牙膏的浸泡液
血红色褪去说明含
C
鉴别与
各取少量固体加水溶解,分别滴加盐酸酸化的溶液,观察溶液颜色变化
溶液变黄色的是 , 不变色的是
D
检验卧室内空气是否含甲醛
用注射器抽取一针管气体慢慢注入盛有酸性高锰酸钾稀溶液的试管中,观察溶液颜色变化
溶液不变色,说明空气中不含甲醛
A、A B、B C、C D、D18. 下列方案设计、现象和结论有不正确的是( )目的
方案设计
现象和结论
A
氨水中NH3检验
在一支洁净的试管中滴加几滴氨水,将湿润的红色石蕊试纸粘在玻璃棒上靠近试管口,观察试纸颜色变化。
若试纸由红色变为蓝色, 则有NH3
B
海带中碘元素的检验
取3g干燥的海带灼烧,在灰分中加入蒸馏水,过滤,在滤液中加入适量稀硫酸,再加入适量新制氯水,取出少许混合液于试管中,滴入几滴淀粉溶液。
若溶液显蓝色,则含碘元素。
C
火柴头中氯元素的检验
摘下几根火柴的火柴头, 将火柴头浸于蒸馏水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液。
若出现白色沉淀,则含氯元素
D
乙酸乙酯水解条件的比较
取两支试管编号为1、2,1中加入4mL蒸馏水+2滴甲基橙+2mL乙酸乙酯,2中加入4 mL4mol/LNaOH溶液+2滴石蕊溶液+2mL乙酸乙酯,振荡后同时插入75℃热水浴,加热约5分钟。观察现象。
1中颜色无变化,2中颜色蓝色变浅,说明水解程度 2大于1.
A、A B、B C、C D、D19. 研究小组为探究Na2S晶体在空气中变质后的产物,进行实验并记录现象如下:①取Na2S样品加水溶解,得到澄清溶液a。
②取少量溶液a加入过量盐酸,有臭鸡蛋气味的气体放出,且出现淡黄色浑浊。
③将②中浊液过滤,向滤液中加入BaCl2溶液,产生白色沉淀。
资料:i.Na2S溶液能溶解S生成Na2Sx , Na2Sx与酸反应生成S和H2S(臭鸡蛋气味)
ii.BaS易溶于水
下列说法不正确的是( )
A、②中淡黄色浑浊可能是 与H+反应产生的 B、①和②说明该Na2S样品中含有S C、③中白色沉淀是BaSO4 D、该Na2S样品中可能含有Na2SO320. 香豆素具有抗凝血作用,以水杨醛(X)为原料可制备合成香豆素的中间体(Y)。

下列有关化合物X、Y说法错误的是( )
A、1molY最多能与2molNaOH反应 B、可用FeCl3溶液鉴别X和Y C、在一定条件下,X可与HCHO发生缩聚反应 D、室温下,Y与Br2加成的产物分子中含有2个手性碳原子21. 二氢黄樟油素是一种常见的日化香料,可用香桂油为原料制取,反应如下:下列说法错误的是( ) A、香桂油能发生聚合反应、还原反应 B、香桂油分子中所有碳原子可能共平面 C、二氢黄樟油素的一氯代物有6种 D、可用溴水鉴别以上两种有机物22. 固体混合物X含有 中的几种,进行如下实验:
A、香桂油能发生聚合反应、还原反应 B、香桂油分子中所有碳原子可能共平面 C、二氢黄樟油素的一氯代物有6种 D、可用溴水鉴别以上两种有机物22. 固体混合物X含有 中的几种,进行如下实验:①X溶于足量水,得到无色溶液Y和沉淀Z;
②往沉淀Z中加足量稀盐酸,沉淀部分溶解。
下列说法错误的是( )
A、X中肯定含有 和 B、往溶液Y中加稀硫酸,若产生黄绿色气体,则X中含有 C、往溶液Y中通 ,不一定生成白色沉淀 D、往沉淀Z中加NaOH溶液,若沉淀部分溶解,则X中含有23. 能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是( )A、点燃,能燃烧的是矿物油 B、加入足量氢氧化钠溶液共热,不分层的是地沟油 C、加入水中,浮在水面上的是地沟油 D、测定沸点,有固定沸点的是矿物油24. 常温下,能鉴别浓 和稀 ,且与浓 强氧化性有关的是( )A、铝片 B、纸 C、铜片 D、焦炭25. 某溶液中可能含浓度均为0.5mol/L的 、 、 、 、 、 中的若干种。向该溶液中逐滴加入稀HCl至过量,无明显现象,得到溶液X,对X进行如下实验:
根据上述实验现象得出的结论,错误的是( )
A、可能含 、 、 B、沉淀N是 C、一定含 、 D、再检验一种离子即可确定原溶液成分26. 下列实验用酸性 溶液不能达到预期目的的是( )A、鉴别 和 B、检验硫酸铁溶液中是否有硫酸亚铁 C、鉴别苯和对二甲苯 D、检验 中含碳碳双键27. 下列鉴别方法可行的是( )A、用湿润的淀粉-KI试纸鉴别Br2(g)和NO2 B、用热的NaOH溶液鉴别地沟油和矿物油 C、用溴水鉴别苯、环己烯和环己烷 D、用酸性KMnO4溶液鉴别FeCl2溶液和FeCl3溶液28. 《天工开物》中记载:“凡铸钱每十斤,红铜(纯铜)居六七,倭铅(锌)居三四,倭铅每见烈火必耗四分之一……盖铅质先走,其铜色渐高。”可见铜钱材质实乃黄铜。下列说法错误的是( )A、黄铜是一种铜锌合金材料,其熔点比纯铜低 B、黄铜与黄金外观相似,制作的钱币均具有耐火性 C、从铸钱过程可以看出,锌的沸点低于铜 D、铜钱不易产生铜绿,由于倭铅保护了铜29. 生活离不开化学,下列行为不合理或有常识性错误的是( )A、用明矾可消除水中Cu2+等重金属离子污染 B、上饶市在创全国文明城市,为符合题意响应“垃圾分一分,环境美十分”的口号,可把坚果壳放到标有 图标的垃圾桶内
C、75%(体积分数)的酒精、含氯消毒剂、过氧乙酸均可以有效灭活新型冠状病毒
D、蚕丝和棉纤维灼烧后产生的气味不同
30. 下列实验现象和结论相对应且正确的是( )
图标的垃圾桶内
C、75%(体积分数)的酒精、含氯消毒剂、过氧乙酸均可以有效灭活新型冠状病毒
D、蚕丝和棉纤维灼烧后产生的气味不同
30. 下列实验现象和结论相对应且正确的是( )选项
实验
现象
结论
A
用铂丝蘸取少量某溶液进行焰色反应
火焰呈黄色
证明该溶液中存在 ,不含
B
向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜,加热
得到蓝色溶液
蔗糖水解的产物没有还原性
C
将 溶液加入 溶液中,充分反应后再加入 混合振荡,静置
溶液分层,下层液体显紫红色
氧化性:
D
将充满NO2的密闭玻璃球浸泡在热水中
红棕色变深
反应:
A、A B、B C、C D、D31. 下列说法或基本操作合理的是( )A、在空气中,将氯化镁溶液蒸发结晶可以获得纯净的氯化镁固体 B、金属钠切割后的剩余部分不能放回原试剂瓶,应放置废液缸中 C、可用硝酸和硝酸银溶液鉴别氯化钠溶液与亚硝酸钠溶液 D、硝酸银溶液保存在棕色的广口瓶中,防止见光分解32. 下列说法错误的是( )A、核磁共振氢谱不能区分CH3CH2OH和CH3OCH3 B、用溴水可以鉴别苯酚溶液、2,4—己二烯和甲苯 C、室温下,在水中的溶解度:甘油>苯酚>溴乙烷 D、两种二肽互为同分异构体,二者的水解产物可能相同33. 根据下列实验操作和现象所得到的结论正确的是( )选项
实验操作和现象
结论
A
向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝
淀粉未水解
B
室温下,向 HCl溶液中加入少量镁粉,产生大量气泡,测得溶液温度上升
镁与盐酸反应放热
C
室温下,向浓度均为 的BaCl2和CaCl2混合溶液中加入Na2CO3溶液,出现白色沉淀
白色沉淀是BaCO3
D
向 H2O2溶液中滴加 KMnO4溶液,溶液褪色
H2O2具有氧化性
A、A B、B C、C D、D二、非选择题
-
34. 某种常见补铁药物的主要成分为琥珀酸亚铁。该药品不溶于水但能溶于常见稀酸。某学习小组同学分别设计实验检验药片中Fe2+的存在并测定Fe2+的含量(假设杂质不参与反应)。回答下列问题:(1)、甲同学为了检验药品中的Fe2+ ,将药物碾碎、水溶后过滤。取少量所得滤液于两支试管中,分别加入K3[Fe(CN)6]溶液和KSCN溶液,观察并记录实验现象。
①甲同学过滤时的下列操作规范的是(填编号)。
a.用玻璃棒引流
b.漏斗口未紧靠烧杯内壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高于漏斗边缘
e.用玻璃棒在漏斗中搅动以加快过滤速度
②滤液加入K3[Fe(CN)6]溶液或KSCN溶液均未出现明显现象,其主要原因为 。
(2)、乙同学设计如下实验测定药片中Fe2+的含量。步骤一:取本品10片,碾碎后加入一定浓度试剂a,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量H2O2溶液,后加入过量NaOH溶液生成沉淀,将沉淀过滤、洗涤、干燥后灼烧至固体质量恒定,得0. 64g固体。
①步骤一中加入的试剂a为 。
②步骤三中,加入H2O2溶液发生反应的离子方程式为 , 灼烧后 所得固体的颜色为 , 灼烧时需要使用下列仪器中的 (填编号)。
a.酒精灯 b.坩埚 c.蒸发皿 d.铁架台(带铁圈) e.三脚架
③若将步骤三中的H2O2 溶液换为Cl2也能达到目的,但使用H2O2溶液的好处是。
④由实验数据计算,每片药片中约含Fe2+ mg。
(3)、医生建议该药品与维生素C同时服用以增强补铁效果,原因是利用了维生素C的 (选填“氧化性”、“ 还原性”或“碱性”。)35. 某实验小组探究Mn2+的检测方法。查阅资料:Mn2+的稀溶液几乎无色,在酸性介质中,S2O能将Mn2+氧化成MnO。
(1)、资料中检测Mn2+方法的反应为(用离子方程式表示)。甲同学设计实验如表。
序号
实验操作
实验现象
Ⅰ
向1mL0.002mol·L-1MnSO4溶液中滴入3滴3mol·L-1H2SO4溶液并加入一粒米大的K2S2O8固体
5min无明显现象
(2)、实验Ⅰ并未观察到预期现象,查阅资料,并进行以下实验。序号
实验操作
实验现象
Ⅱ
向1mL0.002mol·L-1MnSO4溶液中滴入3滴3mol·L-1H2SO4溶液并加入一粒米大的K2S2O8固体,加热至沸腾
溶液变棕黄色,1min后出现紫红色
Ⅲ
向1mL0.002mol·L-1MnSO4溶液中滴入3滴3mol·L-1H2SO4溶液并加入一粒米大的K2S2O8固体,再滴入2滴0.1mol·L-1AgNO3溶液
溶液变棕黄色,5min出现紫红色
Ⅳ
向1mL0.05mol·L-1MnSO4溶液中滴入3滴3mol·L-1H2SO4溶液并加入一粒米大的K2S2O8固体,加热至沸腾
迅速生成棕黑色沉淀
①对比实验Ⅱ、Ⅲ,推测实验Ⅰ无明显现象的原因。
②解释实验Ⅱ、Ⅲ中溶液变棕黄色的原因。
③结合离子方程式解释实验Ⅳ中产生棕黑色沉淀的原因。
(3)、乙同学继续设计实验序号
实验操作
实验现象
V
向1mL0.002mol·L-1MnSO4溶液中滴入3滴3mol·L-1H2SO4溶液并加入一粒米大的K2S2O8固体+ , 微热
1min后出现紫红色
完成表格中空白处。
(4)、总结:探究Mn2+的检测方法需要考虑的因素有。36. 叠氮化钠(NaN3)是易溶于水的白色晶体,微溶于乙醇。不溶于乙醚,常用作汽车安全气囊中的药剂,实验室制取叠氮化钠的原理、实验装置(图甲)及实验步骤如下:
①关闭止水夹K2 , 打开止水夹K1 , 制取并通入氨气。
②加热装置A中的金属钠,使其熔化并充分反应后,停止通入氨气并关闭止水夹K1。
③向装置A中的b容器内充入加热介质,并加热到210~220 ℃,然后打开止水夹K2 , 通入Na2O。
请回答下列问题:
 (1)、盛放无水氯化钙的仪器名称是 , 图乙中可用来制取氨气的装置有(填标号)。(2)、步骤①中先通氨气的目的是 , 步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为 , 步骤③中最适宜的加热方式为(填标号)。
(1)、盛放无水氯化钙的仪器名称是 , 图乙中可用来制取氨气的装置有(填标号)。(2)、步骤①中先通氨气的目的是 , 步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为 , 步骤③中最适宜的加热方式为(填标号)。a水浴加热 b.油浴加热 c.酒精灯直接加热
(3)、生成NaN3的化学方程式为。(4)、反应结束后,进行以下操作,得到NaN3固体(NaNH2能与水反应生成NaOH和氨气)。
操作II的目的是 , 操作IV最好选用的试剂是。