高考二轮复习知识点:除杂1
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 完成下述实验,装置或试剂不正确的是( )
实验室制
实验室收集
验证易溶于水且溶液呈碱性
除去中混有的少量
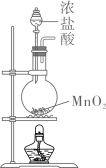
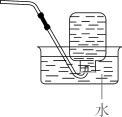
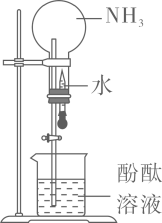
 A、 B、 C、 D、2. 实验室进行粗盐提纯时,需除去 和 ,所用试剂包括 以及( )A、 B、 C、 D、3. 实验室用 和浓盐酸反应生成 后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是( )A、
A、 B、 C、 D、2. 实验室进行粗盐提纯时,需除去 和 ,所用试剂包括 以及( )A、 B、 C、 D、3. 实验室用 和浓盐酸反应生成 后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是( )A、 B、
B、 C、
C、 D、
D、 4. 下列气体去除杂质的方法中,不能实现目的的是( )
4. 下列气体去除杂质的方法中,不能实现目的的是( )气体(杂质)
方法
A
SO2(H2S)
通过酸性高锰酸钾溶液
B
Cl2(HCl)
通过饱和的食盐水
C
N2(O2)
通过灼热的铜丝网
D
NO(NO2)
通过氢氧化钠溶液
A、A B、B C、C D、D5. 除去括号中的杂质适宜用NaOH溶液的是A、溴苯(溴) B、碳酸氢钠(碳酸钠) C、乙酸乙酯(乙酸) D、氧化铝(氧化铁)6. 除去下列物质中所含的少量杂质(括号内为杂质),所用除杂试剂合理的是A、FeCl3溶液(CuCl2)铁粉 B、C2H6(C2H4):H2/催化剂 C、CO2(SO2):酸性高锰酸钾溶液 D、乙醛(乙酸):饱和碳酸钠溶液7. 制备下列物质过程中,净化除杂的有关操作(括号内是杂质)其中正确的是A、C2H4(SO2)——气体通过盛有溴水的洗气瓶 B、CH3COOC2H5(CH3COOH)——用饱和Na2CO3溶液洗涤 C、Cl2(HCl)——通过水洗,再干燥 D、NH3(H2O)——浓H2SO4洗气8. 要除去溶液中少量的 , 可行的方法是( )A、滴入溶液 B、通入氯气 C、加入适量铜粉并过滤 D、加入适量铁粉并过滤9. 使用过量NaOH溶液能满足实验要求的是( )A、除去Al2O3中杂质Fe2O3 B、由AlCl3溶液制备Al(OH)3 C、除去C2H5Br中杂质Br2 D、检验醛基时制备新制Cu(OH)210. 为除去溶液中的下列杂质,所选用的试剂正确的是( )选项
杂质
试剂
A
适量的NaOH溶液
B
NaOH
适量的溶液
C
NaCl
适量的盐酸
D
适量的溶液
A、A B、B C、C D、D11. 下列物质除杂方法错误的是A、除去Fe3+溶液中的少量Al3+:用过量的氨水除去 B、除去CO2中混有的H2S:通入CuSO4溶液除去 C、除去CuCl2溶液中混有的少量FeCl3:向混合溶液中加入足量CuO D、除去NO中的NO2:将混合气体通入水中12. 下列除杂方案错误的是选项
被提纯的物质
杂质
除杂试剂
除杂方法
A
乙酸乙酯
乙酸
氢氧化钠
分液
B
MgCl2(aq)
Fe3+(aq)
MgO(s)
过滤
C
CO2(g)
SO2(g)
饱和NaHCO3、浓H2SO4
洗气
D
Na2CO3(s)
NaHCO3(s)
/
加热
A、A B、B C、C D、D13. 下列除杂试剂选用正确且除杂过程涉及氧化还原反应的是选项
物质(括号内为杂质)
除杂试剂
A
()
饱和溶液
B
()
盐酸、NaOH溶液、
C
()
无水
D
溴苯()
NaOH溶液
A、A B、B C、C D、D14. 除杂和配制试剂是中学化学中常见的实验。对实验方法描述正确的是A、通过加热蒸发、冷却结晶、过滤洗涤除去中少量的 B、用加入溶液并分液的方法除去乙酸乙酯中少量的乙酸 C、称取 , 配制的溶液 D、在10%的溶液中滴入3滴2%的溶液,配制检验醛基的试剂15. 下列气体去除杂质的方法中,达不到实验目的的是选项
气体(杂质)
方法
A
乙烷(乙烯)
通过溴水
B
通过足量蒸馏水
C
通过饱和碳酸氢钠溶液
D
通过盛有碱石灰的干燥管
A、A B、B C、C D、D16. 化学是以实验为基础的科学。下列实验设计正确的是( )选项
实验目的
实验设计
A
除去乙酸乙酯中的乙酸
加入NaOH溶液,振荡后分液
B
验证非金属性:O>S
向溶液中通入 , 观察溶液变浑浊
C
由溶液制备无水
将溶液加热蒸干
D
配制100mL一定物质的量浓度的NaOH溶液
准确称取NaOH固体,放入100mL的容量瓶中,加水溶解,振荡摇匀,定容
A、A B、B C、C D、D17. 下列为除去括号内的杂质而选用的除杂试剂对应正确的是( )选项
主要物质(杂质)
除杂试剂
A
FeCl2溶液(FeCl3)
H2O2
B
CO2(CO)
饱和NaHCO3溶液
C
Fe2O3(Al2O3)
NaOH溶液
D
Na2CO3固体(NaHCO3)
HCl溶液
A、A B、B C、C D、D18. 下列物质除杂的过程中,不能实现目的的是( )A
B
C
D
物质(杂质)
()
碳粉()
乙酸(乙醇)
硝基苯()
除杂试剂
溶液
浓盐酸
新制CaO
NaOH溶液
除杂方法
洗气
加热后过滤
蒸馏
分液
A、A B、B C、C D、D19. 下列除去杂质的方法中,所用试剂不能达到目的的是( )物质(杂质)
除杂试剂
A
FeCl2溶液(FeCl3)
Fe粉
B
Cl2(HCl)
饱和的食盐水
C
NaCl溶液(CaCl2)
Na2CO3溶液、HCl溶液
D
CH2=CH2 (SO2)
酸性高锰酸钾溶液
A、A B、B C、C D、D20. 为提纯下列物质(括号内为杂质),所选用的试剂和除杂方法都正确的是( )选项
被提纯物质
除杂试剂
操作
A
乙烯(甲烷)
溴水
洗气
B
溴苯(溴)
CCl4
萃取
C
乙醇(乙酸)
金属钠
蒸馏
D
淀粉溶液(葡萄糖)
——
渗析
A、A B、B C、C D、D21. 除去下列物质中的杂质,所选试剂与分离方法均能达到目的的是( )物质(杂质)
除杂试剂
分离方法
A
NaCl(aq)(I2)
CCl4
分液
B
C2H5OH(CH3COOH)
NaOH(aq)
蒸馏
C
HCl(Cl2)
饱和食盐水
洗气
D
CaSO4(CaCO3)
稀硫酸
过滤
A、A B、B C、C D、D22. 实验室中对下列气体洗气除杂的方法可行的是( )气体(杂质)
通过除杂试剂
A
C2H4(SO2)
酸性高锰酸钾溶液
B
NH3(H2O)
无水氯化钙
C
Cl2(HCl)
饱和食盐水
D
NO(HCl)
饱和NaHCO3溶液
A、A B、B C、C D、D23. 下列气体去除杂质的方法中,达不到实验目的的是( )选项
气体(杂质)
方法
A
Cl2(HCl)
通过饱和的食盐水
B
N2(O2)
通过足量灼热的铜丝网
C
SO2(CO2)
通过饱和的碳酸氢钠溶液
D
NH3(H2O)
通过盛有碱石灰的干燥管
A、A B、B C、C D、D24. 提纯下列物质(括号内物质为杂质)的方案中,不能达到目的的是( )物质
除杂试剂
除杂和分离方法
①
CO(SO2)
NaOH溶液
洗气
②
CH3COOCH2CH3(CH3COOH)
饱和Na2CO3溶液
分液
③
CuO(Al2O3)
NaOH溶液
过滤
④
乙醇(水)
苯
分液
A、① B、② C、③ D、④25. 下列物质的除杂实验中,不能实现除杂目的的是( )选项
物质(杂质)
除杂实验
A
CH3COOC2H5(CH3COOH)
加入饱和Na2CO3溶液充分振荡,分液、洗涤、干燥
B
KNO3(NaCl)
加AgNO3溶液,过滤,洗涤
C
Na2CO3 (NaHCO3)
加热分解
D
C2H5OH(H2O)
加CaO充分混合,蒸馏
A、A B、B C、C D、D26. 除去下列物质中含有的少量杂质(括号内为杂质),所用除杂试剂合理的是( )A、溶液 B、催化剂 C、溶液():铁粉 D、:饱和溶液27. 下列气体去除杂质的方法中,能实现目的的是( )气体(杂质)
方法
A
SO2(HCl)
通过饱和亚硫酸钠溶液
B
O2(NH3)
通过浓硫酸
C
CO(CO2)
通过氯化钡溶液
D
Cl2(H2O)
通过过氧化钠固体
A、A B、B C、C D、D28. 对固体直接加热可除去杂质是(括号内为杂质)( )A、铁粉(硫粉) B、 C、 D、29. 下列物质除杂的过程中,不能实现目的的是( )原物(杂质)
除杂试剂
除杂方法
A
CO2(H2S)
CuSO4溶液
洗气
B
碳粉(MnO2)
浓盐酸
加热后过滤
C
乙酸(乙醇)
饱和Na2CO3溶液
蒸馏
D
硝基苯(NO2)
NaOH溶液
分液
A、A B、B C、C D、D30. 用下列装置进行相应实验,能达到实验目的的是( )A
B
C
D




验证非金属性:S>C>Si
实验室制乙烯
蒸发结晶获得晶体FeSO4·7H2O
用于除去气体中的杂质
A、A B、B C、C D、D31. 除去下列物质中的杂质(括号内为杂质),可采用加入过量NaOH溶液充分反应后,再用过滤方法分离的是( )A、AlCl3溶液(FeCl3) B、Na2CO3溶液(NaHCO3) C、Fe2O3固体(Al2O3) D、NaCl溶液(MgCl2)32. 表中是有关物质的溶解度(20℃),下列说法正确的是( )物质
CaCl2
Ca(OH)2
CaCO3
溶解度(g/100g)
74.5
0.165
0.0013
A、除去粗盐中含有的CaCl2杂质,最佳除杂试剂为NaOH溶液 B、0.1mol的Ca(OH)2和0.1molCaCO3混合加入1L水中,所得溶液中:c(OH-)>c(Ca2+)>c(CO) C、将CaCl2、Ca(OH)2、CaCO3三种物质和水混合,加热、灼烧,最终的固体产物相同 D、用足量的NaOH溶液与Ca(HCO3)2 , 发生的离子方程式式为:4OH-+Ca2++2HCO=Ca(OH)2↓+2CO+2H2O33. 用下列实验装置进行相应实验,能达到实验目的的是( )A、快速制备少量NH3 B、除去Na2CO3中的NaHCO3
B、除去Na2CO3中的NaHCO3 C、制取并收集一定Cl2
C、制取并收集一定Cl2 D、乙醇加热条件下能还原氧化铜
D、乙醇加热条件下能还原氧化铜 34. 实验室若采用如图装置制备气体并除去杂质,有关设计方案合理的是( )
34. 实验室若采用如图装置制备气体并除去杂质,有关设计方案合理的是( )
制备原理
除杂试剂(杂质)
A
CaCO3和盐酸制CO2
饱和NaHCO3溶液(HCl)
B
MnO2和浓盐酸制Cl2
饱和食盐水(HCl)
C
Na2SO3和硝酸制SO2
饱和NaHSO3溶液(HNO3)
D
浓氨水和烧碱制NH3
碱石灰(H2O)
A、A B、B C、C D、D二、非选择题
-
35. 乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:

水杨酸
醋酸酐
乙酰水杨酸
熔点/℃
157~159
-72~-74
135~138
相对密度/(g·cm﹣3)
1.44
1.10
1.35
相对分子质量
138
102
180
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右,充分反应。稍冷后进行如下操作.
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)、该合成反应中应采用__________加热。(填标号)A、热水浴 B、酒精灯 C、煤气灯 D、电炉(2)、下列玻璃仪器中,①中需使用的有(填标号),不需使用的(填名称)。 (3)、①中需使用冷水,目的是。(4)、②中饱和碳酸氢钠的作用是 , 以便过滤除去难溶杂质。(5)、④采用的纯化方法为。(6)、本实验的产率是%。
(3)、①中需使用冷水,目的是。(4)、②中饱和碳酸氢钠的作用是 , 以便过滤除去难溶杂质。(5)、④采用的纯化方法为。(6)、本实验的产率是%。