高考二轮复习知识点:物质的分离与提纯8
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 下列分离方法正确的是( )A、回收水溶液中的I2 :加入乙酸,分液,蒸发 B、回收含有KCl的MnO2:加水溶解,过滤,干燥 C、除去氨气中的水蒸气:通过盛有P2O5的干燥管 D、除去乙醇中的水,加入无水氯化钙,蒸馏。2. 超临界状态下的CO2流体溶解性与有机溶剂相似,可提取中药材的有效成分,工艺流程如下。

下列说法中错误的是( )
A、浸泡时加入乙醇有利于中草药有效成分的浸出 B、高温条件下更有利于超临界CO2流体萃取 C、升温、减压的目的是实现CO2与产品分离 D、超临界CO2流体萃取中药材具有无溶剂残留、绿色环保等优点3. 以混有 的 为原料制备氧化镁的实验流程如图:
下列说法错误的是( )
A、酸浸的离子方程式为 B、浸出渣的成分是 C、母液的主要溶质是 D、固体X是4. 柠檬酸铁铵是一种常见的补铁剂,其制备流程如下: 已知: 、 ;柠檬酸亚铁微溶于冷水,易溶于热水。
已知: 、 ;柠檬酸亚铁微溶于冷水,易溶于热水。下列说法正确的是( )
A、步骤①制备FeCO3时,应将FeSO4溶液加入Na2CO3溶液中 B、可用KSCN溶液检验步骤③中柠檬酸亚铁是否反应完全 C、步骤③控制温度50℃~60℃既利于柠檬酸亚铁溶解,又避免温度过高造成H2O2分解 D、步骤⑤系列操作包括冷却结晶、过滤、洗涤、干燥5. 某闪锌矿的主要成分为ZnS,还含有SiO2、FeS2等,利用该闪锌矿制备皓钒(ZnSO4·7H2O)的工艺流程如下图所示。
下列说法错误的是( )
A、“破碎”可加快“煅烧”速率,并使反应更充分 B、“废气”合理处理可用于工业制硫酸 C、“滤渣”的主要成分为Fe2O3 , 可用于冶炼铁 D、“一系列操作”包括蒸发浓缩、冷却结晶、过滤等6. 硒(Se)是一种新型半导体材料,对富硒废料(含Ag2Se、Cu2S)进行综合处理的一种工艺流程如下图:下列说法错误的是( ) A、合理处理富硒废料符合循环经济理念。 B、母液可在“酸溶”工序循环利用 C、“滤液”经处理可制得胆矾 D、“吸收”时氧化剂与还原剂物质的量之比为1:17. 锑白(Sb2O3)为白色粉末,不溶于水,溶于酸和强碱,主要用于制备白色颜料、油漆等。一种利用锑矿粉(主要成分为Sb2S3、SiO2)制取锑白的流程如下。
A、合理处理富硒废料符合循环经济理念。 B、母液可在“酸溶”工序循环利用 C、“滤液”经处理可制得胆矾 D、“吸收”时氧化剂与还原剂物质的量之比为1:17. 锑白(Sb2O3)为白色粉末,不溶于水,溶于酸和强碱,主要用于制备白色颜料、油漆等。一种利用锑矿粉(主要成分为Sb2S3、SiO2)制取锑白的流程如下。
已知:浸出液中的阳离子主要为Sb3+、Fe3+、Fe2+。
下列说法错误的是( )
A、“浸出”时发生的反应为Sb2S3+6Fe3+=2Sb3++6Fe2++3S B、可以用KSCN溶液检验“还原”反应是否完全 C、“滤液”中通入Cl2后可返回“浸出”工序循环使用 D、“中和”时可用过量的NaOH溶液代替氨水8. 以硅石(SiO2)和萤石(CaF2)为原料制备冰晶石(Na3AlF6)的一种流程如图:
已知:无水氟硅酸(H2SiF6)为易溶于水、不稳定的强酸;滤渣2的主要成分为Na2SiF6。
下列说法错误的是( )
A、硅石和萤石需预先研磨目的是加快反应速率 B、“反应Ⅲ”应该在陶瓷器皿中进行 C、滤液1、滤液2经浓缩处理后可在流程中循环利用 D、“反应Ⅳ”的化学方程式为2NaF+4NH4F+NaAlO2+2H2O=Na3AlF6↓+4NH3·H2O9. 利用钛铁矿(主要成分为FeTiO3 , 含有少量MgO、SiO2等杂质)制备LiFePO4的工艺流程如图所示: 已知:钛铁矿经盐酸浸取后钛主要以 形式存在, 、 。下列说法错误的是( )A、钛铁矿经盐酸浸取后过滤,滤渣的主要成分为SiO2 B、“过滤③”之前[设此时 ],使Fe3+恰好沉淀完全[即 ],此时不会有 沉淀生成 C、“高温煅烧”的主要反应为 D、LiFePO4缺失部分Li+则形成 ,若 ,则 中10. 工业上可用软锰矿(含少量铜化合物的MnO2)和黄铁矿(主要成分是FeS2、SiO2等)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工艺流程如图:
已知:钛铁矿经盐酸浸取后钛主要以 形式存在, 、 。下列说法错误的是( )A、钛铁矿经盐酸浸取后过滤,滤渣的主要成分为SiO2 B、“过滤③”之前[设此时 ],使Fe3+恰好沉淀完全[即 ],此时不会有 沉淀生成 C、“高温煅烧”的主要反应为 D、LiFePO4缺失部分Li+则形成 ,若 ,则 中10. 工业上可用软锰矿(含少量铜化合物的MnO2)和黄铁矿(主要成分是FeS2、SiO2等)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工艺流程如图:
下列说法错误的是( )
A、研磨矿石、适当升高温度均可提高溶浸工序中原料的浸出率 B、溶浸工序产生的废渣成分为S;净化工序产生的废渣成分为CaF2 C、除铁工序中,试剂的加入顺序是先加软锰矿,再加石灰调节溶液pH D、从沉锰工序中得到纯净MnCO3的操作方法是过滤、洗涤、干燥11. 铋 与氮同主族,在中性及碱性环境下常以 的形式存在,铋及其化合物广泛应用于电子、医药等领域。以辉铋矿(主要成分为 ,含少量杂质 等)为原料,采用湿法冶金制备精铋工艺流程如下,下列说法错误的是( ) A、“浸出”产生S的主要离子反应为 B、“浸出”时盐酸可以还原杂质PbO2 C、“浸出、置换、再生、电解精炼”工序中不全是氧化还原反应 D、再生液可以加入“浸出”操作中循环利用12. SO2虽是大气污染物之一,但也是重要的工业原料。某研究小组利用软锰矿(主要成分为MnO2 , 另含有少量铁、铝、铜、镍等金属化合物)作燃煤尾气脱硫剂,简化流程如图所示。下列说法错误的是( )
A、“浸出”产生S的主要离子反应为 B、“浸出”时盐酸可以还原杂质PbO2 C、“浸出、置换、再生、电解精炼”工序中不全是氧化还原反应 D、再生液可以加入“浸出”操作中循环利用12. SO2虽是大气污染物之一,但也是重要的工业原料。某研究小组利用软锰矿(主要成分为MnO2 , 另含有少量铁、铝、铜、镍等金属化合物)作燃煤尾气脱硫剂,简化流程如图所示。下列说法错误的是( ) A、软锰矿浆吸收SO2反应的主要离子方程式为MnO2+SO2=Mn2++SO B、MnS除铜镍过程是将Cu2+转化为Cu2S,Ni2+转化为NiS C、SO2是大气污染物,也是葡萄酒生产中普遍应用的添加剂 D、该流程既脱除燃煤尾气中的SO2 , 又制得电池材料MnO2 , 达到变废为宝的目的13. 化工行业常用硒(Se)作催化剂,该催化剂具有反应条件温和、成本低、环境污染小、用后处理简便等优点。以铜阳极泥(主要成分为Cu2Se、Ag2Se,还含有少量Ag、Au、Pt等)为原料制备纯硒的工艺流程如图。
A、软锰矿浆吸收SO2反应的主要离子方程式为MnO2+SO2=Mn2++SO B、MnS除铜镍过程是将Cu2+转化为Cu2S,Ni2+转化为NiS C、SO2是大气污染物,也是葡萄酒生产中普遍应用的添加剂 D、该流程既脱除燃煤尾气中的SO2 , 又制得电池材料MnO2 , 达到变废为宝的目的13. 化工行业常用硒(Se)作催化剂,该催化剂具有反应条件温和、成本低、环境污染小、用后处理简便等优点。以铜阳极泥(主要成分为Cu2Se、Ag2Se,还含有少量Ag、Au、Pt等)为原料制备纯硒的工艺流程如图。
已知:①“净化除杂”时采用真空蒸馏的方法提纯硒(沸点为685℃);
②焙烧后,Cu、Ag均以硫酸盐形式存在, ;
③“浸出液”中溶质的饱和浓度不小于0.01 。
下列说法错误的是( )
A、“加硫酸并焙烧”时使用的硫酸应为浓硫酸 B、“水吸收”过程得到的溶液呈酸性 C、在实验室蒸馏时,需要用到直形冷凝管 D、“浸出液”中的溶质成分不可能含有Ag2SO414. 以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe3SO4)2(OH)6]和纳米镍粉的部分工艺流程如图:
已知:Fe3+在pH约为3.7时可完全转化为Fe(OH)3 , Fe2+在pH约为9时可完全转化为Fe(OH)2
下列说法错误的是( )
A、“滤渣”的主要成分是SiO2 B、为提高镍、铁元素的利用率,可将“过滤I”的滤液和滤渣洗涤液合并 C、“氧化”过程发生的离子方程式为2H++2Fe2++ClO-=2Fe3++Cl-+H2O D、“沉铁”过程中加入碳酸钠的作用是调节溶液的酸碱度,应将pH控制在3.7~9二、多选题
-
15. 如图是以一种以绿柱石(主要含有BeO、 、 、 和FeO等)为原料制取单质铍的工艺流程。已知常温下, 在pH>10时会溶解。下列相关说法错误的是( )
 A、“除铁”过程应先加适量 ,再加适量氨水调节pH B、“沉铍”过程中,氨水也可改用过量的NaOH溶液 C、其中“分解”过程中发生的反应之一可表示为 D、用镁热还原法制取铍时Ar气可以改为
A、“除铁”过程应先加适量 ,再加适量氨水调节pH B、“沉铍”过程中,氨水也可改用过量的NaOH溶液 C、其中“分解”过程中发生的反应之一可表示为 D、用镁热还原法制取铍时Ar气可以改为三、非选择题
-
16. 苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
 +KMnO4→
+KMnO4→ 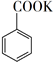 + MnO2
+ MnO2  +HCl→
+HCl→  +KCl
+KCl名称
相对分
子质量
熔点/℃
沸点/℃
密度/(g·mL−1)
溶解性
甲苯
92
−95
110.6
0.867
不溶于水,易溶于乙醇
苯甲酸
122
122.4(100℃左右开始升华)
248
——
微溶于冷水,易溶于乙醇、热水
实验步骤:①在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
②停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
③纯度测定:称取0. 122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25. 00 mL溶液,用0.01000 mol·L−1的KOH标准溶液滴定,三次滴定平均消耗21. 50 mL的KOH标准溶液。
回答下列问题:
(1)、根据上述实验药品的用量,三颈烧瓶的最适宜规格为______(填标号)。A、100 mL B、250 mL C、500 mL D、1000 mL(2)、在反应装置中应选用冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是。(3)、加入适量饱和亚硫酸氢钠溶液的目的是;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理。(4)、“用少量热水洗涤滤渣”一步中滤渣的主要成分是。(5)、干燥苯甲酸晶体时,若温度过高,可能出现的结果是。(6)、本实验制备的苯甲酸的纯度为;据此估算本实验中苯甲酸的产率最接近于(填标号)。A.70% B.60% C.50% D.40%
(7)、若要得到纯度更高的苯甲酸,可通过在水中的方法提纯。17. 乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
水杨酸
醋酸酐
乙酰水杨酸
熔点/℃
157~159
-72~-74
135~138
相对密度/(g·cm﹣3)
1.44
1.10
1.35
相对分子质量
138
102
180
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右,充分反应。稍冷后进行如下操作.
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)、该合成反应中应采用__________加热。(填标号)A、热水浴 B、酒精灯 C、煤气灯 D、电炉(2)、下列玻璃仪器中,①中需使用的有(填标号),不需使用的(填名称)。 (3)、①中需使用冷水,目的是。(4)、②中饱和碳酸氢钠的作用是 , 以便过滤除去难溶杂质。(5)、④采用的纯化方法为。(6)、本实验的产率是%。18. 碱式硫酸铝溶液可用于烟气脱硫。室温下向一定浓度的硫酸铝溶液中加入一定量的碳酸钙粉末,反应后经过滤得到碱式硫酸铝溶液,反应方程式为
(3)、①中需使用冷水,目的是。(4)、②中饱和碳酸氢钠的作用是 , 以便过滤除去难溶杂质。(5)、④采用的纯化方法为。(6)、本实验的产率是%。18. 碱式硫酸铝溶液可用于烟气脱硫。室温下向一定浓度的硫酸铝溶液中加入一定量的碳酸钙粉末,反应后经过滤得到碱式硫酸铝溶液,反应方程式为(2−x)Al2(SO4)3+3xCaCO3+3xH2O=2[(1−x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
生成物(1−x)Al2(SO4)3·xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率。
(1)、制备碱式硫酸铝溶液时,维持反应温度和反应时间不变,提高x值的方法有。(2)、碱式硫酸铝溶液吸收SO2过程中,溶液的pH(填“增大”、“减小”、“不变”)。(3)、通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入0.1000 mol·L−1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L−1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1−x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。
19. 3,4−亚甲二氧基苯甲酸是一种用途广泛的有机合成中间体,微溶于水,实验室可用KMnO4氧化3,4−亚甲二氧基苯甲醛制备,其反应方程式为
实验步骤如下:
步骤1:向反应瓶中加入3,4−亚甲二氧基苯甲醛和水,快速搅拌,于70~80 ℃滴加KMnO4溶液。反应结束后,加入KOH溶液至碱性。
步骤2:趁热过滤,洗涤滤饼,合并滤液和洗涤液。
步骤3:对合并后的溶液进行处理。
步骤4:抽滤,洗涤,干燥,得3,4−亚甲二氧基苯甲酸固体。
(1)、步骤1中,反应结束后,若观察到反应液呈紫红色,需向溶液中滴加NaHSO3溶液, 转化为(填化学式);加入KOH溶液至碱性的目的是。(2)、步骤2中,趁热过滤除去的物质是(填化学式)。(3)、步骤3中,处理合并后溶液的实验操作为。(4)、步骤4中,抽滤所用的装置包括、吸滤瓶、安全瓶和抽气泵。20. 某化工厂产生的铋渣,主要成分为Bi2O3、PbO、CuO、Sb2O3 , 按如下流程回收Bi和Cu。
已知:Sb2O3难溶于H2SO4;Bi2Oз+2H2SO4=2Bi(OH)SO4↓+H2O。
回答下列问题:
(1)、“粉碎”的目的是。(2)、①若氧化剂为H2O2 , 溶解Cu2O反应的离子方程式为;②温度对铜浸出率的影响如图所示。

工业浸出时一般选择70℃~80℃,温度过低时铜浸出率低的原因是;
(3)、“操作I”为减压过滤。与常压过滤比较,其优点是;(4)、①“浸出渣II”的主要成分是SbOCl、;②写出SbCl3水解生成SbOCl的化学方程式:;
(5)、“铜浸出液”用如图旋流式电解装置电解。
①钛涂层柱的电极反应式是;
②若“铜浸出液”中含铜92.16g·L-1 , 选择合适条件进行旋流电解。取电解后溶液25.00mL,加入足量KI溶液充分反应,以淀粉为指示剂,用0.1000mol·L-1的标准液Na2S2O3滴定,反应为:2Cu2++4I-=2CuI↓+I2、I2+2 =2I-+ ,消耗18.00mL标准液。旋流电解铜回收率是。(用质量分数表示,保留一位小数)。
21. 碘酸钙[Ca(IO3)2]是广泛使用的既能补钙又能补碘的新型食品添加剂,不溶于乙醇,在水中的溶解度随温度降低而减小。实验室制取Ca(IO3)2的流程如图所示:
已知:碘酸(HIO3)是易溶于水的强酸,不溶于有机溶剂。
(1)、实验流程中“转化”步骤是为了制得碘酸,该过程在如图所示的装置中进行。
①当观察到三颈瓶中现象时,停止通入氯气。
②“转化”时发生反应的离子方程式为。
(2)、“分离”时用到的玻璃仪器有烧杯、。(3)、采用冰水浴的目的是。(4)、有关该实验说法正确的是______。A、适当加快搅拌速率可使“转化”时反应更充分 B、“调pH=10”后的溶液中只含有KIO3和KOH C、制得的碘酸钙可选用酒精溶液洗涤(5)、准确称取产品0.2500g,加酸溶解后,再加入足量KI发生反应IO +5I-+6H+=3I2+3H2O,滴入2~3滴淀粉溶液,用0.1000mol·L-1Na2S2O3溶液滴定(I2+2S2O =2I-+S4O )至终点,消耗Na2S2O3溶液30.00mL。达滴定终点时的现象是 , 产品中Ca(IO3)2的质量分数为。[已知Ca(IO3)2的摩尔质量:390g·mol-1]。22. MnO2是重要的化工原料,由软锰矿(主要成分为MnO2 , 还含有少量Fe3O4、Al2O3和SiO2等杂质)和硫化锰(MnS)制备精MnO2的一种工艺流程如图:
已知:相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
Fe3+
Al3+
Mn2+
Fe2+
开始沉淀时
1.5
3.4
5.8
6.3
完全沉淀时
2.8
4.7
7.8
8.3
回答下列问题:
(1)、“滤渣1”中含有未反应完全的矿粉、S和。(2)、“纯化”时加MnO2的作用是 , 假定溶液中c(Mn2+)=0.1mol·L-1 , 则加入氨水调节溶液pH的范围为。(3)、“沉锰”时生成MnCO3 , 工业上不直接用Na2CO3溶液来沉锰的原因为。(4)、“热分解”后所得物质中还有少量MnO,需进一步进行氧化,“氧化”时生成的气体2为氯气,写出该过程中发生反应的化学方程式。(5)、操作x为。(6)、工业上还可用电解“Mn2+纯化液”来制取MnO2 , 其阳极电极反应式为。电解后的废水中还含有少量Mn2+ , 常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S进行二级沉降。已知Ksp(MnS)=2.5×10-10 , 欲使溶液中c(Mn2+)≤1.0×10-5mol·L-1 , 则应保持溶液中c(S2-)≥mol·L-1。23. 利用某冶金行业产生的钒炉渣(主要含V2O3及少量SiO2、P2O5等杂质)可以制备氧钒碱式碳酸铵晶体[(NH4)5(VO)6(CO3)4(OH)9·10H2O],其生产流程如图:
已知:V2O5微溶于水,可溶于碱生成VO 。向Na3VO4溶液中加酸,不同pH对应的主要存在形式如表:
pH
≥13
10.6~12
约8.4
3~8
约2
<1
存在形式
VO
V2O
V3O
V10O
V2O5
VO
回答下列问题:
(1)、“焙烧”后V元素转化为NaVO3 , 该反应的化学方程式为。(2)、欲除去磷元素[使c(PO )≤1.0×10-6mol·L-1],则应控制溶液中Mg2+浓度至少为mol·L-1(已知Ksp[Mg3(PO4)2]=1.0×10-24)。此时Si元素转化为(写化学式)。(3)、“沉钒”的作用为 , “沉钒”需要控制pH约为。(4)、“还原”过程中,生成VOSO4和一种常温下无色无味的气体化合物,该反应的离子方程式为。用浓盐酸与V2O5反应也可以制得VO2+ , 该方法的缺点是。24. 下图1为从铜转炉烟火[主要含有ZnO,还有少量的Fe(II)、Pb、Cu、As元素]制取活性氧化锌的流程。请回答以下问题:
已知:①活性炭主要吸附有机质;②25℃时, ;③氨体系环境中锌元素以 形式存在;④部分金属离子开始沉淀和完全沉淀的pH:
金属离子
开始沉淀pH
1.9
7.0
4.5
8.1
完全沉淀pH
3.2
9.0
6.4
10.1
(1)、 中Pb的化合价为。(2)、题中所列铜转炉烟灰所含主要元素中有种非主族元素,画出 的原子结构示意图。(3)、浸取温度为50℃,反应时间为1h时,测定各元素的浸出率与氯化铵溶液浓度的关系如图2,则氯化铵最适宜的浓度为 。 (4)、加入适量 溶液的目的是除去铁元素的同时溶液中不会有明显的锰元素残留,写出除铁步骤的离子方程式: , 常温下此时体系中 残留最大浓度为 。(5)、“滤渣Ⅲ”的主要成分为(填化学式)。(6)、“沉锌”反应的离子方程式为。25. 铍可应用于飞机、火箭制造业和原子能工业。素有“中国铍业一枝花”之称的湖南水口山六厂改进国外生产工艺,以硅铍石(主要成分为 、 、 、 、 )为原料提取铍,具体流程如下:
(4)、加入适量 溶液的目的是除去铁元素的同时溶液中不会有明显的锰元素残留,写出除铁步骤的离子方程式: , 常温下此时体系中 残留最大浓度为 。(5)、“滤渣Ⅲ”的主要成分为(填化学式)。(6)、“沉锌”反应的离子方程式为。25. 铍可应用于飞机、火箭制造业和原子能工业。素有“中国铍业一枝花”之称的湖南水口山六厂改进国外生产工艺,以硅铍石(主要成分为 、 、 、 、 )为原料提取铍,具体流程如下:
已知:①铍和铝在元素周期表中处于对角线位置,电负性相近,其单质及化合物在结构与性质等方面具有相似性。
②铝铵钒在不同温度下的溶解度:
温度/℃
0
10
20
30
40
60
溶解度/g
2.10
5.00
7.74
10.9
14.9
26.7
回答下列问题:
(1)、流程中“系列操作”为。(2)、将“中和液”沉淀时,调节溶液的 不能过大或过小。 过大时发生反应的离子方程式为。(3)、已知 , 。若 浓度为0.40 的中和液开始沉淀时,溶液中 。(4)、若在实验室洗涤粗 ,操作为;洗涤时加入 溶液除去表面吸附的少量氢氧化铝,反应的离子方程式为。(5)、氧化铍转化为氯化铍的化学方程式为。(6)、 的电子式为;电解时须加入氯化钠的作用是。26. 高纯镓是用来制作光学玻璃、真空管、半导体的重要原料。工业上由锌粉置换渣(主要成分有Ga2O3、Ga2S3、ZnS、FeO、Fe2O3、SiO2 , 还有部分锗元素)制备高纯镓的主要流程如图:
已知:①镓与铝性质相似;
②不同的萃取剂对微粒的选择性不同,N235型萃取剂优先萃取铁;P204+YW100协萃体系优先萃取离子的顺序是:Ge(Ⅳ)>Fe(Ⅲ)>Ga(Ⅲ)>Fe(Ⅱ)>Zn(Ⅱ)。
回答下列问题:
(1)、二段浸出渣的成分是S和(填化学式),富氧浸出时通入氧气的作用是 , 进行两段富氧浸出的目的是。(2)、N235萃取和P204+YW100萃取的顺序不可以调换,说明原因。(3)、中和沉镓时发生反应的离子反应方程式为 , 选用Na2CO3中和沉镓优于选用NaOH的原因是。(4)、生成粗镓的电极反应式为。(5)、一定温度下,影响Fe3+在N235型萃取剂中溶解度大小的主要因素是 , 真空蒸馏采用真空的原因是。27. 用锑砷烟灰(主要成分为Sb2O3、As2O3 , 含Pb、Ag、Cu等元素)制取焦锑酸钠[NaSb(OH)6]和砷酸钠(Na3AsO4),不仅治理了砷害污染,还可综合回收其它有价金属。其工艺流程如图所示:
已知:
①Ag、Cu、Fe的氧化物不溶于Na2S溶液
②硫浸后,锑砷以Na3SbS3、Na3AsS3存在;
③NaSb(OH)6易溶于热水,难溶于冷水,不溶于乙醇。
回答下列问题:
(1)、“硫浸”时,Sb2O3溶解的离子方程式为。(2)、用NaNO3和NaOH浸取锑砷烟灰也可得到Na3SbO4 , 其缺陷是。(3)、“氧化”时所用H2O2的电子式为 , 反应温度不宜太高的原因是。(4)、“中和”时,生成NaSb(OH)6的化学方程式为 , 操作X为、过滤、洗涤、干燥。(5)、As2O3对应的酸为H3AsO3 , 测得某工业酸性废液中含H3AsO3和Fe2+ , 其浓度如表:物质
H3AsO3
Fe2+
浓度/g·L-1
0.378
0.840
已知:Ksp(FeAsO3)>Ksp(FeAsO4)=5.70×10-21 , H3AsO3的还原性比Fe2+强。
根据题目信息,则可采用方法除去该废水中的砷,除去砷后的废液中c(AsO )=mol·L-1(不考虑反应过程中溶液体积的微小变化)
28. 2020年6月比亚迪正式发布采用磷酸铁锂技术的刀片电池,大幅度提高了电动汽车的续航里程,可媲美特斯拉。以硫铁矿(主要成分是FeS2 , 含少量Al2O3、SiO2和Fe3O4)为原料制备LiFePO4的流程如下:
已知几种金属离子沉淀的pH如表所示:
金属氢氧化物
Fe(OH)3
Fe(OH)2
Al(OH)3
开始沉淀的pH
2.3
7.5
4.0
完全沉淀的pH
4.1
9.7
5.2
请回答下列问题:
(1)、“酸浸”需要适当加热,但温度不宜过高,其原因是。灼烧滤渣3得到固体的主要成分是(写出化学式)。(2)、用FeS还原Fe3+的目的是 , 加入FeO的作用是(用离子反应方程式表示)。(3)、试剂R宜选择 ___________(填字母)。A、高锰酸钾 B、稀硝酸 C、双氧水 D、次氯酸钠(4)、常温下,Ksp(FePO4)=1.3×10-22 , “沉铁”中为了使c(Fe3+)≤1×10-5 mol·L-1 , c(PO )最小为mol·L-1。(5)、写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式:。29. 重铬酸钾是一种重要的化工原料,一般由铬铁矿制备。铬铁矿的主要成分为FeO·Cr2O3 , 还含有硅、铝等杂质。制备流程如图所示:
回答下列问题:
(1)、步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比(最简整数比)为。该步骤不能使用陶瓷容器,原因是(用化学方程式表示)。(2)、滤渣1中含量最多的金属元素是(填写元素符号),设计实验方案验证滤渣1中经步骤①中反应后的产物。滤渣2的主要成分是(填写化学式)及含硅杂质。(3)、步骤④调滤液2的pH使之变(填“大”或“小”),原因是(用离子方程式和适当的文字表述说明)。(4)、有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。写出步骤⑤的化学反应方程式。 30. 锆(40Zr)是现代工业中重要的金属原料,具有良好的可塑性,其抗蚀性能强于钛。以锆英石(主要成分是ZrSiO4 , 还含有少量Al2O3、SiO2、Fe2O3等杂质)为原料生产错及其化合物的流程如图所示:
30. 锆(40Zr)是现代工业中重要的金属原料,具有良好的可塑性,其抗蚀性能强于钛。以锆英石(主要成分是ZrSiO4 , 还含有少量Al2O3、SiO2、Fe2O3等杂质)为原料生产错及其化合物的流程如图所示: (1)、分馏属于(填“物理变化”或“化学变化”)。(2)、锆英石(填“能”或“不能”)直接用稀盐酸浸取后再分馏,理由是。(3)、“高温气化”中ZrSiO4发生反应得到ZrCl4的反应的化学方程式为。(4)、流程中ZrCl4与水反应后经过滤、洗涤、干燥等操作可获得ZrOCl2·8H2O,检验该物质是否洗涤干净的实验操作为。(5)、工业上使用惰性电极电解K2ZrF6与KCl组成的熔盐来制取金属错。阳极上的电极反应式为 , 每转移0.4mole- , 理论上阴极增加的质重为。(6)、极稀溶液中溶质的物质的量浓度很小,常用其负对数pc(pcB=-lgcB)表示。某温度下Ksp[Zr(CO3)2]=4.0×10-12 , 则其饱和溶液中pc(Zr4+)+pc(CO )=。(已知lg2=0.3)31. 某实验小组以回收站回收的废铁制品(主要成分为 ,还含有少量的 和 )为原料制备 晶体。(1)、取 废铁制品,用质量分数为 的碳酸钠溶液浸泡一段时间,然后用倾析法倒去碳酸钠溶液,用蒸馏水洗涤2~3次,将洗涤好的废铁制品加入如图所示装置中,再加入 硫酸。控制温度在 之间,加热 ,将所得溶液趁热过滤、冷却结晶、过滤洗涤,得到 晶体。
(1)、分馏属于(填“物理变化”或“化学变化”)。(2)、锆英石(填“能”或“不能”)直接用稀盐酸浸取后再分馏,理由是。(3)、“高温气化”中ZrSiO4发生反应得到ZrCl4的反应的化学方程式为。(4)、流程中ZrCl4与水反应后经过滤、洗涤、干燥等操作可获得ZrOCl2·8H2O,检验该物质是否洗涤干净的实验操作为。(5)、工业上使用惰性电极电解K2ZrF6与KCl组成的熔盐来制取金属错。阳极上的电极反应式为 , 每转移0.4mole- , 理论上阴极增加的质重为。(6)、极稀溶液中溶质的物质的量浓度很小,常用其负对数pc(pcB=-lgcB)表示。某温度下Ksp[Zr(CO3)2]=4.0×10-12 , 则其饱和溶液中pc(Zr4+)+pc(CO )=。(已知lg2=0.3)31. 某实验小组以回收站回收的废铁制品(主要成分为 ,还含有少量的 和 )为原料制备 晶体。(1)、取 废铁制品,用质量分数为 的碳酸钠溶液浸泡一段时间,然后用倾析法倒去碳酸钠溶液,用蒸馏水洗涤2~3次,将洗涤好的废铁制品加入如图所示装置中,再加入 硫酸。控制温度在 之间,加热 ,将所得溶液趁热过滤、冷却结晶、过滤洗涤,得到 晶体。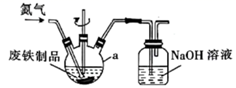
①仪器a的名称为。
②用纯碱浸泡的目的是 , 溶液的作用是。
③反应中需要控制温度在 之间,宜采用的方法是。
④用冰水洗涤 晶体的操作是 , 若将 晶体在隔绝空气条件下加热到 ,会生成红棕色固体,写出反应的化学方程式:。
(2)、若以赤铁矿渣(含有 和 杂质)为原料制备 晶体,请补充完整相应的实验方案:①取一定量的赤铁矿渣,分次加入足量的稀硫酸,充分反应后过滤。
②取滤液,。
③过滤、洗涤,将沉淀溶入 的硫酸中,同时加入过量铁粉,充分反应后,过滤,向滤液中加乙醇,在恒温水浴槽中冷却结晶、过滤,用丙酮洗涤、干燥。
已知:该实验中 时, 沉淀完全; 时, 开始沉淀。实验室现有试剂: 的 溶液、 的 溶液、铁粉。
(3)、通过下列方法测定产品纯度:准确称取 样品,加适量水溶解,配成 溶液,取 溶液置于锥形瓶中,用 的酸性 标准溶液滴定(杂质不与酸性 标准溶液反应),经3次测定,每次消耗 溶液的体积如表所示:实验序号
1
2
3
消耗 溶液的体积
19.98
20.58
20.02
通过计算确定产品中 的质量分数约为(保留三位有效数字)。
32. 钌( )为稀有元素,广泛应用于电子、航空航天、化工等领域。钌的矿产资源很少,故从含钌废料中回收钌的研究很有意义。某科研小组设计了一种从含钌废料中分离提纯钌的工艺,其流程如下: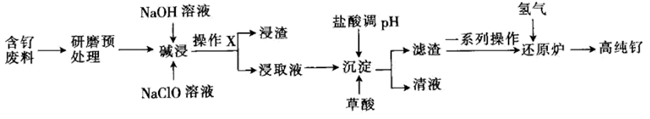 (1)、加碱浸取时,为提高钌的浸出率可采取的措施有(任写两点)。(2)、操作X的名称为。(3)、“研磨预处理”是将研磨后的含钌废料在氢气还原炉中还原为单质钌,再进行“碱浸”获得 ,写出“碱浸”时生成 的离子方程式:。(4)、“滤渣”的主要成分为 ,加入草酸的作用是 , 金属钌与草酸的质量比x和反应温度T对钌的回收率的影响如图所示,则回收钌较为适宜的条件是。
(1)、加碱浸取时,为提高钌的浸出率可采取的措施有(任写两点)。(2)、操作X的名称为。(3)、“研磨预处理”是将研磨后的含钌废料在氢气还原炉中还原为单质钌,再进行“碱浸”获得 ,写出“碱浸”时生成 的离子方程式:。(4)、“滤渣”的主要成分为 ,加入草酸的作用是 , 金属钌与草酸的质量比x和反应温度T对钌的回收率的影响如图所示,则回收钌较为适宜的条件是。
在酸性介质中,若使用 溶液代替草酸,可获得 ,则反应中氧化剂和还原剂的物质的量之比为。
(5)、“一系列操作”为 , 写出在“还原炉”中还原制得钌的化学方程式:。33. 钯( )是一种不活泼金属,含钯催化剂在工业、科研上用量较大。某废钯催化剂(钯碳)中含有钯(5%~6%)、碳(93%~94%)、铁(1%~2%)以及其他杂质,故钯碳具有很高的回收价值。如图是利用钯碳制备氯化钯( )和 的流程。
回答下列问题:
(1)、“钯碳”焚烧过程中空气一定要过量,目的是。(2)、“钯灰”中的主要成分有 ,加入甲酸( ),可以将 还原成金属单质,请写出 还原 的化学方程式。(3)、王水是按照体积比3:1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,加热条件下钯在王水中发生反应生成 和一种有毒的无色气体A,该气体遇空气变红棕色,请写出 和王水反应的化学方程式。(4)、加入浓氨水,调节 至9.0,并控制温度在70~75℃, 元素以 的形式存在于溶液中。若温度大于75℃,则不利于除铁,原因是;。(5)、黄色晶体的成分为 ,将其烘干、在空气中550℃下焙烧(氧气不参与反应)可以直接得到 ,同时得到无色刺激性混合气体,在温度下降时“冒白烟”,则除 外其他产物有(写化学式)。(6)、海绵状金属钯密度为 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R= ,氢气的浓度r=。(吸附容量R即 钯吸附氢气的体积;氢气的浓度r为 吸附氢气的物质的量)34. 多晶硅是单质硅的一种形态,是制造硅抛光片、太阳能电池及高纯硅制品的主要原料。(1)、已知多晶硅第三代工业制取流程如图所示。
发生的主要反应
电弧炉
SiO2+2C Si+CO↑
流化床反应器
Si+3HCl SiHCl3+H2
①物质Z的名称是。
②用石英砂和焦在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为
③在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和。
物质
Si
SiCl4
SiHCl3
SiH2Cl2
SiH3Cl
HCl
SiH4
沸点/℃
2355
57.6
31.8
8.2
-30.4
-84.9
-111.9
(2)、利用晶体硅的粉末与干燥的氮气在1300~1400℃下反应,可制取结构陶瓷材料氮化硅(Si3N4)。现用如图所示装置(部分仪器已省略)制取少量氮化硅。
①装置II中所盛试剂为。
②装置I和装置皿均需要加热,实验中应先(填“皿”或“I”)的热源。
(3)、由晶体硅制成的n型半导体、p型半导体可用于太阳能电池。一种太阳能储能电池的工作原理如图所示,已知锂离子电池的总反应为:Li1-xNiO2+xLiC6 LiNiO2+xC6。完成下列问题。
①该锂离子电池充电时,n型半导体作为电源.(填“正”或“负”)极。
②该锂离子电池放电时,b极上的电极反应式为。
35. 钼(Mo)是重要的过渡金属元素,具有广泛用途。由钼精矿(主要成分是MoS2)湿法回收钼酸铵[(NH4)2MoO4]部分工艺流程如图:
请回答下列问题:
(1)、“氧化焙烧”时通常采用粉碎矿石、逆流焙烧或增大空气量等措施,除了增大氧化焙烧速率,其作用还有。MoS2焙烧时得到+6价钼的氧化物,焙烧时的化学方程式为。(2)、已知MoO3在碱性溶液中溶解度增大,“浸出”操作时加入Na2CO3溶液会有气体产生,用离子方程式表示气泡产生的原因。(3)、向“滤液1”中加入硝酸,调节pH为5~7,加热到65℃~70℃过滤除硅。则滤渣2的成分为。(4)、为了提高原料的利用率,工艺流程中“滤渣1”应循环到操作。(5)、“滤液2”先加入有机溶剂“萃取”,再加氨水“反萃取”,进行“萃取”和“反萃取”操作的目的是。(6)、“酸沉”中析出钼酸铵晶体时,加人HNO3调节pH为1.5~3,其原因是。(7)、Na2MoO4·2H2O是一种无公害型冷却水系统的金属缓蚀剂,常用钼酸铵和氢氧化钠反应来制取。写出制备Na2MoO4·2H2O的化学方程式是。
-