高考二轮复习知识点:物质的分离与提纯7
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 固液分离操作中,需要用到的仪器是( )A、
 B、
B、 C、
C、 D、
D、 2. 实验室分离Fe3+和Al3+的流程如下:
2. 实验室分离Fe3+和Al3+的流程如下:
知Fe3+在浓盐酸中生成黄色配离子(FeCl4),该配离子在乙醚(Et2O,沸点34.6℃)中生成缔合物 。下列说法错误的是( )
A、萃取振荡时,分液漏斗下口应倾斜向下 B、分液时,应先将下层液体由分液漏斗下口放出 C、分液后水相为无色,说明已达到分离目的 D、蒸馏时选用直形冷凝管二、非选择题
-
3. 某兴趣小组对化合物X开展探究实验。

其中:X是易溶于水的强酸盐,由3种元素组成;A和B均为纯净物;B可使品红水溶液褪色。请回答:
(1)、组成X的3种元素是(填元素符号),X的化学式是。(2)、将固体X加入温热的稀H2SO4中,产生气体B,该反应的离子方程式是。(3)、步骤I,发生反应的化学方程式是。(4)、步骤II,某同学未加H2O2溶液,发现也会缓慢出现白色浑浊,原因是。(5)、关于气体B使品红水溶液褪色的原因,一般认为:B不能使品红褪色,而是B与水反应的生成物使品红褪色。请设计实验证明。4. 某兴趣小组用铬铁矿[Fe(CrO2)2]制备K2Cr2O7晶体,流程如下: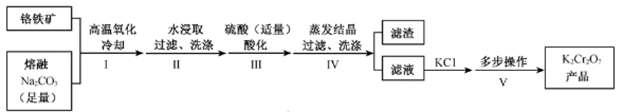
已知:4Fe (CrO2)2 + 10Na2CO3+7O2 8Na2CrO4 +4NaFeO2+10CO2
2H++2CrO Cr2O +H2O
相关物质的溶解度随温度变化如下图。
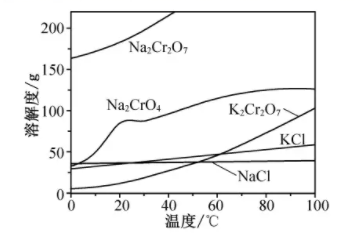
请回答:
(1)、步骤I,将铬铁矿粉碎有利于加快高温氧化的速率,其理由是。(2)、下列说法正确的是______。A、步骤II,低温可提高浸取率 B、步骤II,过滤可除去NaFeO2水解产生的Fe(OH)3 C、步骤III,酸化的目的主要是使Na2CrO4转变为Na2Cr2O7 D、步骤IV,所得滤渣的主要成分是Na2SO4和Na2CO3(3)、步骤V,重结晶前,为了得到杂质较少的K2Cr2O7粗产品,从下列选项中选出合理的操作(操作不能重复使用)并排序:溶解KCl →→→→→重结晶。a.50℃蒸发溶剂;
b.100℃ 蒸发溶剂;
c.抽滤;
d.冷却至室温;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热。
(4)、为了测定K2Cr2O7产品的纯度,可采用氧化还原滴定法。①下列关于滴定分析的操作,错误的是。
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,继续摇动锥形瓶,观察颜色变化。(请在横线上补全操作)
(5)、该小组用滴定法准确测得产品中K2Cr2O7的质量分数为98.50%。某同学还用分光光度法测定产品纯度(K2Cr2O7溶液的吸光度与其浓度成正比例),但测得的质量分数明显偏低。分析其原因,发现配制K2Cr2O7待测水溶液时少加了一种试剂。该试剂是 , 添加该试剂的理由是。5. 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。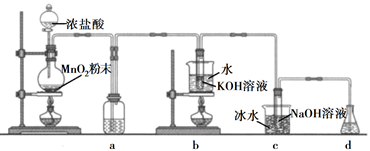
回答下列问题:
(1)、盛放MnO2粉末的仪器名称是 , a中的试剂为。(2)、b中采用的加热方式是 , c中化学反应的离子方程式是 , 采用冰水浴冷却的目的是。(3)、d的作用是 , 可选用试剂(填标号)。A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
(4)、反应结束后,取出b中试管,经冷却结晶, , , 干燥,得到KClO3晶体。(5)、取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显色。可知该条件下KClO3的氧化能力NaClO(填“大于”或“小于")。