高考二轮复习知识点:物质的分离与提纯4
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 工业上以SO2和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法错误的是( )
 A、吸收过程中有气体生成 B、结晶后母液中含有NaHCO3 C、气流干燥湿料时温度不宜过高 D、中和后溶液中含Na2SO3和NaHCO32. 下列说法正确的是( )A、减压过滤适用于过滤胶状氢氧化物类沉淀 B、实验室电器设备着火,可用二氧化碳灭火器灭火 C、制备硫酸亚铁铵晶体时,须将含 和 的溶液浓缩至干 D、将热的 饱和溶液置于冰水中快速冷却即可制得颗粒较大的晶体3. 下列实验的试剂、装置选用不合理的是( )
A、吸收过程中有气体生成 B、结晶后母液中含有NaHCO3 C、气流干燥湿料时温度不宜过高 D、中和后溶液中含Na2SO3和NaHCO32. 下列说法正确的是( )A、减压过滤适用于过滤胶状氢氧化物类沉淀 B、实验室电器设备着火,可用二氧化碳灭火器灭火 C、制备硫酸亚铁铵晶体时,须将含 和 的溶液浓缩至干 D、将热的 饱和溶液置于冰水中快速冷却即可制得颗粒较大的晶体3. 下列实验的试剂、装置选用不合理的是( )
选项
实验目的
选用试剂
选用装置
A
除去Cl2中少量的HCl、H2O
试剂a为饱和氯化钠溶液
甲
B
除去NH3中少量的H2O
试剂b为无水氯化钙
乙
C
除去H2中少量的HCl、H2O
试剂b为碱石灰
乙
D
除去N2中少量的O2
足量铜网
丙
A、A B、B C、C D、D4. 设计如下实验流程,操究甲醛与新制反应的固体混合产物成分。
下列说法错误的是( )
A、分析可知反应的固体混合产物为和Cu B、根据现象,推测红色固体X为 C、根据现象可知,与形成的络合物为无色 D、若产物浸泡过程进行充分振荡,则无法推测出其成分5. 下列除杂试剂或方法选用正确的是( )物质(括号内为杂质)
除杂试剂或方法
A
NaHCO3固体(Na2CO3)
加热
B
苯(苯酚)
浓溴水
C
NaCl溶液(Na2SO4)
BaCl2溶液、Na2CO3溶液
D
CO2(SO2)
BaCl2与H2O2混合溶液、浓硫酸
A、A B、B C、C D、D6. 某学生设计如下流程,以废铁屑(含有少量碳和杂质)为原料制备无水固件:
下列有关说法正确的是( )
A、操作①用到的仪器均为玻璃仪器 B、操作中试剂b可选用稀硝酸或过氧化氢溶液 C、进行操作②时通入HCl气体以提高产品纯度 D、由于易与结晶水反应可用作操作③的脱水剂7. α-呋喃丙烯酸是一种重要的有机酸,其实验室制备原理如下: +CH2(COOH)2
+CH2(COOH)2 +CO2↑+H2O
+CO2↑+H2O制备α-呋喃丙烯酸的步骤如下:向三颈烧瓶中依次加入丙二酸、糠醛和吡啶,在95℃下回流2小时,停止反应;将混合物倒入冷的3mol·L-1 盐酸中析出淡黄色沉淀,将其置于冰水中1小时,过滤,用水洗涤2~3次,得到粗产品。实验装置如图所示。

下列说法正确的是( )
A、仪器A的a口为进水口 B、不产生气泡时表明三颈烧瓶中反应已完成 C、冷的盐酸和冰水的主要作用是提高晶体纯度 D、过滤后洗涤时,向漏斗中注满蒸馏水并不断搅拌8. 下列仪器一般不用于物质分离提纯实验的是( )A、 B、
B、 C、
C、 D、
D、 9. 氮化硅()是一种重要的结构陶瓷材料。用石英砂和原料气(含和少量)制备的操作流程如下(粗硅中含少量Fe、Cu的单质及化合物):
9. 氮化硅()是一种重要的结构陶瓷材料。用石英砂和原料气(含和少量)制备的操作流程如下(粗硅中含少量Fe、Cu的单质及化合物):
下列叙述不正确的是( )
A、“还原”主要被氧化为 B、“高温氮化”反应的化学方程式为 C、“操作X”可将原料气通过灼热的铜粉 D、“稀酸Y”可选用稀硝酸10. 溴乙烷是无色油状液体,是制造巴比妥的原料,工业上可用海水制备溴乙烷,部分工艺流程如图:
下列说法不正确的是( )
A、粗盐提纯时,加入沉淀剂的顺序可以是BaCl2、NaOH和Na2CO3 B、向“母液”中通入热空气,利用溴的易挥发性,将溴吹出 C、“制备”时氧化剂和还原剂的物质的量之比为3:1 D、“精制”时所用的玻璃仪器有分液漏斗、烧杯11. 下列除杂试剂和分离方法都正确的是( )选项
物质(括号内为杂质)
除杂试剂
分离方法
A
澄清石灰水
过滤
B
饱和溶液
洗气
C
粉
加热
D
饱和溶液
分液
A、A B、B C、C D、D12. 可用作杀虫剂,其制备步骤如下。步骤1:向足量铜粉与一定量稀的混合物中通入热空气,当铜粉不再溶解时,过滤得滤液。
步骤2:向步骤1所得滤液中边搅拌边滴加氨水,沉淀先增加后减少。当沉淀完全溶解时,停止滴加氨水。
步骤3:向步骤2所得溶液中加入95%乙醇,析出深蓝色晶体。
下列说法正确的是( )
A、步骤1发生反应的离子方程式为 B、步骤2所得溶液中大量存在的离子有、、、 C、步骤3加入95%乙醇的目的是降低的溶解量 D、中有12个配位键13. 下列有关实验操作、现象和解释或结论都正确的是( )实验操作
现象
解释或结论
A
用试管取2mL溶液,向其中滴入2滴品红溶液,振荡
品红溶液褪色
该溶液溶有气体
B
等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体
HA放出的氢气多且反应速率快
HB酸性比HA强
C
向甲苯中滴入少量浓溴水,振荡,静置
溶液分层,上层呈橙红色,下层几乎无色
甲苯和溴水发生取代反应,使溴水褪色
D
向尿液中加入新制悬浊液
没有砖红色沉淀生成
说明尿液中不含有葡萄糖
A、A B、B C、C D、D14. 碳酸锶(SrCO3)被广泛应用于电子工业、彩色显像管、陶瓷等行业,工业上以天青石矿(SrSO4)为原料制备碳酸锶的操作流程如下图:
已知:浸取液中主要含有硫化锶(SrS)。常温下 , 下列说法正确的是( )
A、Sr元素位于元素周期表中第五周期第Ⅱ族 B、焙烧反应的化学方程式为: C、操作a为过滤,之后向浸取液中通入CO2 , 还会产生一种有毒气体,该气体是SO2 D、将天青矿石粉末与碳酸钠溶液混合浸泡也可以制得SrCO315. 氯化法制取FeCl3流程:以废铁屑和氯气为原料,在立式反应炉里反应,生成的氯化铁蒸气和尾气由炉的顶部排出,进入捕集器冷凝为固体结晶,实验室模拟该方法的装置如下图所示,下列说法错误的是( ) A、装置I反应的离子方程式为 B、装置II洗气瓶中加入饱和氯化钠溶液除去Cl2中的少量HCl C、装置IV洗气瓶中盛放的液体为浓盐酸 D、装置V的作用是收集FeCl316. 除去下列物质中的杂质,所选的试剂与分离方法不能达到目的的是( )
A、装置I反应的离子方程式为 B、装置II洗气瓶中加入饱和氯化钠溶液除去Cl2中的少量HCl C、装置IV洗气瓶中盛放的液体为浓盐酸 D、装置V的作用是收集FeCl316. 除去下列物质中的杂质,所选的试剂与分离方法不能达到目的的是( )物质
除杂试剂
分离方法
A
NaCl溶液(I2)
CCl4
分液
B
CH3CH2OH(CH3COOH)
NaOH溶液
蒸馏
C
HCl(Cl2)
饱和食盐水
洗气
D
CaCO3(CaSO4)
Na2CO3溶液
过滤
A、A B、B C、C D、D17. 为了研究Mg(OH)2溶于铵盐溶液的原因,进行如下实验:①向2mL 0.2mol/LMgCl2溶液中滴加1mol/LNaOH溶液至不再产生沉淀,将浊液分为2等份。
②向一份中逐滴加入4mol/L NH4Cl溶液,另一份中逐滴加入4mol/L CH3COONH4溶液(pH≈7),边滴加边测定其中沉淀的量,沉淀的量与铵盐溶液的体积的关系如图。
③将①中的NaOH溶液用氨水替换,重复上述实验。
下列说法错误的是( )
 A、Mg(OH)2浊液中存在:Mg(OH)2(s)Mg2+(aq)+2OH﹣(aq) B、②中两组实验中均存在反应:Mg(OH)2+2NH4+=Mg2++2NH3•H2O C、H+可能参与了NH4Cl溶液溶解Mg(OH)2的过程 D、③中获得的图像与②相同
A、Mg(OH)2浊液中存在:Mg(OH)2(s)Mg2+(aq)+2OH﹣(aq) B、②中两组实验中均存在反应:Mg(OH)2+2NH4+=Mg2++2NH3•H2O C、H+可能参与了NH4Cl溶液溶解Mg(OH)2的过程 D、③中获得的图像与②相同二、非选择题
-
18. 六氯化钨(WCl6)可用作有机合成催化剂,熔点为283℃,沸点为340℃,易溶于CS2 , 极易水解。实验室中,先将三氧化钨(WO3)还原为金属钨(W)再制备WCl6 , 装置如图所示(夹持装置略)。回答下列问题:
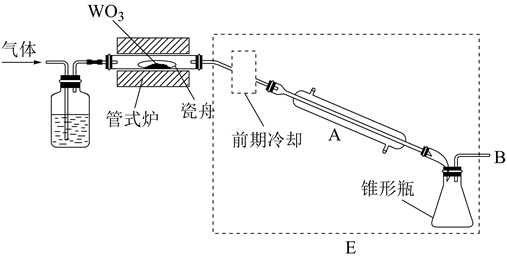 (1)、检查装置气密性并加入WO3。先通N2 , 其目的是;一段时间后,加热管式炉,改通H2 , 对B处逸出的H2进行后续处理。仪器A的名称为 , 证明WO3已被完全还原的现象是。(2)、WO3完全还原后,进行的操作为:①冷却,停止通H2;②以干燥的接收装置替换E;③在B处加装盛有碱石灰的干燥管;④……;⑤加热,通Cl2;⑥……。碱石灰的作用是;操作④是 , 目的是。(3)、利用碘量法测定WCl6产品纯度,实验如下:
(1)、检查装置气密性并加入WO3。先通N2 , 其目的是;一段时间后,加热管式炉,改通H2 , 对B处逸出的H2进行后续处理。仪器A的名称为 , 证明WO3已被完全还原的现象是。(2)、WO3完全还原后,进行的操作为:①冷却,停止通H2;②以干燥的接收装置替换E;③在B处加装盛有碱石灰的干燥管;④……;⑤加热,通Cl2;⑥……。碱石灰的作用是;操作④是 , 目的是。(3)、利用碘量法测定WCl6产品纯度,实验如下:①称量:将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称重为m1g;开盖并计时1分钟,盖紧称重为m2g;再开盖加入待测样品并计时1分钟,盖紧称重为m3g,则样品质量为g(不考虑空气中水蒸气的干扰)。
②滴定:先将WCl6转化为可溶的Na2WO4 , 通过IO 离子交换柱发生反应:WO +Ba(IO3)2=BaWO4+2IO ;交换结束后,向所得含IO 的溶液中加入适量酸化的KI溶液,发生反应:IO +5I-+6H+=3I2+3H2O;反应完全后,用Na2S2O3标准溶液滴定,发生反应:I2+2S2O =2I-+S4O 。滴定达终点时消耗cmol•L-1的Na2S2O3溶液VmL,则样品中WCl6(摩尔质量为Mg•mol-1)的质量分数为。称量时,若加入待测样品后,开盖时间超过1分钟,则滴定时消耗Na2S2O3溶液的体积将(填“偏大”“偏小”或“不变”),样品中WCl6质量分数的测定值将(填“偏大”“偏小”或“不变”)。
19. 工业上以铬铁矿(FeCr2O4 , 含Al、Si氧化物等杂质)为主要原料制备红矾钠(Na2Cr2O7•2H2O)的工艺流程如图。回答下列问题: (1)、焙烧的目的是将FeCr2O4转化为Na2Cr2O4并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是。(2)、矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度c≤1.0×10-5mol•L-1时,可认为已除尽。
(1)、焙烧的目的是将FeCr2O4转化为Na2Cr2O4并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是。(2)、矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度c≤1.0×10-5mol•L-1时,可认为已除尽。
中和时pH的理论范围为;酸化的目的是;Fe元素在(填操作单元的名称)过程中除去。
(3)、蒸发结晶时,过度蒸发将导致;冷却结晶所得母液中,除Na2Cr2O7外,可在上述流程中循环利用的物质还有。(4)、利用膜电解技术(装置如图所示),以Na2Cr2O4为主要原料制备Na2Cr2O7的总反应方程式为:4Na2Cr2O4+4H2O 2Na2Cr2O7+4NaOH+2H2↑+O2↑。则Na2Cr2O7在(填“阴”或“阳”)极室制得,电解时通过膜的离子主要为。 20.(1)、已知3种原子晶体的熔点数据如下表:
20.(1)、已知3种原子晶体的熔点数据如下表:金刚石
碳化硅
晶体硅
熔点/℃
>3550
2600
1415
金刚石熔点比晶体硅熔点高的原因是。
(2)、提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的pH使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是。21. 以固体废锌催化剂(主要成分为ZnO及少量、CuO、MnO、)为原料制备锌的工艺流程如图:
已知:①“浸取”时。ZnO、CuO转化为、进入溶液;
②25℃时, , ;
③深度除杂标准:溶液中
(1)、为提高锌浸出率,必须采取的措施是;“浸取”温度为30℃时,锌浸出率可达90.6%,继续升温浸出率反而下降,其原因为。(2)、“操作a”的名称为。(3)、“深度除锰”是在碱性条件下将残留的转化为 , 离子方程式为。(4)、“深度除铜”时,锌的最终回收率、除铜效果[除铜效果以反应后溶液中铜锌比表示]与“加入量”[以表示]的关系曲线如图所示。
①当加入量时,锌的最终回收率下降的原因是(用离子方程式表示),该反应的平衡常数为 , (已知的)
②“深度除铜”时加入量最好应选。
a.100% b.110% c.120% d.130%
(5)、测定反萃取水相中的浓度:量取20.00mL反萃取水相于锥形瓶中,用0.0100mol/L EDTA(乙二胺四乙酸钠)标准溶液滴定至终点()。重复实验三次,平均消耗标准溶液22.30mL。则反萃取水相中的浓度为(保留两位小数)。22. 天空课堂第二课中航天员展示了金属锆(40Zr)在无容器实验柜中从液体变成固体时的“再辉”现象。以锆英石(主要成分是ZrSiO4 , 还含有少量Al2O3、SiO2、Fe2O3等杂质)为原料生产锆的流程如图所示:
已知:常温下,ZrCl4是白色固体, 604K升华,遇水强烈水解:ZrCl4+9H2O=ZrOCl2·8H2O+2HCl,在浓盐酸中会析出ZrOCl2·8H2O沉淀。请回答下列问题:
(1)、“高温气化”中可发生多个反应,写出发生的主要反应的化学方程式是。(2)、分馏过程中,为防止产品变质,过程中一定需要注意的是。液体a的电子式是。(3)、实验室中洗涤ZrOCl2·8H2O沉淀操作是。(4)、“还原”中氧化剂是(填化学式)。(5)、由于锆铪(Hf)矿石共生,这样制得的锆中常含有少量的铪,需要进一步分离提纯。第一步:溶解分离
将样品溶于氢氟酸后再加入一定量KOH溶液,锆和铪均以[MF6]2-存在。
①已知在水中K2HfF6比K2ZrF6的溶解度大,且K2ZrF6的溶解度随温度的升高而增大,可以利用
方法进行分离。
②离子交换法:利用强碱型酚醛树脂R-N(CH3)Cl-阴离子交换剂进行交换分离,原理是:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是。
③将所得溶液与有机相磷酸三丁酯(TBP)充分混合、振荡,可以达到Zr与Hf分离。这种分离方法是。
第二步:高温还原
在高温条件下,加入铝将制得的K2ZrF6还原可得锆,反应的化学方程式是。
23. 金属镓拥有电子工业脊梁的美誉,镓与铝同族,化学性质相似。一种从高铝粉煤灰(主要成分是Al2O3 , 还含有少量Ga2O3和Fe2O3等)中回收镓的工艺如下:
回答下列问题:
(1)、“焙烧”中,Ga2O3转化成NaGaO2的化学方程式为。(2)、“碱浸”所得浸出渣的主要成分是。(3)、“转化1”中通入过量CO2至溶液pH=8,过滤,所得滤渣的主要成分是Al(OH)3和Ga(OH)3 , 写出生成Al(OH)3的离子方程式。(4)、“溶镓”所得溶液中存在的阴离子主要有。(5)、“电解”所用装置如图所示,阴极的电极反应为。若电解获得1molGa,则阳极产生的气体在标准状况下的体积至少为L,电解后,阳极室所得溶液中的溶质经加热分解生成(填化学式)可循环利用。 24. 超细碳酸锶是重要的无机化工产品。利用锶渣(主要成分SrSO4 , 含少量CaCO3、Fe2O3、Al2O3、MgCO3等杂质)制备超细碳酸锶的工艺如下:
24. 超细碳酸锶是重要的无机化工产品。利用锶渣(主要成分SrSO4 , 含少量CaCO3、Fe2O3、Al2O3、MgCO3等杂质)制备超细碳酸锶的工艺如下:
已知:①“高温煅烧”过程中发生的主要反应为:SrSO4+4CSrS+4CO↑
②Sr(OH)2、Ca(OH)2在不同温度下的溶解度表(g/100mLH2O)
温度/℃
0
20
40
60
80
90
100
氢氧化钙
0.19
0.17
0.14
0.12
0.09
0.08
0.07
氢氧化锶
0.91
1.77
3.95
8.42
20.20
44.50
91.20
回答下列问题:
(1)、“粉碎”的目的是(2)、“酸浸”过程中主要反应的化学方程式为(3)、“除铁铝”过程中温度控制在75℃左右,适宜的加热方式为(4)、“操作I”为(5)、①写出“沉锶”的离子方程式②反应温度对锶转化率的影响如图,温度高于60℃时,“锶转化率”降低的原因为。

③从平衡移动的角度分析“沉锶”过程中控制pH≥10的原因。
25. 一种以镍电极废料(含Ni以及少量Al2O3、Fe2O3和不溶性杂质)为原料制备NiOOH的过程可表示为: (1)、基态Ni原子的电子排布式为。(2)、“酸浸”后过滤,滤液中的金属离子除Ni2+外还有少量的Al3+和Fe2+等,产生Fe 2+的原因是。(3)、“氧化”时需将溶液调至碱性后加入KClO溶液,充分反应后过滤、洗涤得产品。写出Ni2+被氧化的离子方程式:。(4)、工业上也可用惰性电极电解Ni(OH)2悬浊液(pH=11左右)制备NiOOH。阳极电极反应式为Ni(OH)2-e-+OH-=NiOOH+H2O。
(1)、基态Ni原子的电子排布式为。(2)、“酸浸”后过滤,滤液中的金属离子除Ni2+外还有少量的Al3+和Fe2+等,产生Fe 2+的原因是。(3)、“氧化”时需将溶液调至碱性后加入KClO溶液,充分反应后过滤、洗涤得产品。写出Ni2+被氧化的离子方程式:。(4)、工业上也可用惰性电极电解Ni(OH)2悬浊液(pH=11左右)制备NiOOH。阳极电极反应式为Ni(OH)2-e-+OH-=NiOOH+H2O。①电解过程中需要充分搅拌Ni(OH)2悬浊液的目的是。
②Ni(OH)2悬浊液中加入一定量KCl可显著提高NiOOH产率,原因是。
(5)、NiOOH在空气中加热时,固体残留率随温度的变化如图所示。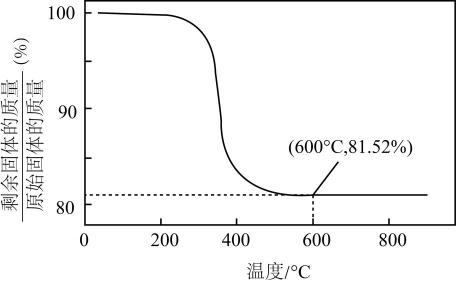
已知NiOOH加热至600 ℃后固体质量保持不变,则600 ℃时,剩余固体的成分为(填化学式)。
26. 磷酸亚铁锂(LiFePO4)能可逆地嵌入、脱出锂,使其作为锂离子电池正极材料的研究及应用得到广泛关注。通过水热法制备磷酸亚铁锂的一种方法如下(装置如图所示):

I.在A中加入40mL蒸馏水、0.01molH3PO4和0.01molFeSO4·7H2O,用搅拌器搅拌溶解后,缓慢加入0.03molLiOH·H2O,继续搅拌。
II.向反应液中加入少量抗坏血酸(即维生素C),继续搅拌5min。
III.快速将反应液装入反应釜中,保持170℃恒温5h。
IV.冷却至室温,过滤。
V.用蒸馏水洗涤沉淀。
VI.干燥,得到磷酸亚铁锂产品。
回答下列问题:
(1)、装置图中仪器A的名称是 , 根据上述实验药品的用量,A的最适宜规格为(填选项)A.100mL B.250mL C.500mL D.1000mL
(2)、步骤II中,抗坏血酸的作用是 , 也可以用Na2SO3代替抗坏血酸,其原理是(用离子方程式表示)。(3)、步骤IV过滤用到的玻璃仪器除烧杯外还有。(4)、步骤V检验LiFePO4是否洗涤干净的方法是。(5)、干燥后称量,产品的质量是1.4g,本实验的产率为%(保留小数点后1位)。27. 从印刷电路板的腐蚀废液(主要含CuCl2、FeCl3、FeCl2等)中回收FeCl3、制备CuSO4·5H2O的流程如下。 (1)、上述流程中能加快反应速率的措施有。(2)、粗品的主要成分是硫酸铜晶体,而不是硝酸铜晶体,分析有两种可能的原因:
(1)、上述流程中能加快反应速率的措施有。(2)、粗品的主要成分是硫酸铜晶体,而不是硝酸铜晶体,分析有两种可能的原因:①相对于Cu2+ , 粗液中浓度过小,原因是(用离子方程式表示),不能得到硝酸铜晶体。
②粗液中浓度较大,但由于 , 不能得到硝酸铜晶体。
(3)、测量粗品中铁(含、)的含量,评定纯度等级。Ⅰ.用水溶解一定质量粗品,加入稀和溶液,加热。
Ⅱ.待溶液冷却后,加入试剂X至溶液。过滤、洗涤,得到红褐色沉淀。
Ⅲ.用稀溶解红褐色沉淀,滴入溶液,稀释至一定体积。将溶液红色的深浅与标准色阶对照,确定含量。
已知:完全沉淀的pH为6.7,完全沉淀的pH为2.8
①Ⅰ中将氧化为的离子方程式是。
②试剂X是。
(4)、电解:在不同电压、不同pH(pH<7)条件下电解溶液,研究溶液的再生条件。序号
电压
阴极现象
阳极产物
i
a
无气泡,少量金属析出
无 , 有
ii
b
较多气泡,极少量金属析出
无 , 有
iii
a
少量气泡,少量金属析出,
有 , 有
( , )
①iii中产生的原因有、。
②溶液再生的合适条件是(填实验序号)。
28. 硫代硫酸钠(Na2S2O3)俗称海波,广泛应用于照相定影及纺织业等领域。某实验小组制备硫代硫酸钠并探究其性质。(1)、Ⅰ:硫代硫酸钠的制备实验小组设计如下装置制备硫代硫酸钠

已知:①Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2
②Na2S2O3中S元素的化合价分别为-2和+6
仪器a的名称是。A中发生的化学反应方程式为。
(2)、为了保证Na2S2O3的产量,实验中通入的SO2不能过量,需控制A中SO2的生成速率,采取的措施是。(3)、Ⅱ:产品纯度的测定①溶液配制:准确取该硫代硫酸钠样品2.0000g,配制成250mL溶液。
②滴定:向锥形瓶中加入20.00mL0.01mol·L-1KIO3溶液,加入过量KI溶液和H2SO4溶液,发生反应: +5I-+6H+=3I2+3H2O,然后加入淀粉作指示剂,用硫代硫酸钠样品溶液滴定,发生反应:I2+2 = +2I-。
滴定终点现象为 , 消耗样品溶液的用量为25.00mL,则样品纯度为%(保留1位小数)
(4)、Ⅲ:硫代硫酸钠性质的探究①取Na2S2O3晶体,溶解,配成0.2mol/L溶液。
②取4mL溶液,向其中加入1mL饱和氯水(pH=2.4),溶液立即出现浑浊,经检验浑浊物为S。
实验小组研究S产生的原因,提出了以下假设:
假设1:氧化剂氧化:Cl2、HClO等含氯的氧化性微粒氧化了-2价硫元素。
假设2: (不考虑空气中氧气氧化)。
设计实验方案:

假设2是。
(5)、第②组实验中胶头滴管加入的试剂是。胶头滴管
现象
第①组
1mL饱和氯水
立即出现浑浊
第②组
一段时间后出现浑浊,且浑浊度比①组
(6)、依据现象,S产生的主要原因是。29. 钼催化剂常用于合成氨工业,以废钼催化剂(主要含有MoS2和Al2O3)为原料制备钼酸钠晶体和硫酸钠晶体的一种工艺流程如下图所示。回答下列问题: (1)、为了提高“焙烧”效率,可采用的措施为(写一条即可),“焙烧”反应中氧化剂与还原剂物质的量之比为。(2)、“水溶”时,钼浸取率与浸取时间、浸取温度的关系如下图所示,综合考虑成本等因素,则最佳浸取时间和浸取温度为。
(1)、为了提高“焙烧”效率,可采用的措施为(写一条即可),“焙烧”反应中氧化剂与还原剂物质的量之比为。(2)、“水溶”时,钼浸取率与浸取时间、浸取温度的关系如下图所示,综合考虑成本等因素,则最佳浸取时间和浸取温度为。 (3)、“调pH”时,生成Al(OH)3的离子方程式为 , 调节pH不能过低的原因是。(4)、“操作I”的名称为;“溶液1”中含有大量Na2SO4和少量Na2MoO4 , 根据下图分析“结晶”过程的操作为(填标号)。
(3)、“调pH”时,生成Al(OH)3的离子方程式为 , 调节pH不能过低的原因是。(4)、“操作I”的名称为;“溶液1”中含有大量Na2SO4和少量Na2MoO4 , 根据下图分析“结晶”过程的操作为(填标号)。
A.蒸干溶剂
B.蒸发水分至有大量晶体析出时,趁热过滤
C.蒸发浓缩,冷却至10℃左右
(5)、碱性条件下,将废钼催化剂加入NaClO溶液中,也可制备钼酸钠,同时生成硫酸盐,该反应的离子方程式为。30. 硼、镁及其化合物在工农业生产中应用广泛。已知硼镁矿的主要成分为 , 硼砂的化学式为。一种利用硼镁矿制取金属镁及粗硼的工艺流程如图所示: (1)、生成的化学方程式为。(2)、将硼砂溶于热水后,用硫酸调节溶液的pH为2~3以制取 , 已知是一元弱酸,且自身不能电离出氢离子,写出其电离方程式。X为晶体加热脱水的氧化物,其与Mg反应制取粗硼的化学方程式为。(3)、由制备时,需要在HCl氛围中加热,其目的是。(4)、镁酸性燃料电池的反应原理为 , 常温下,若起始电解质溶液pH=1,则pH=2时,电解质溶液中所含的物质的量浓度为。已知常温下, , 当电解质溶液的pH=6时,(填“有”或“无”)沉淀析出。(忽略反应过程中溶液的体积变化)31. 某电解铜企业生产过程中产生大量阳极泥,主要成分如下:Cu-16.32%,Ag-4.62%,Au-0.23%,Pb-15.68%。现设计如下流程实现对铜、银的有效回收:
(1)、生成的化学方程式为。(2)、将硼砂溶于热水后,用硫酸调节溶液的pH为2~3以制取 , 已知是一元弱酸,且自身不能电离出氢离子,写出其电离方程式。X为晶体加热脱水的氧化物,其与Mg反应制取粗硼的化学方程式为。(3)、由制备时,需要在HCl氛围中加热,其目的是。(4)、镁酸性燃料电池的反应原理为 , 常温下,若起始电解质溶液pH=1,则pH=2时,电解质溶液中所含的物质的量浓度为。已知常温下, , 当电解质溶液的pH=6时,(填“有”或“无”)沉淀析出。(忽略反应过程中溶液的体积变化)31. 某电解铜企业生产过程中产生大量阳极泥,主要成分如下:Cu-16.32%,Ag-4.62%,Au-0.23%,Pb-15.68%。现设计如下流程实现对铜、银的有效回收:
已知:
①NaNO3受热分解产生NaNO2和O2;
②焙烧时Pb转化为PbO;
③Ag(NH)2OH能被含醛基的有机物还原生成银。
回答下列问题:
(1)、铜阳极泥可用湿法直接浸出,浸出剂主要是硫酸,同时还需加入一定量的氯酸钠(NaClO3),加入氯酸钠的目的是。写出铜被浸出的离子反应方程式。(2)、写出焙烧过程中银与NaNO3反应的化学方程式。(3)、浸渣的主要成分有。(4)、对浸取液进行氯化时的现象是 , 滤渣提银时需依次加入、甲醛溶液。(5)、最后的滤液中加入一定浓度的纯碱沉铜(主要沉淀为碱式碳酸铜),经实验测定某批沉铜产品中m(Cu):m(C)=16:1,则该碱式碳酸铜的组成可表示为____。A、Cu(OH)2·CuCO3 B、Cu(OH)2·2CuCO3 C、2Cu(OH)2·CuCO332. 含钒化合物广泛用于冶金、化工行业。由富钒废渣(含、和、FeO)制备的一种流程如下:
查阅资料:
部分含钒物质在水溶液中的主要存在形式如下,
pH
<1
1~4
4~6
6-8.5
8.5~13
>13
主要形式
多矾酸根
多矾酸根
备注
多矾酸盐在水中溶解度较小
本工艺中,生成氢氧化物沉淀的pH如下:
物质
开始沉淀pH
7.0
1.9
3.2
沉淀完全pH
9.0
3.2
4.7
回答下列问题:
(1)、“焙烧”中,将“研磨”所得粉末与逆流混合的目的为;所生成的气体A可在工序中再利用。(2)、“酸浸”V元素发生的离子反应方程式。(3)、滤渣2含有的物质为。(4)、“转化Ⅱ”需要调整pH范围为 , “转化Ⅲ”中含钒物质反应的离子方程式为。(5)、“沉钒”中加入过量有利于晶体析出,其原因为。(6)、“煅烧”中所生成的气体B用途广泛,写出基于其物理性质的一种用途:。33. 铁及其化合物在日常生产生活中用途广泛,利用FeSO4制备还原铁粉的工业流程如图:
实验室中可用FeSO4(由铁粉和稀硫酸反应制得)和NH4HCO3用如图装置模拟上述流程中的“转化”环节。

回答下列问题:
(1)、配制溶液所用的蒸馏水须先除去其中溶解的氧气,具体方法是。(2)、装置A用于制备FeSO4 , 实验过程中,欲将生成的FeSO4溶液与装置B中的NH4HCO3溶液混合,操作方法是关闭 , 打开(填“K1”、“K2”或“K3”);装置B中生成FeCO3的离子方程式为。(3)、转化过程中温度不超过35℃,主要原因是;“过滤”环节,不需要使用下列仪器中的(填仪器名称)。 (4)、干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为;检验产品中是否含Fe3+需要的试剂有稀H2SO4和(填化学式)。(5)、取干燥后的FeCO3样品(含少量FeOOH)37.47g,与炭混合后焙烧,最终得到还原铁粉18.48g,计算样品中FeCO3的质量分数为%(计算结果取整数)。34. 硫酸亚铁铵是一种重要化工原料,其晶体为浅蓝绿色晶体,较硫酸亚铁不易被氧化。(1)、硫酸亚铁铵晶体的制备:
(4)、干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为;检验产品中是否含Fe3+需要的试剂有稀H2SO4和(填化学式)。(5)、取干燥后的FeCO3样品(含少量FeOOH)37.47g,与炭混合后焙烧,最终得到还原铁粉18.48g,计算样品中FeCO3的质量分数为%(计算结果取整数)。34. 硫酸亚铁铵是一种重要化工原料,其晶体为浅蓝绿色晶体,较硫酸亚铁不易被氧化。(1)、硫酸亚铁铵晶体的制备:
①铁屑需先用碱洗后,再用少量酸洗,酸洗的目的是。
②制备硫酸亚铁过程中,初始时活塞a、b、c的开关状态依次是 , 反应一段时间后,调整活塞a、b、c的开关状态依次为 , 最后得到晶体产品。
(2)、产品的相关实验:
①硫酸亚铁铵晶体在500℃时隔绝空气加热完全分解,将方程式补充完整(合理即可) 。
□□(系数为1时,也要写出)
②为验证甲中残留物含有可选用的试剂有(填字母)。
a.稀硝酸 b.稀硫酸 c.新制氯水 d.硫氰酸钾
③装置乙中HCl的作用是。实验中,观察到装置丙中有白色沉淀生成,发生的离子反应方程式为。
(3)、样品纯度的测定:准确称量20.00g硫酸亚铁铵晶体样品,配制成100mL溶液。取所配溶液20.00mL于锥形瓶中,加稀酸化,实验测定其与溶液恰好完全反应。已知:的摩尔质量是392g/mol,则产品中的质量分数为。35. 常用作杀虫剂、媒染剂,某小组在实验室以铜为主要原料合成该物质的路线如图所示: 已知:①为绛蓝色晶体,在溶液中存在以下电离(解离)过程:
已知:①为绛蓝色晶体,在溶液中存在以下电离(解离)过程:、。
②和在水中均可溶,在乙醇中均难溶。若向溶液中加入乙醇,会析出晶体。
请回答下列问题:
(1)、实验室用下图装置制备合成所需的溶液。
①仪器a的名称是;仪器d中发生反应的离子方程式是。
②说明检验装置A气密性的方法:。
③装置B的加热方法为水浴加热,其优点是。
(2)、方案1的实验步骤为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。该方案存在一定缺陷,因为根据该方案得到的产物晶体中往往含有__(填化学式)杂质,其原因是__(从平衡移动的角度回答)。
(3)、方案2的实验步骤为:向溶液中加入适量(填试剂名称),过滤、洗涤、干燥。(4)、方案1、2中步骤均有过滤、洗涤、干燥。①过滤的主要目的是将固液混合物进行分离。中学化学中常见的固液混合物分离的操作有“倾析法”、“普通过滤法”和“减压过滤法”等,操作示意图如下:

减压过滤法相对于普通过滤法的优点为(填序号,下同)。
A.过滤速度相对较快 B.能过滤胶体类混合物 C.得到的固体物质相对比较干燥
②下列最适合在“洗涤”步骤中作为洗涤液的是。
A.蒸馏水 B.乙醇与水的混合液 C.饱和(NH4)2SO4溶液