高考二轮复习知识点:物质的分离与提纯2
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 利用如图所示的装置(夹持及加热装置略)制备高纯白磷的流程如下:

下列操作错误的是
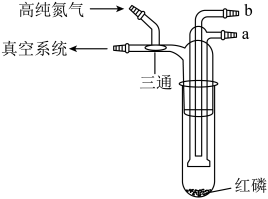 A、红磷使用前洗涤以除去表面杂质 B、将红磷转入装置,抽真空后加热外管以去除水和氧气 C、从a口通入冷凝水,升温使红磷转化 D、冷凝管外壁出现白磷,冷却后在氮气氛围下收集2. 溶液可作为替代氟利昂的绿色制冷剂。合成工艺流程如下:
A、红磷使用前洗涤以除去表面杂质 B、将红磷转入装置,抽真空后加热外管以去除水和氧气 C、从a口通入冷凝水,升温使红磷转化 D、冷凝管外壁出现白磷,冷却后在氮气氛围下收集2. 溶液可作为替代氟利昂的绿色制冷剂。合成工艺流程如下:
下列说法错误的是( )
A、还原工序逸出的用溶液吸收,吸收液直接返回还原工序 B、除杂工序中产生的滤渣可用煤油进行组分分离 C、中和工序中的化学反应为 D、参与反应的为1∶1∶13. 《医学入门》中记载我国传统中医提纯铜绿的方法:“水洗净,细研水飞,去石澄清,慢火熬干,”其中未涉及的操作是( )A、洗涤 B、粉碎 C、萃取 D、蒸发4. 某化工厂的废液含有乙醇、苯酚、乙酸和二氯甲烷,该工厂设计回收方案如下:
下列说法错误的是
A、试剂a选择溶液比溶液更合适 B、回收物1、2分别是二氯甲烷、乙醇 C、试剂b为 , 试剂c为稀硫酸 D、操作Ⅰ、Ⅱ、Ⅲ均为蒸馏5. 从电镀污泥(含Ni2+、Ca2+、Fe3+、Al3+等)中提取镍的工艺流程如图所示,下列说法错误的是
已知:丁二酮肟可与Ni2+反应生成易溶于有机溶剂的配合物:Ni2++2C4H8N2ONi(C4H7N2O)2+2H+
A、“氨浸”可除去Ca2+、Fe3+、Al3+等金属阳离子 B、进行操作I时,将有机相从分液漏斗上口倒出 C、操作II为反萃取,试剂X可为盐酸,有机相可返回操作I循环使用 D、操作III可能为过滤、洗涤、干燥、灼烧6. 正丁醛经催化加氢可得到含少量正丁醛的1-丁醇粗品,为提纯1-丁醇设计如图路线。
已知:①1-丁醇微溶于水,易溶于乙醚;
②R-CHO+NaHSO3(饱和)→R-CH(OH)SO3Na↓。
下列说法错误的是
A、试剂a为饱和NaHSO3溶液,试剂b为乙醚 B、操作I和操作III均为过滤 C、无水MgSO4的作用是干燥除水 D、蒸馏时冷却水应从球形冷凝管的上口进入7. 工业上可通过“酸性歧化法”和“电解法”制备。“酸性歧化法”中,利用软锰矿(主要成分为)先生成 , 进而制备的流程如下所示。
实验室中模拟“酸性歧化法”制备。下列说法正确的是
A、为加快“熔融”反应速率,可将矿石粉碎,并用玻璃棒不断翻炒固体 B、“酸化”时若改用盐酸,则反应为 C、“结晶”获取晶体时采用蒸发结晶 D、该流程中涉及到的氧化还原反应至少有2个8. 一定量的甲苯和溶液发生反应得到混合物,按如下流程分离出苯甲酸、回收未反应的甲苯。下列说法错误的是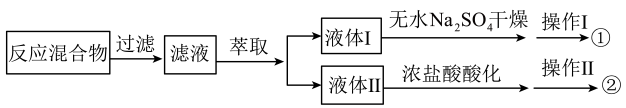 A、苯甲酸可反应形成盐、酯、酰胺、酸酐等 B、操作Ⅰ和操作Ⅱ依次为蒸发浓缩、冷却结晶和蒸馏 C、甲苯、苯甲酸依次由①、②获得 D、苯甲酸100℃时迅速升华,故其粗品精制除采用重结晶方法外,还可用升华法9. 为提纯下列物质(括号内是杂质),所选用的除杂试剂和分离方法都正确的是( )
A、苯甲酸可反应形成盐、酯、酰胺、酸酐等 B、操作Ⅰ和操作Ⅱ依次为蒸发浓缩、冷却结晶和蒸馏 C、甲苯、苯甲酸依次由①、②获得 D、苯甲酸100℃时迅速升华,故其粗品精制除采用重结晶方法外,还可用升华法9. 为提纯下列物质(括号内是杂质),所选用的除杂试剂和分离方法都正确的是( )选项
被提纯的物质
除杂试剂
分离方法
A
NaBr(aq)(NaI)
氯水、CCl4
萃取、分液
B
NH4Cl(aq)(FeCl3)
NaOH(aq)
过滤
C
CO2(CO)
CuO粉末
通过灼热的CuO粉末
D
CH3COOC2H5(CH3COOH)
C2H5OH、浓硫酸
加热蒸馏
A、A B、B C、C D、D10. 下列说法错误的是A、可用纸层析法分离含少量 Fe3+和 Cu2+的混合溶液,亲水性强的 Cu2+在滤纸条的下方 B、抽滤过程中洗涤沉淀时,应关小水龙头,加洗涤剂浸没沉淀,用玻璃棒在过滤器上搅拌以使沉淀跟洗涤剂充分接触,以便洗得更干净 C、液溴不慎溅到手上,先用苯清洗伤口,再用水洗;溴中毒时不可进行人工呼吸 D、Na3AlF6溶液中滴加稀氨水无明显白色沉淀11. 下列实验操作与物质的溶解性无关的是A、用水洗气,能除去混在CO中的HCl B、用CCl4能萃取碘水中的碘单质 C、蒸馏海水,能得到淡水 D、冷却KNO3饱和溶液,能耗析出KNO3晶体12. 以卤水(富含I-)为原料用高分子树脂提取碘的工艺流程如图所示,下列说法错误的是 A、“氧化1”过程既可以用Cl2 , 也可以用H2O2 B、“解脱”过程指在酸性条件下用Na2SO3将I2还原为I- , 离子方程式为I2+SO+2OH-=2I-+2SO+H2O C、用高分子树脂“吸附”,再“解脱”是为了便于分离富集碘元素 D、“提纯”过程是先萃取分液、蒸馏得到粗产品,再升华纯化13. “汲水而上,于釜中煎炼,顷刻结盐,色成至白”(《天工开物》生产井盐)。上述古代研究成果中涉及的物质分离操作是( )A、蒸馏 B、萃取分液 C、蒸发结晶 D、趁热过滤14. 由含硒废料(主要 含S、Se 、Fe2O3、CuO 、ZnO 、SiO2等)制取硒的流程如图:
A、“氧化1”过程既可以用Cl2 , 也可以用H2O2 B、“解脱”过程指在酸性条件下用Na2SO3将I2还原为I- , 离子方程式为I2+SO+2OH-=2I-+2SO+H2O C、用高分子树脂“吸附”,再“解脱”是为了便于分离富集碘元素 D、“提纯”过程是先萃取分液、蒸馏得到粗产品,再升华纯化13. “汲水而上,于釜中煎炼,顷刻结盐,色成至白”(《天工开物》生产井盐)。上述古代研究成果中涉及的物质分离操作是( )A、蒸馏 B、萃取分液 C、蒸发结晶 D、趁热过滤14. 由含硒废料(主要 含S、Se 、Fe2O3、CuO 、ZnO 、SiO2等)制取硒的流程如图:
下列有关说法正确的是( )
A、“分离”时得到含硫煤油的方法是蒸馏 B、“酸溶”时能除去废料中的全部氧化物杂质 C、“酸化”的离子反应为:+2H+=Se↓+SO2↑+H2O D、若向“酸溶”所得的滤液中加入少量铜,铜不会溶解二、多选题
-
15. 一种由湿法炼铜的低铜萃取余液(含Co2+、Cu2+、Fe2+、Fe3+、Mn2+、H+、)回收金属的工艺流程如下:

室温下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子
开始沉淀时的pH
7.8
5.5
5.8
1.8
8.3
完全沉淀时的pH
9.4
6.7
8.8
2.9
10.9
下列说法正确的是
A、“滤渣I”为 B、“调pH”时,选用CaO浆液代替CaO固体可加快反应速率 C、生成的离子方程式为 D、“沉钴”时,用代替可以提高的纯度16. (钴酸锂)常用作锂离子电池的正极材料。以某海水(含浓度较大的LiCl、少量、、等)为原料制备钴酸锂的一种流程如下:
已知:①的溶解度随温度升高而降低;
②常温下,几种难溶物质的溶度积数据如下:
物质
下列说法错误的是
A、高温时“合成”反应的化学方程式为 B、滤渣1主要成分有、 C、“洗涤”时最好选用冷水 D、“除杂2”调pH=12时,溶液中三、非选择题
-
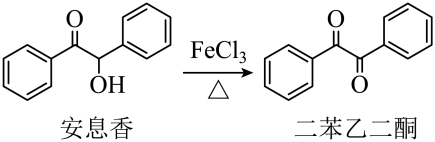
17. 实验室由安息香制备二苯乙二酮的反应式如下:
相关信息列表如下:
物质
性状
熔点/℃
沸点/℃
溶解性
安息香
白色固体
133
344
难溶于冷水
溶于热水、乙醇、乙酸
二苯乙二酮
淡黄色固体
95
347
不溶于水
溶于乙醇、苯、乙酸
冰乙酸
无色液体
17
118
与水、乙醇互溶
装置示意图如下图所示,实验步骤为:
①在圆底烧瓶中加入冰乙酸、水及 , 边搅拌边加热,至固体全部溶解。
②停止加热,待沸腾平息后加入安息香,加热回流。
③加入水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用的乙醇重结晶,干燥后得淡黄色结晶。
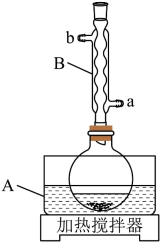
回答下列问题:
(1)、仪器A中应加入(填“水”或“油”)作为热传导介质。(2)、仪器B的名称是;冷却水应从(填“a”或“b”)口通入。(3)、实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是。(4)、在本实验中,为氧化剂且过量,其还原产物为;某同学尝试改进本实验:采用催化量的并通入空气制备二苯乙二酮。该方案是否可行?简述判断理由。(5)、本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是防止。(6)、若粗品中混有少量未氧化的安息香,可用少量洗涤的方法除去(填标号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯。a.热水 b.乙酸 c.冷水 d.乙醇
(7)、本实验的产率最接近于(填标号)。a. b. c. d.
18. 废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为CuIn0.5Ga0.5Se2。某探究小组回收处理流程如图:
回答下列问题:
(1)、硒(Se)与硫为同族元素,Se的最外层电子数为;镓(Ga)和铟(In)位于元素周期表第IIIA族,CuIn0.5Ga0.5Se2中Cu的化合价为。(2)、“酸浸氧化”发生的主要氧化还原反应的化学方程式为。(3)、25℃时,已知:Kb(NH3·H2O)≈2.0×10-5 , Ksp[Ga(OH)3]≈1.0×10-35 , Ksp[In(OH)3]≈1.0×10-33 , Ksp[Cu(OH)2]≈1.0×10-20 , “浸出液”中c(Cu2+)=0.01mol·L-1。当金属阳离子浓度小于1.0×10-5mol·L-1时沉淀完全,In3+恰好完全沉淀时溶液的pH约为(保留一位小数);若继续加入6.0mol·L-1氨水至过量,观察到的实验现象是先有蓝色沉淀,然后;为探究Ga(OH)3在氨水中能否溶解,计算反应Ga(OH)3+NH3·H2O [Ga(OH)4]-+NH 的平衡常数K=。(已知:Ga3++4OH- [Ga(OH)4]- K′= ≈1.0×1034)
(4)、“滤渣”与SOCl2混合前需要洗涤、干燥,检验滤渣中SO 是否洗净的试剂是;“回流过滤”中SOCl2的作用是将氢氧化物转化为氯化物和。(5)、“高温气相沉积”过程中发生的化学反应方程式为。19. 铬盐是重要的无机化工产品。我国某科研团队研究了一种铬铁矿(主要成分为 , 含少量、MgO和少量硬度比金刚石大的BN)液相氧化浸出制备的工艺,流程如下:
回答下列问题:
(1)、“碱浸”步骤提高浸出率的方法有(任写出一条),滤渣的成分为 , 该步骤发生反应的化学方程式是。(2)、已知 , 在“转化”步骤将铬元素完全沉淀时(离子浓度不大于),需保持转化液中至少为。(3)、“还原”步骤的尾气为无色无味气体,则其反应离子方程式为。(4)、该团队在实验室模拟流程中用到的主要分离方法,所需玻璃仪器有。(5)、立方氮化硼(BN)晶体是一种硬度比金刚石大的特殊耐磨和削切材料,其晶胞结构如图所示:
该晶体中B的配位数为 , 其晶胞参数为 , 则立方氮化硼晶体的密度为。
20. 回收钴废料能有效缓解金属资源浪费、环境污染等问题。一种以含钴催化剂废料(主要含Co、Fe,还含有少量的CoO、FeO、Fe2O3、CaO、SiO2)制备氧化钴(Co2O3)的工艺流程如下图所示:
已知:①有关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子
Fe2+
Fe3+
Co2+
开始沉淀的pH
7.5
2.2
6.7
完全沉淀的pH
9.5
3.0
8.7
②在pH为4~6时,Fe3+水解生成含Fe(OH)3·nFe3+·(n-x) 胶粒的胶体;
③金属钴与铁具有相似的化学性质;
④氧化性:Co3+>ClO-。
回答下列问题:
(1)、酸浸后,“滤渣”的主要成分有和(填化学式)。(2)、“除铁”时加入NaClO,主要反应的离子方程式为 , 再加入Na2CO3溶液调节pH,已知溶液pH对除铁率和钴回收率影响如图所示,则该步骤应控制pH范围为 , 图中钴回收率骤降的可能原因是。 (3)、“滤液2”中主要溶质的常见用途为。(4)、“沉钴2”中加入(NH4)2C2O4使Co2+沉淀完全[c(Co2+)<10-5mol·L-1],控制的浓度不小于mol·L-1[已知:Ksp(CoC2O4)=6.3×10-8]21. 碳酸锶( SrCO3)主要用于制造磁性材料、电子元件等。利用锶渣(主要成分SrSO4 , 含少量CaCO3、Fe2O3、 Al2O3、MgCO3杂质),工业上制备超细碳酸锶的工艺如图所示:
(3)、“滤液2”中主要溶质的常见用途为。(4)、“沉钴2”中加入(NH4)2C2O4使Co2+沉淀完全[c(Co2+)<10-5mol·L-1],控制的浓度不小于mol·L-1[已知:Ksp(CoC2O4)=6.3×10-8]21. 碳酸锶( SrCO3)主要用于制造磁性材料、电子元件等。利用锶渣(主要成分SrSO4 , 含少量CaCO3、Fe2O3、 Al2O3、MgCO3杂质),工业上制备超细碳酸锶的工艺如图所示:
已知:①25℃时溶液中金属离子物质的量浓度c与溶液pH的关系如图所示:

②Sr (OH)2、 Ca (OH) 2在不同温度下的溶解度表
温度/℃
0
20
40
60
80
90
100
Ca(OH)2/g
0.19
0.17
0.14
0.12
0.09
0.08
0.07
Sr(OH)2/g
0.91
1.77
3.95
8.42
20.20
44.50
91.20
回答下列问题:
(1)、“高温煅烧”得到的主要产物为锶的硫化物和一种可燃性气体。 则“高温煅烧”的主要反应化学方程式为。(2)、气体2的主要成分为(填化学式)。(3)、不设置步骤1的后果是。(4)、“除铁铝” 后溶液温度降至室温(25℃) ,溶液中c(Fe3+) 为mol/L。(5)、“除镁钙”过程温度控制在95℃~100℃的目的是。(6)、“沉锶” 的离子反应方程式为。(7)、“沉锶”过程中反应温度对锶转化率的影 响如图所示,温度高于60℃时,锶转化率降低的原因为。 (8)、从平衡移动的角度分析“沉锶”过程中控制pH≥10的原因。22. 铬盐是重要的无机化工产品。我国某科研团队研究了一种铬铁矿(主要成分为 , 含少量、MgO和少量硬度比金刚石大的BN)液相氧化浸出制备的工艺,流程如下:
(8)、从平衡移动的角度分析“沉锶”过程中控制pH≥10的原因。22. 铬盐是重要的无机化工产品。我国某科研团队研究了一种铬铁矿(主要成分为 , 含少量、MgO和少量硬度比金刚石大的BN)液相氧化浸出制备的工艺,流程如下:
回答下列问题:
(1)、“碱浸”步骤提高浸出率的方法有(任写出一条),滤渣的成分为 , 该步骤发生反应的化学方程式是。(2)、已知 , 在“转化”步骤将铬元素完全沉淀时(离子浓度不大于),需保持转化液中至少为。(3)、“还原”步骤的尾气为无色无味气体,则其反应离子方程式为。(4)、该团队在实验室模拟流程中用到的主要分离方法,所需玻璃仪器有。(5)、立方氮化硼(BN)晶体是一种硬度比金刚石大的特殊耐磨和削切材料,其晶胞结构如图所示:
该晶体中B的配位数为 , 其晶胞参数为 , 则立方氮化硼晶体的密度为。
23. 湿法炼锌综合回收系统产出的萃余液中含有Na2SO4、ZnSO4、H2SO4 , 还含有Mn2+、Co2+、Ni2+、Cd2+、Fe2+、Al3+等,一种将萃余液中有价离子分步分离、富集回收的工艺流程如下:
回答下列问题:
(1)、“氧化”时,Mn2+、Fe2+均发生反应。后者发生反应时,氧化剂与还原剂的物质的量之比为。(2)、“调pH”时,所得“滤渣1”中除含有MnO2和Fe(OH)3外,还有。(3)、“除镉”时,发生反应的类型为。(4)、“除钴镍”时,有机净化剂的基本组分为大分子立体网格结构的聚合物。其净化原理可表示为:
反应时,接受电子对的一方是;Co2+、Ni2+能发生上述转化而Zn2+不能,推测可能的原因为。
(5)、“沉锌”时有气体生成,则生成碱式碳酸锌的离子方程式为。(6)、“沉锌”时,所得滤液经硫酸酸化后,用惰性电极电解可制备Na2S2O8 , 从而实现原料的循环利用,该电解过程中总反应的化学方程式为。(7)、氧化锌有多种晶体结构,其中一种晶胞结构及晶胞参数如图所示。已知阿伏加德罗常数的值为NA , 则该氧化锌晶体的密度为 g∙cm-3 (列出计算式即可)。 24. 工业上以钛铁矿(主要成分为FeTiO3 , 含有SiO2、Fe3O4、MgO、CaO杂质)为原料制备金属钛,并得到副产品FeSO4•7H2O,其工艺流程如图:
24. 工业上以钛铁矿(主要成分为FeTiO3 , 含有SiO2、Fe3O4、MgO、CaO杂质)为原料制备金属钛,并得到副产品FeSO4•7H2O,其工艺流程如图: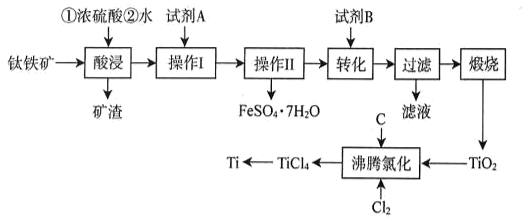
已知:①TiO2+易水解,只能存在于强酸性溶液中;高温下Ti易与N2 , H2反应。
②25℃时相关物质的Ksp见表:
物质
Fe(OH)2
Fe(OH)3
Mg(OH)2
TiO(OH)2
Ksp
1.0×10-16.3
1.0×10-38.6
1.0×10-11.6
1.0×10-29
回答下列问题:
(1)、矿渣的主要成分是;试剂A为(填化学式)。(2)、“酸段”时,钛铁矿与浓硫酸在160~200℃反应,FeTiO3转化为Fe2+和TiO2+ , 该工序主要反应的化学方程式为;加水浸取前需先冷却的目的是。(3)、“转化”工序,加入试剂B调节pH。①试剂B为(填标号)。
A.H2SO4 B.H2O2 C.Na2CO3 D.NH4Cl
②为沉钛完全[c(TiO2+)≤1.0×10-5mol•L-1]需要调节溶液的pH略大于。
(4)、“沸腾氯化”中,氯气与矿料逆流而行,目的是 , 充分反应后,混合气体中各组分的分压如表:物质
TiCl4
Cl2
CO
CO2
分压MPa
4.59×10-2
4.98×10-9
1.84×10-2
3.70×10-2
该温度下,TiO2与C、Cl2反应的总化学方程式为。
(5)、高温下镁与TiCl4反应制备粗钛时需加保护气,下列可作为保护气的是____(填标号)。A、N2 B、H2 C、CO2 D、Ar25. 主要用于电镀工业、生产镍镉电池,用作油脂加氢催化剂、媒染剂等。某兴趣小组用含镍废催化剂(主要含有 , 还含有、、及其他不溶于酸、碱的杂质)制备 , 其流程如下: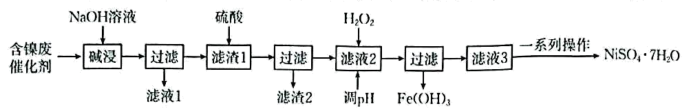
已知:①常温下,部分金属化合物的近似值如表所示:
化学式
近似值
②金属活泼性:。
③。
回答下列问题:
(1)、元素在元素周期表中的位置为 , 其基态原子的价层电子排布式为。(2)、“滤液1”中的主要溶质为、。(3)、加入硫酸时,发生反应的离子方程式为。(4)、加入的目的是将氧化为 , 该步骤(填“能”或“不能”)用适量稀硝酸代替,理由是。然后调节溶液的 , 则此时应调节溶液的至少为(保留3位有效数字,离子浓度小于或等于时认为沉淀完全),检验“滤液3”中杂质金属离子已除尽的操作和现象是。(5)、用配位滴定法测定粗品中的纯度。取粗品溶于水(滴加几滴稀硫酸)配成溶液,取溶液于锥形瓶中,滴入几滴紫脲酸胺指示剂(紫色试剂,遇显橙黄色),用浓度为的标准液滴定,平均消耗标准液。已知:。粗品中的纯度是%;下列操作会使测定结果偏低的是(填标号)。A.锥形瓶中溶液颜色由橙黄色局部变为紫色后立即停止滴定
B.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡
C.滴定前平视读数,滴定后仰视读数
26. 实验室以含硒废料(假设杂质不参与反应)提取硒,部分实验过程如下: (1)、“浸取”时单质硒大部分生成二元弱酸H2SeO3 , 该反应离子方程式为(2)、H2SeO4溶液转化为H2SeO3溶液的实验可在如图装置中进行。滴液漏斗中液体是 (填名称)。
(1)、“浸取”时单质硒大部分生成二元弱酸H2SeO3 , 该反应离子方程式为(2)、H2SeO4溶液转化为H2SeO3溶液的实验可在如图装置中进行。滴液漏斗中液体是 (填名称)。 (3)、H2SeO3溶液与SO2反应制备硒单质,反应后溶液中物质的量减少的离子有(填化学式)(4)、以上述流程中生成的H2SeO3溶液为原料制取高纯硒单质,请补充完整实验方案:取一定量H2SeO3溶液, , 得高纯硒单质。 (必须使用的试剂: BaCl2溶液、1 mol·L-1NaOH溶液)(5)、实验室常用氧化还原滴定法测定某样品中Se的质量分数,步骤如下:
(3)、H2SeO3溶液与SO2反应制备硒单质,反应后溶液中物质的量减少的离子有(填化学式)(4)、以上述流程中生成的H2SeO3溶液为原料制取高纯硒单质,请补充完整实验方案:取一定量H2SeO3溶液, , 得高纯硒单质。 (必须使用的试剂: BaCl2溶液、1 mol·L-1NaOH溶液)(5)、实验室常用氧化还原滴定法测定某样品中Se的质量分数,步骤如下:I.取0.8400 g样品充分磨碎,加酸煮沸配成H2SeO3溶液,将溶液完全转移到250 mL容量瓶中后定容。
II.准确量取25.00 mL待测液于锥形瓶中,加入0.0200 mol·L-1KMnO4标准溶液25.00 mL,向锥形瓶中再加入25.00 mL 0.06 mol·L-1Fe2+溶液,加入磷酸后再用0.0200mol·L-1KMnO4滴定,消耗KMnO4溶液10.00 mL。
已知:Se的最高价含氧酸氧化Fe2+较慢,在该滴定过程可忽略此反应。计算硒的质量分数 (写出计算过程)。
27. 镀锌钢构件的酸洗废液中含有盐酸、和。实验室从酸洗废液中回收盐酸和的实验流程如下:
已知化合物的溶解度(水)数据如下表:
物质
49.7
59.0
62.5
66.7
70.0
78.3
88.7
94.9
342
363
395
437
452
488
541
614
回答下列问题:
(1)、I.回收盐酸和粗产品操作1应选择____(填字母序号)。
A、水浴加热 B、油浴加热 C、投入沸石(2)、为了获得粗产品,应适时停止加热且留有少量残余液,这样做除了防止被氧化外,另一目的是;若留有残余液过多,会造成的不良后果是(答一条)。(3)、II.粗产品的重结晶检验粗产品中含有的操作方法是。
(4)、重结晶前加入的物质X为;操作2的名称是。(5)、III.滴定亚铁离子,测定晶体纯度准确称取重结晶后的晶体,溶于混酸中并定容至。移取三份溶液,加入指示剂,用标准溶液()滴定至终点,半分钟内不恢复,平均消耗标准溶液体积为(此时不被氧化)。
计算晶体的纯度为(含a、c的代数式,化到最简)。
28. 锰酸锂是一种锂电池的正极材料。工业上以方锰矿(主要成分为 , 还含有少量的)为原料制备锰酸锂的流程如下:
已知:I.时,相关物质的如下表:
物质
II.时,电离常数
III.离子浓度低于时即为沉淀完全
回答下列问题:
(1)、写出步骤①溶于稀硫酸时杂质反应的离子方程式。(2)、滤渣1的成分是(填化学式);步骤②加入的目的是。(3)、步骤③加入目的是除去杂质离子,若溶液中浓度为 , 要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控的范围应该为。反应的平衡常数。(4)、“离子交换”步骤和“洗脱”过程是利用反应:(是氢型交换树脂)的平衡移动将进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用。(5)、步骤④反应未见气体生成,则该反应留存在滤液3中的产物有(填化学式)。(6)、步骤⑤反应的化学方程式为。29. 铟被广泛应用于电子工业、航空航天、太阳能电池新材料、合金制造等高科技领域。自然界铟大多富集在闪锌矿(主要成分 , 还含有、等杂质)中,工业上常采用铅锌冶炼过程中的含铟烟灰作为回收铟的主要原料。如图为工业提取铟的流程图: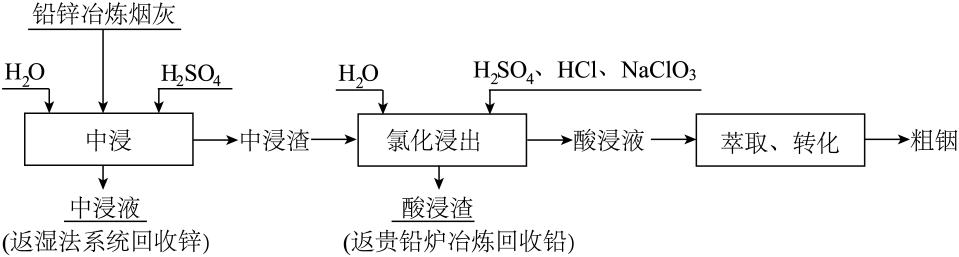
已知:①烟灰中钢主要以硫化铟、氧化铟以及和形式存在,其中和的化学性质非常稳定,难以被硫酸溶解浸出。
②铅锌冶炼烟灰先经稀硫酸溶液预处理后得到中浸渣,主要成分如下:
成分
质量分数(%)
0.72
3.01
60.48
8.92
1.16
③酸性条件下,温度过高,氯酸钠易分解释放出氯气。
回答下列问题:
(1)、铟元素位于元素周期表第周期族。(2)、闪锌矿经氧化焙烧可获得铅锌烟灰,焙烧时气体与矿料逆流而行,目的是。(3)、写出闪锌矿主要成分氧化焙烧反应的化学方程式。(4)、已知与发生反应生成配合离子 , 不利于的萃取,则“氯化浸出”实验中加入硫酸的原因是。(5)、氯化步骤中,铟元素被氧化到最高正价,写出氯化过程中发生反应的离子方程式(产物中元素以形式存在)。在氯化过程中,反应温度、时长、盐酸、硫酸、氯酸钠的浓度都会影响铟元素的浸出率,控制其他条件不变,考查不同浸出温度对铟浸出率的影响,结果如图所示。实验采取的是80℃的条件,原因是。 (6)、转化步骤中往往需要加入“锌粉”,其作用是。30. 五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、石油精炼用的催化剂等。科研人员研制了一种从废钒催化剂中(含有、、、、等)回收钒的工艺,其主要流程如下:
(6)、转化步骤中往往需要加入“锌粉”,其作用是。30. 五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、石油精炼用的催化剂等。科研人员研制了一种从废钒催化剂中(含有、、、、等)回收钒的工艺,其主要流程如下: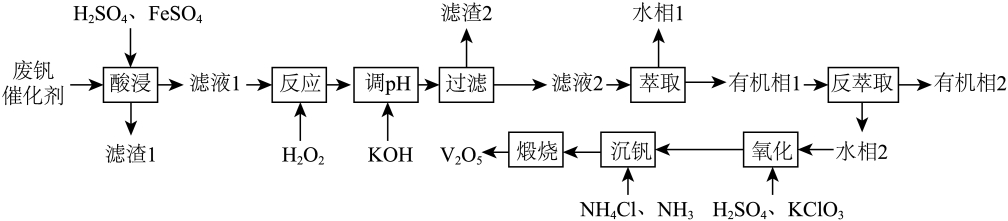
回答下列问题:
(1)、滤渣1的主要成分是(填化学式)。(2)、已知有机萃取剂萃取的能力比萃取的能力强。滤液2中的含钒离子为(填化学式);实验室进行萃取操作时,需要不时打开分液漏斗活塞放气,正确的放气图示(填标号)。A.
 B.
B. C.
C. (3)、“酸浸”时,发生反应 , 发生反应的离子方程式为;“反应”时,加入的不宜过量,其原因是。(4)、已知溶液中与可相互转化: , 且为沉淀,“沉钒”时通入氨气的作用是。(5)、该工艺流程中,可以循环使用的物质有。31. 我国科学家开发催化剂来提高燃料电池的性能。某小组以含镍废料(主要含、 , 以及少量、、、、、和等)为原料提取镍的流程如下:
(3)、“酸浸”时,发生反应 , 发生反应的离子方程式为;“反应”时,加入的不宜过量,其原因是。(4)、已知溶液中与可相互转化: , 且为沉淀,“沉钒”时通入氨气的作用是。(5)、该工艺流程中,可以循环使用的物质有。31. 我国科学家开发催化剂来提高燃料电池的性能。某小组以含镍废料(主要含、 , 以及少量、、、、、和等)为原料提取镍的流程如下: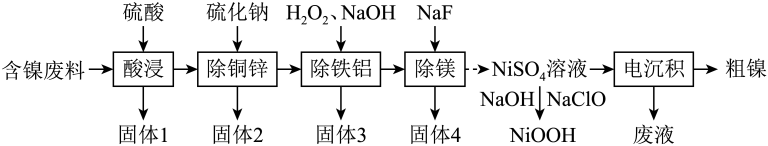
已知常温下部分难溶物的如表所示:
物质
请回答下列问题:
(1)、“酸浸”中产生了一种还原性气体,它是(填化学式);“除铁铝”中双氧水的作用是。(2)、“固体2”中除、外,还可能含硫单质等物质,生成硫单质的离子方程式为。(3)、为提高原料利用率,“电沉积”得到的“废液”可以循环用于(填名称)工序。(4)、常温下,在“除铁铝”中,当滤液中时,其。(5)、可以通过电解法提纯镍,粗镍作(填“阳”或“阴”)极,阴极的电极反应式为。32. 金属钛(Ti)因硬度大、熔点高、密度小、抗腐蚀性强而被广泛用作高新科技材料,披誉为“太空金属”。工业上用某金属氧化物的混合物(主要成分有TiO2、FeO、Fe2O3、Al2O3、CuO)来制备钛、铁红等的工艺流程如下:
回答下列问题:
(1)、为加快"水溶”速率,可采取的措施为(写出一种即可)。(2)、“滤液E”中除含有过量的硫酸和硫酸铝外,还含有。(3)、已知二氧化钛能与熔融的氢氧化钠反应生产Na2TiO3 , 在酸性条件下TiO主要以TiO2+的形式存在,TiO2+水解生成H2TiO2(沉淀)的离子方程式为。“滤液A”到“滤液E"需加热的原因是。(4)、为了便于分离铁和铜,通常要将Fe2+氧化成Fe3+ , 使用的氧化剂合理的是 , 调节pH的目的是。(5)、用“滤液D”制胆矾的步骤为蒸发浓缩、、过滤、冰水洗涤、自然风干。(6)、取500 mL “滤液E” ,经过一系列变化后,电解得到5.4 g Al,不考虑变化过程中铝的损耗,则“滤液E"中Al2(SO4)3的物质的量浓度为mol·L-1。33. 我国稀土资源丰富,其中二氧化铈(CeO2) 是一种重要的稀土氧化物,具有吸收强紫外光线的能力,可以用于光催化降解有机污染物,利用氟碳铈矿(主要成分为CeCO3F)制备CeO2的工艺流程如下: (1)、CeCO3F其中Ce元素的化合价为。(2)、“焙烧”过程中可以加快反应速率,提高焙烧效率的方法有 ( 写出一种即可)。(3)、操作①所需的玻璃实验仪器有烧杯、、。(4)、上述流程中 盐酸可用硫酸和H2O2替换,避免产生污染性气体Cl2 , 由此可知氧化性: CeO2 H2O2 (填“>”或“<”)。(5)、写出“沉铈”过程中的离子反应方程式。
(1)、CeCO3F其中Ce元素的化合价为。(2)、“焙烧”过程中可以加快反应速率,提高焙烧效率的方法有 ( 写出一种即可)。(3)、操作①所需的玻璃实验仪器有烧杯、、。(4)、上述流程中 盐酸可用硫酸和H2O2替换,避免产生污染性气体Cl2 , 由此可知氧化性: CeO2 H2O2 (填“>”或“<”)。(5)、写出“沉铈”过程中的离子反应方程式。若“沉铈”中,Ce3+恰好沉淀完全[c(Ce3+)为1.0×10-5mol·L-1 , 此时溶液的pH为5,则溶液中c()= mol·L-1 (保留2位有效数字)。
已知常温下:
(6)、Ce4+溶 液可以吸收大气中的污染物NOx , 减少空气污染,其转化过程如图所示(以NO2为例)。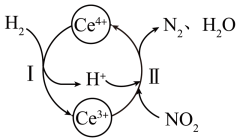
①该反应中的催化剂为(写离子符号);
②该转化过程中还原剂与氧化剂物质的量之比为。
34. LiFePO4可作为新型锂离子电池的正极材料。以精钛铁矿(主要成分为FeTiO3、Fe2O3及少量CuO、SiO2杂质)为主要原料生产TiOSO4 , 同时得到的绿矾(FeSO4·7H2O)与磷酸和LiOH反应可制备LiFePO4 , 制备流程如图所示:
请回答下列问题:
(1)、反应之前先将矿石粉碎的目的是。(2)、酸溶时钛酸亚铁(FeTiO3)与硫酸反应的化学方程式为。(3)、①还原步骤中,加过量铁屑,其目的是。②滤渣成分的化学式是
(4)、滤渣中的铜提纯后可用于制取Cu2O,工业制取Cu2O的电解池示意图如图,总反应为:2Cu+H2OCu2O+H2↑。则:
①该装置中铜电极应连接直流电源的极。
②石墨电极的电极反应式为。
③当有0.1molCu2O生成时电路中转移mol电子。
35. 工业上以铬铁矿(主要成分为FeO和Cr2O3 , 含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:
查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42- , 自身被还原为Bi(OH)3固体。
ii.
物质
Fe(OH)3
Al(OH)3
Cr(OH)3
Fe(OH)2
Bi(OH)3
开始沉淀的pH
2.7
3.4
4.6
7.5
0.7
完全沉淀的pH
3.7
4.4
5.9
9.7
4.5
回答下列问题:
(1)、将铬铁矿矿石粉碎的目的是。(2)、操作I、III、IV用到的主要玻璃仪器有玻璃棒和(填仪器名称)。(3)、写出④反应的化学方程式。(4)、⑤中酸化是使CrO42-转化为Cr2O72-。写出该反应的离子方程式。(5)、将溶液H经下列操作:蒸发浓缩, , 过滤,洗涤,干燥即得红矾钠。(6)、取一定质量的固体D溶解于200mL的稀硫酸中,向所得溶液中加入5.0mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为 , 固体D中含Fe化合物的物质的量为。