高考二轮复习知识点:洗气
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 下列气体中,既可用浓硫酸干燥,又可用碱石灰固体干燥的是A、 B、 C、 D、2. 在实验室采用如图所示装置进行气体的干燥、收集和尾气处理,合理的是( )
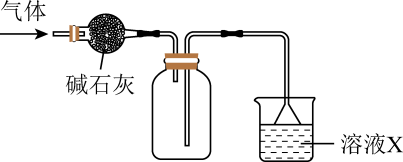
选项
气体
溶液X
A
NO
氢氧化钠溶液
B
NH3
水
C
SO2
氢氧化钠溶液
D
Cl2
饱和食盐水
A、A B、B C、C D、D3. 四氯化锡常用作合成有机锡化合物的原料。利用下图装置使含锡硫渣与氯气反应制备四氯化锡并进行尾气处理。
已知:①无水四氯化锡的熔点为-33℃、沸点为114.1℃;②四氯化锡易水解。下列说法正确的是( )
A、装置A中KClO3可用MnO2替代 B、装置D中球形冷凝管的进水口为1、出水口为2 C、装置B的作用是吸收HCl D、装置E中的试剂为无水氯化钙4. 下列关于氯气的实验装置能达到实验目的的是( )A
B
C
D


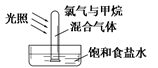

干燥氯气
收集氯气
探究氯气与甲烷的反应
证明氯气具有漂白性
A、A B、B C、C D、D5. 利用如图所示洗气装置,不可以达到除杂目的的是( )选项
气体(杂质)
广口瓶内的试剂
洗气装置
A
Cl2 (HCl)
饱和NaCl溶液

B
C2H4 (CO2)
NaOH溶液
C
C2H6 (C2H4 )
酸性KMnO4溶液
D
CO2 (SO2)
饱和NaHCO3溶液
A、A B、B C、C D、D6. 实验室在500℃时,隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有FeO、Fe2O3和Fe3O4 , 气体产物可能有NH3、N2、H2O、SO3和SO2)。下列说法正确的是( )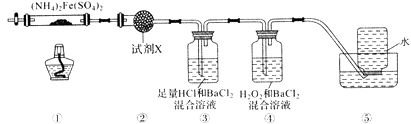 A、取①中固体残留物与稀硫酸反应并滴加KSCN,溶液变红,则残留物一定为Fe2O3 B、装置②用于检验分解产物中是否有水蒸气生成,试剂X最好选用碱石灰 C、装置③用于检验分解产物中是否有SO3气体生成并除去SO3和NH3 D、装置④用于检验分解产物中是否有SO2气体生成,装置⑤用于收集生成的NH3和N27. 下列对物质用途的描述中,错误的是( )A、铝可用于冶炼某些熔点较高的金属 B、Na2O2可用作漂白剂 C、碱石灰可用于干燥CO2、NH3等气体 D、NaClO可用作消毒剂8. 实验是化学研究的基础,下列关于各实验装置的叙述正确的是( )
A、取①中固体残留物与稀硫酸反应并滴加KSCN,溶液变红,则残留物一定为Fe2O3 B、装置②用于检验分解产物中是否有水蒸气生成,试剂X最好选用碱石灰 C、装置③用于检验分解产物中是否有SO3气体生成并除去SO3和NH3 D、装置④用于检验分解产物中是否有SO2气体生成,装置⑤用于收集生成的NH3和N27. 下列对物质用途的描述中,错误的是( )A、铝可用于冶炼某些熔点较高的金属 B、Na2O2可用作漂白剂 C、碱石灰可用于干燥CO2、NH3等气体 D、NaClO可用作消毒剂8. 实验是化学研究的基础,下列关于各实验装置的叙述正确的是( ) A、装置①常用于分离互相溶解且沸点相差10℃以上的液态混合物 B、装置②可用于吸收NH3或HCl气体,并防止到吸 C、装置③可用于收集H2、CO2、Cl2、NH3等气体 D、装置④可用于干燥、收集氨气,若将碱石灰改成五氧化二磷,可用于干燥、收集氯化氢9. 下列实验装置进行的相应实验,达不到实验目的的是( )
A、装置①常用于分离互相溶解且沸点相差10℃以上的液态混合物 B、装置②可用于吸收NH3或HCl气体,并防止到吸 C、装置③可用于收集H2、CO2、Cl2、NH3等气体 D、装置④可用于干燥、收集氨气,若将碱石灰改成五氧化二磷,可用于干燥、收集氯化氢9. 下列实验装置进行的相应实验,达不到实验目的的是( ) A、用图1所示装置除去CO2中含有的少量HCl气体 B、用图2所示装置加热蒸发NaCl饱和溶液制备NaCl晶体 C、用图3所示装置制取少量CO2气体 D、用图4所示装置除去少量黄河水中的泥沙10. CaCl2固体常用作许多气体的干燥剂,但CaCl2固体遇NH3会形成CaCl2•8NH3(可溶于水),下列说法不正确的是( )A、CaCl2与NH3形成CaCl2•8NH3的过程属于化学变化 B、CaCl2作干燥剂时,不能干燥NH3 C、可预测CaCl2•8NH3不稳定,受热易分解 D、向CaCl2•8NH3溶于水后的溶液中通入少量CO2 , 无明显现象产生11. 如图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨气和氯化氢,烧杯内盛装滴有石蕊试液的蒸馏水。下列说法错误的是( )
A、用图1所示装置除去CO2中含有的少量HCl气体 B、用图2所示装置加热蒸发NaCl饱和溶液制备NaCl晶体 C、用图3所示装置制取少量CO2气体 D、用图4所示装置除去少量黄河水中的泥沙10. CaCl2固体常用作许多气体的干燥剂,但CaCl2固体遇NH3会形成CaCl2•8NH3(可溶于水),下列说法不正确的是( )A、CaCl2与NH3形成CaCl2•8NH3的过程属于化学变化 B、CaCl2作干燥剂时,不能干燥NH3 C、可预测CaCl2•8NH3不稳定,受热易分解 D、向CaCl2•8NH3溶于水后的溶液中通入少量CO2 , 无明显现象产生11. 如图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨气和氯化氢,烧杯内盛装滴有石蕊试液的蒸馏水。下列说法错误的是( )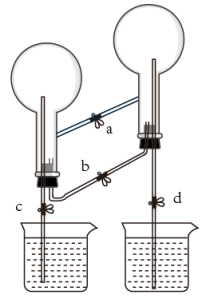 A、在实验室中,不能直接分解氯化铵制备氨气 B、在实验室中制备干燥的氨气和氯化氢时,不能都选用无水氯化钙作干燥剂 C、实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉 D、喷泉结束后,将烧瓶内溶液混合后得到氯化铵溶液,蒸干可得氯化铵固体12. 以下实验操作,不能达到目的的是( )
A、在实验室中,不能直接分解氯化铵制备氨气 B、在实验室中制备干燥的氨气和氯化氢时,不能都选用无水氯化钙作干燥剂 C、实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉 D、喷泉结束后,将烧瓶内溶液混合后得到氯化铵溶液,蒸干可得氯化铵固体12. 以下实验操作,不能达到目的的是( ) A、装置甲∶既可以盛装浓硫酸干燥 , 也可以用来收集 B、装置乙∶根据铝热反应原理可制得金属锰 C、装置丙∶实验室制取乙酸乙酯 D、装置丁∶挤压胶头滴管水滴下后,气球会鼓起来13. 下列实验装置设计符合题意,且能达到实验目的的是( )
A、装置甲∶既可以盛装浓硫酸干燥 , 也可以用来收集 B、装置乙∶根据铝热反应原理可制得金属锰 C、装置丙∶实验室制取乙酸乙酯 D、装置丁∶挤压胶头滴管水滴下后,气球会鼓起来13. 下列实验装置设计符合题意,且能达到实验目的的是( ) A、图1:分离苯和溴苯 B、图2:制取少量Fe(OH)2 C、图3:分离乙酸和乙醇 D、图4:除甲烷中的乙烯14. 在化学实验中,经常要进行分离提纯,下列除去杂质的方法正确的是( )A、除去 中少量的 :将气体通过盛有饱和碳酸钠溶液的洗气瓶 B、除去乙烷中少量的乙烯:通入氢气,在催化剂条件下加热 C、除去淀粉溶液中少量的蛋白质:放入半透膜袋中进行渗析操作 D、除去乙醇中少量的水:加足量生石灰,蒸馏15. 为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是( )
A、图1:分离苯和溴苯 B、图2:制取少量Fe(OH)2 C、图3:分离乙酸和乙醇 D、图4:除甲烷中的乙烯14. 在化学实验中,经常要进行分离提纯,下列除去杂质的方法正确的是( )A、除去 中少量的 :将气体通过盛有饱和碳酸钠溶液的洗气瓶 B、除去乙烷中少量的乙烯:通入氢气,在催化剂条件下加热 C、除去淀粉溶液中少量的蛋白质:放入半透膜袋中进行渗析操作 D、除去乙醇中少量的水:加足量生石灰,蒸馏15. 为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是( )序号
不纯物
除杂试剂
分离方法
A
CH4(C2H4)
酸性KMnO4溶液
洗气
B
C2H5OH(乙酸)
新制生石灰
蒸馏
C
乙酸乙酯(乙醇)
饱和Na2CO3溶液
蒸馏
D
NH4Cl溶液(FeCl3)
NaOH溶液
过滤
A、A B、B C、C D、D16. 实验室按如下装置测定纯碱(含少量NaCl)的纯度。下列说法正确的是( ) A、滴入盐酸前,应先通入一段时间的空气 B、在装置②、③间添加盛有饱和NaHCO3溶液的洗气瓶,测定结果更准确 C、若省去装置④,对测定结果无影响 D、反应结束后,无需再通入空气17. 下列去除杂质的方法中,能达到相应目的的是( )
A、滴入盐酸前,应先通入一段时间的空气 B、在装置②、③间添加盛有饱和NaHCO3溶液的洗气瓶,测定结果更准确 C、若省去装置④,对测定结果无影响 D、反应结束后,无需再通入空气17. 下列去除杂质的方法中,能达到相应目的的是( )选项
物质(杂质)
方法
A
(炭粉)
在氧气流中灼烧
B
加热升华
C
HCl气体( )
通过KI溶液
D
加入盐酸溶解、过滤、洗涤及干燥
A、A B、B C、C D、D18. 下述实验设计能够达到目的的是( )选项
目的
试剂
操作
A
CO2(SO2)
饱和碳酸氢钠溶液、浓硫酸
洗气
B
HNO3(H2SO4)
BaCl2溶液
过滤
C
提取碘水中的碘
乙醇
萃取
D
检验Fe2+
氯水、KSCN溶液
向样品溶液中滴入氯水后,再滴加KSCN溶液
A、A B、B C、C D、D19. 无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用Al和氯气通过下装置制备。已知A中产生的氯气混有少许HCl和水蒸气。则下列说法正确的是( )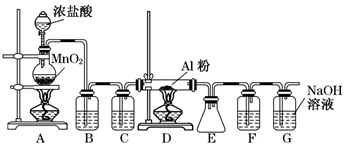 A、试剂瓶B,C,F中分别盛饱和NaHCO3、浓硫酸、浓硫酸 B、氯化铝产品最后在装置E中收集 C、实验开始时应先点燃D处酒精灯 D、装置F和G可用盛无水CaCl2的干燥管替换20. 如图所示的实验操作,能达到相应目的的是( )A、干燥Cl2
A、试剂瓶B,C,F中分别盛饱和NaHCO3、浓硫酸、浓硫酸 B、氯化铝产品最后在装置E中收集 C、实验开始时应先点燃D处酒精灯 D、装置F和G可用盛无水CaCl2的干燥管替换20. 如图所示的实验操作,能达到相应目的的是( )A、干燥Cl2 B、检验K2CO3中的K+
B、检验K2CO3中的K+  C、稀释浓硫酸
C、稀释浓硫酸  D、定容
D、定容  21. 用下列装置不能达到实验目的的是( )
21. 用下列装置不能达到实验目的的是( )实验室制氨气
海水蒸馏制淡水
证明乙醇与浓硫酸共热生成乙烯
用CuSO4溶液净化乙炔气体




A
B
C
D
A、A B、B C、C D、D22. 为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法均正确的一组是( )选项
待提纯的物质
除杂试剂
分离方法
A
Cl2(H2O)
饱和NaCl溶液
洗气
B
CH3CH2OH(H2O)
CaO
蒸馏
C
FeCl2(FeCl3)
Cu
过滤
D
 (Br2)
(Br2)CCl4
萃取
A、A B、B C、C D、D23. 用下图所示装置及药品进行相应实验,能达到实验目的的是( ) A、图1分离乙醇和乙酸 B、图2除去乙炔中的乙烯 C、图3除去溴苯中的溴单质 D、图4除去工业酒精中的甲醇24. 下列实验操作能达到实验目的的是( )A、用长颈漏斗分离出乙酸与乙醇反应的产物 B、用向上排空气法收集铜粉与稀硝酸反应产生的NO C、配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 D、将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl225. 欲除去下列物质中混入的少量杂质(括号内为杂质),所选试剂错误的是( )A、C2H6(C2H4):氢气 B、溴苯(Br2):NaOH溶液 C、NO(NO2):水 D、CO2(SO2):饱和NaHCO3溶液26. 下列有关实验的说法正确的是( )A、用无水硫酸铜检验乙醇中是否有水 B、配制一定物质的量浓度的溶液时,容量瓶必须干燥 C、除去乙烷中含有的少量乙烯可用酸性高锰酸钾溶液洗气 D、往2%的稀氨水中加入2%的硝酸银溶液,至沉淀恰好溶解,制得澄清的银氨溶液27. 下列实验能达到预期目的的是( )A、
A、图1分离乙醇和乙酸 B、图2除去乙炔中的乙烯 C、图3除去溴苯中的溴单质 D、图4除去工业酒精中的甲醇24. 下列实验操作能达到实验目的的是( )A、用长颈漏斗分离出乙酸与乙醇反应的产物 B、用向上排空气法收集铜粉与稀硝酸反应产生的NO C、配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 D、将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl225. 欲除去下列物质中混入的少量杂质(括号内为杂质),所选试剂错误的是( )A、C2H6(C2H4):氢气 B、溴苯(Br2):NaOH溶液 C、NO(NO2):水 D、CO2(SO2):饱和NaHCO3溶液26. 下列有关实验的说法正确的是( )A、用无水硫酸铜检验乙醇中是否有水 B、配制一定物质的量浓度的溶液时,容量瓶必须干燥 C、除去乙烷中含有的少量乙烯可用酸性高锰酸钾溶液洗气 D、往2%的稀氨水中加入2%的硝酸银溶液,至沉淀恰好溶解,制得澄清的银氨溶液27. 下列实验能达到预期目的的是( )A、 蒸发溴水获取溴单质
B、
蒸发溴水获取溴单质
B、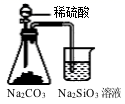 证明碳酸酸性强于硅酸
C、
证明碳酸酸性强于硅酸
C、 比较NaHCO3和Na2CO3的热稳定性
D、
比较NaHCO3和Na2CO3的热稳定性
D、 除去氯气中的HCl杂质
28. 除去下列物质中的杂质(括号内的物质),所使用的试剂和主要操作都正确的是( )
除去氯气中的HCl杂质
28. 除去下列物质中的杂质(括号内的物质),所使用的试剂和主要操作都正确的是( )选项
物质
使用的试剂
主要操作
A
乙醇(水)
金属钠
蒸馏
B
乙酸乙酯(乙酸)
饱和碳酸钠溶液
分液
C
FeCl2(FeCl3)溶液
过量铜粉
过滤
D
乙烯(SO2)
酸性高锰酸钾溶液
洗气
A、A B、B C、C D、D二、多选题
-
29. 下列关于物质应用和组成的说法正确的是( )A、P2O5可用于干燥Cl2和NH3 B、“可燃冰”主要成分是甲烷和水 C、CCl4可用于鉴别溴水和碘水 D、Si和SiO2都用于制造光导纤维
三、非选择题
-
30. 亚硫酰氯(SOCl2)又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,其熔点-105℃,沸点79℃,140℃以上时易分解。遇水剧烈反应生成SO2和另一种酸性气体,常用作脱水剂,主要用于制造酰基氯化物,还用于医药、农药、染料等的生产。
实验室合成SOCl2的原理之一为SO2+Cl2+SCl22SOCl2 , 部分装置(夹持、加热装置略去)如图所示。
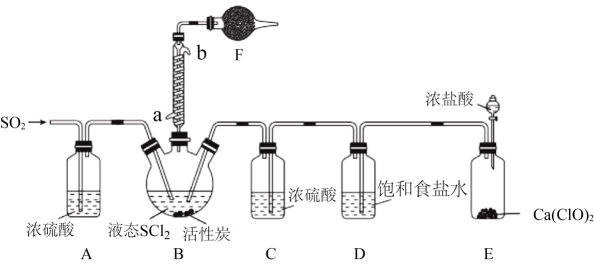 (1)、①仪器F的名称为 , 所盛的试剂是;
(1)、①仪器F的名称为 , 所盛的试剂是;②装置A、C除干燥气体外,另一作用可能是;
如果没有A、C,二氧化硫与氯气在装置B中会有副反应发生,该反应的离子方程式为
③E中反应的化学方程式:。
(2)、甲同学认为SOCl2和FeCl3∙6H2O混合加热可制得无水FeCl3 , 但乙同学认为该实验可能发生副反应使产品不纯。乙同学设计如下实验判断副反应的可能性:取少量FeCl3∙6H2O于试管中,加入足量SOCl2 , 充分反应后向试管中加水溶解,用四支试管各取溶解后的溶液少许,分别进行下列实验,通过现象能验证发生副反应的是(填选项字母)。a.滴加BaCl2溶液 b.滴加K3[Fe(CN)6]溶液
c.滴加酸性KMnO4溶液 d.滴加溴水
(3)、分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液,检验该溶液中存在Cl-的需要用到的试剂是31. 某校科学兴趣小组探究二氧化碳与过氧化钠反应是否有氧气生成,设计了如图的实验装置,E为收集气体装置。 (1)、B中盛有溶液。(2)、C中盛放的溶液的目的是。(3)、装置E中有一处不正确,请指出。(4)、若反应中总共转移电子e-为0.01mol,请计算产生标准状况下O2多少毫升?至少需要1mol/L盐酸多少毫升? 写出计算过程 。32. 实验室制取、净化并收集氯气涉及以下几个主要阶段:(1)、实验室制取氯气的离子方程式为 , 表示阿伏加德罗常数的值,若有 的 被氧化,则转移的电子总数为;将足量的 投入含 的浓盐酸中,充分加热,可生成的 (填“>”“=”或“<”) 。(2)、现有3种试剂可供选择:A.饱和食盐水 B.浓硫酸 C. 溶液,则Y溶液应选用(填字母),X溶液的作用是。(3)、 溶液用于尾气吸收,常温下发生反应的离子方程式为。33. 氯仿(CHCl3)是无色透明液体,不溶于水和浓硫酸,溶于醇,沸点为61.2℃,工业品氯仿中常含有少量乙醇。某校同学设计实验制备少量氯仿。(1)、甲组同学设计下列装置用干燥纯净的氯气制备实验原料漂白粉[已知:3Ca(ClO)2 Ca(ClO3)2+2CaCl2△H>0]。
(1)、B中盛有溶液。(2)、C中盛放的溶液的目的是。(3)、装置E中有一处不正确,请指出。(4)、若反应中总共转移电子e-为0.01mol,请计算产生标准状况下O2多少毫升?至少需要1mol/L盐酸多少毫升? 写出计算过程 。32. 实验室制取、净化并收集氯气涉及以下几个主要阶段:(1)、实验室制取氯气的离子方程式为 , 表示阿伏加德罗常数的值,若有 的 被氧化,则转移的电子总数为;将足量的 投入含 的浓盐酸中,充分加热,可生成的 (填“>”“=”或“<”) 。(2)、现有3种试剂可供选择:A.饱和食盐水 B.浓硫酸 C. 溶液,则Y溶液应选用(填字母),X溶液的作用是。(3)、 溶液用于尾气吸收,常温下发生反应的离子方程式为。33. 氯仿(CHCl3)是无色透明液体,不溶于水和浓硫酸,溶于醇,沸点为61.2℃,工业品氯仿中常含有少量乙醇。某校同学设计实验制备少量氯仿。(1)、甲组同学设计下列装置用干燥纯净的氯气制备实验原料漂白粉[已知:3Ca(ClO)2 Ca(ClO3)2+2CaCl2△H>0]。
①各仪器接口连接顺序为(气流自左至右,用小写字母表示)。
②装置B中发生反应的离子方程式为 。
③装置A用冰水冷却的目的是。
(2)、乙组同学用甲组制得的漂白粉与乙醇溶液反应制备氯仿的实验装置如图。
①装置I需控制温度约为70℃,适宜的加热方式是 , 温度不宜过高,其目的是。
②装置Ⅱ的名称是。
③一定条件下,装置I中漂白粉先与乙醇溶液反应生成Cl2和Ca(OH)2 , 然后Cl2与CH3CH2OH反应生成CCl3CHO,CCl3CHO再与Ca(OH)2反应生成CHCl3和一种盐,CCl3CHO与Ca(OH)2反应的化学方程式为 。
(3)、丙组同学用下列方法对乙组制得的粗产品进行提纯。已知浓硫酸能与乙醇混溶。步骤I.向粗产品中加入适量浓硫酸,搅拌至呈淡咖啡色,分液得有机层;
步骤Ⅱ.用15%的Na2CO3溶液洗涤多次,分液得有机层;
步骤Ⅲ.向有机层中加入少量无水CaCl2。
步骤I中用浓硫酸洗涤的目的是;步骤Ⅱ中证明已洗涤干净的依据是;步骤Ⅲ中加入少量无水CaCl2的目的是 。
34. 按要求回答下列问题:(1)、现有下列几组物质:①D2O与H2O②16O与18O③ 与
与  ④CH4与CH3CH2CH3⑤CH3CH3与
④CH4与CH3CH2CH3⑤CH3CH3与  。
。 其中互为同位素的是(填序号,下同),互为同系物的是。
(2)、科学家设想将温室气体CO2转化为有机物来有效实现碳循环:a.2CO2+6H2 CH3CH2OH+3H2O
b.CO2+CH4 CH3COOH
以上反应中原子利用率较高的是(填字母。)
(3)、将乙烯通入溴的四氯化碳溶液中,可以观察到的现象是 , 发生反应的化学方程式为。(4)、海洋是非常巨大的资源宝库,从海水中可以提取溴,但得到的液溴中常常溶有少量氯气,除去氯气应采用的方法是___(填字母)。A、加适量的KI溶液 B、通入溴蒸气 C、加入适量的NaOH溶液 D、加入适量的NaBr溶液35. 某工厂综合处理含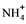 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),流程如图所示:
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),流程如图所示: (1)、固体1的主要成分除Ca(OH)2外,还有、(填化学式)。(2)、为使反应①中的有关气体被充分吸收,可采取的措施有:①增大接触面积;②。(3)、已知:
(1)、固体1的主要成分除Ca(OH)2外,还有、(填化学式)。(2)、为使反应①中的有关气体被充分吸收,可采取的措施有:①增大接触面积;②。(3)、已知:2NO2+2NaOH=NaNO3+NaNO2+H2O
NO2+NO+2NaOH=2NaNO2+H2O
为确保反应③只生成NaNO2 , 理论上应控制NO与O2的物质的量之比为;此时反应④的离子方程式为。若n(NO) :n(O2)=3:1,且NaOH溶液足量,则所得溶液1中NaNO3与NaNO2的物质的量之比为。
-