高考二轮复习知识点:分液和萃取1
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 下列装置可以用于相应实验的是
A
B
C
D
制备
分离乙醇和乙酸
验证酸性
测量体积
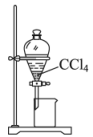
A、A B、B C、C D、D2. 下列实验中,不能达到实验目的的是( )由海水制取蒸馏水
萃取碘水中的碘
分离粗盐中的不溶物
由制取无水固体



A
B
C
D
A、A B、B C、C D、D3. 化学是以实验为基础的科学。下列实验操作或做法正确且能达到目的的是( )选项
操作或做法
目的
A
将铜丝插入浓硝酸中
制备
B
将密闭烧瓶中的 降温
探究温度对平衡移动的影响
C
将溴水滴入 溶液中,加入乙醇并振荡
萃取溶液中生成的碘
D
实验结束,将剩余 固体放回原试剂瓶
节约试剂
A、A B、B C、C D、D4. 已二酸是一种重要的化工原料,科学家在现有工业路线基础上,提出了一条“绿色”合成路线: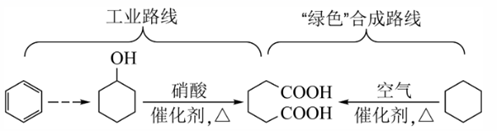
下列说法正确的是( )
A、苯与溴水混合,充分振荡后静置,下层溶液呈橙红色 B、环己醇与乙醇互为同系物 C、已二酸与 溶液反应有 生成 D、环己烷分子中所有碳原子共平面5. 下列操作规范且能达到实验目的的是( )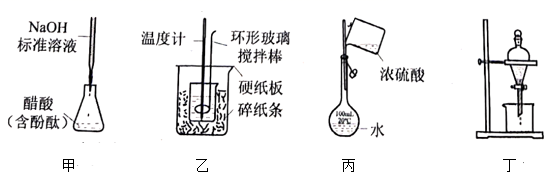 A、图甲测定醋酸浓度 B、图乙测定中和热 C、图丙稀释浓硫酸 D、图丁萃取分离碘水中的碘6. 下列实验装置(部分夹持装置略去)正确且能达到相应实验目的的是
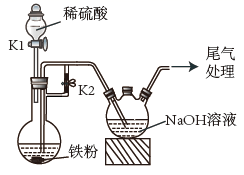
A、图甲测定醋酸浓度 B、图乙测定中和热 C、图丙稀释浓硫酸 D、图丁萃取分离碘水中的碘6. 下列实验装置(部分夹持装置略去)正确且能达到相应实验目的的是 A、装置Ⅰ利用乙醇提取溴水中的Br2 B、利用装置Ⅱ蒸干AlCl3溶液制无水AlCl3固体 C、利用装置Ⅲ制备Fe(OH)3胶体 D、利用装置Ⅳ验证非金属性S>C>Si7. 兔年春晚《满庭芳·国色》以中国传统色为切入点,使得桃红、凝脂、群青等有着优美名字的“中国色”扑而而来。其中“桃红”可从红花、铅丹、朱砂或赫石等原料中提取。下列说法错误的是A、提取红花中的有效成分红花素时,可使用萃取操作 B、铅丹中价与价的个数比为 C、以朱砂(主要成分为)为原料提取的“桃红”不宜用于制作化妆品 D、赭石(主要成分为)可用于制作磁性物质8. 实验室以含镍废料(主要成分为NiO,含少量FeO、Fe2O3、CoO、BaO和SiO2)为原料,制备NixOy和CoCO3的工艺流程如图所示。
A、装置Ⅰ利用乙醇提取溴水中的Br2 B、利用装置Ⅱ蒸干AlCl3溶液制无水AlCl3固体 C、利用装置Ⅲ制备Fe(OH)3胶体 D、利用装置Ⅳ验证非金属性S>C>Si7. 兔年春晚《满庭芳·国色》以中国传统色为切入点,使得桃红、凝脂、群青等有着优美名字的“中国色”扑而而来。其中“桃红”可从红花、铅丹、朱砂或赫石等原料中提取。下列说法错误的是A、提取红花中的有效成分红花素时,可使用萃取操作 B、铅丹中价与价的个数比为 C、以朱砂(主要成分为)为原料提取的“桃红”不宜用于制作化妆品 D、赭石(主要成分为)可用于制作磁性物质8. 实验室以含镍废料(主要成分为NiO,含少量FeO、Fe2O3、CoO、BaO和SiO2)为原料,制备NixOy和CoCO3的工艺流程如图所示。
已知:25℃时,Ksp[Co(OH)2]=2.0×10-15.下列说法正确的是( )
A、滤渣I中含H2SiO3和BaSO4 B、“氧化”、“调pH”时均需加过量的试剂 C、“萃取”时,待下层液体从分液漏斗下口流出后,上层液体再从下口放出 D、“沉钴”开始时,若溶液中的c(Co2+)=0.02mol·L-1 , 为防止生成Co(OH)2 , 应控制溶液pH<7.59. 实验室从海带中提取碘的过程如下:
下列说法正确的是( )
 A、步骤①⑤分别用装置丙、甲完成 B、装置乙使用时先放出下层水溶液,再从上口倒出有机层 C、海带中含有的硫酸盐在步骤③中实现与碘的分离 D、过程⑦酸化时发生反应的离子方程式:5I-+ +6H+=3I2+3H2O10. 易溶于水,难溶于乙醇。从电镀污泥[含有、、、和等]中回收制备和其它金属的工艺流程如下,下列说法正确的是 ( )
A、步骤①⑤分别用装置丙、甲完成 B、装置乙使用时先放出下层水溶液,再从上口倒出有机层 C、海带中含有的硫酸盐在步骤③中实现与碘的分离 D、过程⑦酸化时发生反应的离子方程式:5I-+ +6H+=3I2+3H2O10. 易溶于水,难溶于乙醇。从电镀污泥[含有、、、和等]中回收制备和其它金属的工艺流程如下,下列说法正确的是 ( )
已知:萃取剂萃取的原理为。
A、“酸浸”时,为加快浸出速率,提高生产效益,可以使用浓硫酸 B、萃取余液可在酸浸中循环利用,反萃取剂X为 C、“反萃取”得到的溶液,在碱性条件下可被氧化生成 , 该反应的离子方程式为 D、溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作可得 , 向冷却结晶后的固液混合物中加入乙醇可提高产率11. 将浓硫酸、NaBr固体、1-丁醇混合加热回流后,再经洗涤→干燥→蒸馏获得1-溴丁烷,实验中涉及如图装置(部分夹持和加热装置省略)。下列说法错误的是( ) A、两处冷凝管冷凝时都利用了气液流向相反,增强冷凝效果的原理 B、气体吸收装置的作用是吸收HBr等有毒气体 C、经水洗→碱洗→水洗可除去大部分杂质 D、1-溴丁烷从分液漏斗的下口放出12. 下列装置能达到相应实验目的的是( )
A、两处冷凝管冷凝时都利用了气液流向相反,增强冷凝效果的原理 B、气体吸收装置的作用是吸收HBr等有毒气体 C、经水洗→碱洗→水洗可除去大部分杂质 D、1-溴丁烷从分液漏斗的下口放出12. 下列装置能达到相应实验目的的是( )去除CO2中少量HCl
制取氯气
分离酒精和水
收集NO2




A
B
C
D
A、A B、B C、C D、D13. 下列实验操作可达到预期目的的是( )选项
目的
操作
A
利用密度差异分离混合物
对乙酸乙酯和乙醇混合液用分液漏斗进行分液
B
配制0.10mol/LNa2CO3溶液
称取5.3gNa2CO3•10H2O固体于烧杯中,加入少量蒸馏水溶解,冷却后,转移至500mL容量瓶中定容
C
测定硫酸铜晶体中结晶水含量
加热后的坩埚直接放置在石棉网上冷却,称重
D
配制FeSO4溶液
先将FeSO4固体溶在稀硫酸中,然后稀释,并加入少量铁粉
A、A B、B C、C D、D14. 下列图示表示分液操作的是( )A、 B、
B、 C、
C、 D、
D、 15. 化学与生产、生活息息相关。下列叙述不正确的是( )A、橱窗所用有机玻璃为高分子化合物 B、家庭装修用水性涂料代替油性涂料有利于健康 C、应用光伏发电可缓解温室效应及减少酸雨发生 D、用己烷萃取玉米胚芽中的油脂时发生了化学反应16. 可萃取溴水中Br2的试剂是( )A、石蜡 B、甘油 C、氯仿 D、新戊烷17. 下列有关实验设计不合理的是( )
15. 化学与生产、生活息息相关。下列叙述不正确的是( )A、橱窗所用有机玻璃为高分子化合物 B、家庭装修用水性涂料代替油性涂料有利于健康 C、应用光伏发电可缓解温室效应及减少酸雨发生 D、用己烷萃取玉米胚芽中的油脂时发生了化学反应16. 可萃取溴水中Br2的试剂是( )A、石蜡 B、甘油 C、氯仿 D、新戊烷17. 下列有关实验设计不合理的是( ) A、图1装置可制取NO气体 B、图2装置可以完成“喷泉”实验 C、图3证明非金属性强弱:S>C>Si D、图4用四氯化碳萃取碘水中的碘18. 图示的实验或操作正确的是( )
A、图1装置可制取NO气体 B、图2装置可以完成“喷泉”实验 C、图3证明非金属性强弱:S>C>Si D、图4用四氯化碳萃取碘水中的碘18. 图示的实验或操作正确的是( )A
B
C
D
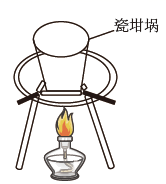
熔化NaOH
制取少量
萃取振荡时放气
分离甲苯和水
A、A B、B C、C D、D19. 下列实验操作描述符合题意且能达到实验目的的是( )A
B
C
D




苯萃取碘水后的分离操作
配制 1 mol/L的NaCl溶液时的定容操作
探究接触面积对反应速率的影响
验证Ksp(AgSO4)>Ksp(Ag2S)
A、A B、B C、C D、D20. 下列实验操作描述正确且能达到实验目的的是( )A
B
C
D




苯萃取碘水后的分离操作
配制 1 mol/L的NaCl溶液时的定容操作
探究接触面积对反应速率的影响
验证Ksp(AgSO4)>Ksp(Ag2S)
A、A B、B C、C D、D21. 下列有关实验的操作正确的是( )实验
操作
A
稀释浓硫酸
先将浓硫酸加入烧杯中,后倒入蒸馏水
B
除去NaHCO3固体中的少量Na2CO3杂质
将固体加热至恒重
C
浓盐酸与MnO2反应制备纯净Cl2
将气体产物先通过盛有浓硫酸的洗气瓶,后通过盛有饱和食盐水的洗气瓶。
D
CCl4萃取碘水中的I2
先从分液漏斗下口放出有机层,后从上口倒出水层
A、A B、B C、C D、D22. 下列对实验现象的解释与结论正确的是( )选项
实验操作
实验现象
解释与结论
A
向浓度均为0.1 mol·L-1Na2S和NaI混合溶液中滴加少量AgNO3溶液
出现黑色沉淀
Ksp( (AgI)<Ksp(Ag2S)
B
向某溶液中加入盐酸酸化的BaCl2溶液
有白色沉淀产生
该溶液中一定含有SO
C
向苯中滴入少量浓溴水,振荡,静置
溶液分层;上层呈橙红色,下层几乎无色
苯和溴水发生取代反应,使溴水褪色
D
向蔗糖中加入浓硫酸
蔗糖变黑,放热,体积膨胀,放出刺激性气味气体
浓硫酸具有脱水性和强氧化性,反应中生成C、SO2和CO2等
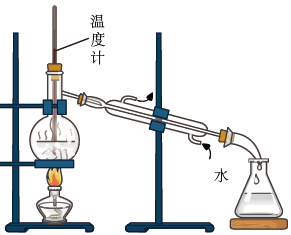
A、A B、B C、C D、D23. 已知实验室按反应C2H5OH CH2=CH2↑+H2O制备的乙烯中常含有副产物CO2、SO2等。某实验小组利用如下装置制备少量1,2-二溴乙烷:
下列说法正确的是( )
A、浓硫酸主要作氧化剂 B、温度计用来指示溶液温度 C、装置连接顺序为adebcf D、可采用分液操作分离产品24. 实验室从废定影液[含Ag(S2O3) 和Br-等]中回收Ag和Br2的步骤是:向废定影液中加入Na2S沉银,过滤、洗涤、干燥,灼烧Ag2S制Ag;制取Cl2并将其通入滤液中氧化Br- , 用四氯化碳萃取分液。其中部分操作的装置如图所示。
下列叙述正确的是( )
A、用装置甲分离出Ag2S B、用装置乙灼烧Ag2S制取Ag C、用装置丙制备Cl2 D、用装置丁分液时,有机相应从下口放出25. 在海带提碘的实验中可做萃取剂的是( )A、四氯化碳 B、水 C、乙醇 D、乙酸26. 下列实验能达到实验目的的是( )选项
A
B
C
D
实验




实验目的
证明非金属性
分离溴苯
测定中和热
证明
A、A B、B C、C D、D27. 为减少环境污染,降低化石燃料消耗,我国正积极推广乙醇汽油。乙醇可由淀粉或纤维素经水解、发酵制得。下列说法错误的是( )A、纤维素的水解反应为取代反应 B、可用乙醇做萃取剂,萃取碘水中的碘单质 C、可用碘液来检验淀粉是否水解完全 D、乙醇可由乙烯与水发生加成反应制取28. 中国不少古诗词清晰描述了当时人们的生活和社会的发展,如刘禹锡的《浪淘沙》“日照澄洲江雾开,淘金女伴满江隈,美人首饰侯王印,尽是沙中浪底来。”下列有关本诗中蕴含的化学知识认知正确的是( )A、雾的分散质粒子直径范围是1~100nm B、淘金原理与化学上的萃取一致 C、沙子的主要成分是 D、“沙中浪底来”指的是金的氧化物29. 中华传统文化源远流长下列对古代著作涉及化学的解读错误的是( )A、“以火烧之,紫青烟起,乃真硝石也”利用的是钾元素的焰色反应 B、“落红不是无情物,化作春泥更护花”蕴藏着自然界碳、氮的循环 C、“煮豆燃豆其,豆在釜中泣”涉及的能量变化主要是化学能转化为热能 D、“日照澄洲江雾开,淘金女伴满江限。美人首饰侯王印,尽是沙中浪底来”诗中淘金原理与化学上的萃取一致30. 下列四种实验装置,适合用于分离水和植物油的是( )A、 B、
B、 C、
C、 D、
D、 31. 下列实验装置或操作与实验目的不相符的是( )A、
31. 下列实验装置或操作与实验目的不相符的是( )A、 证明Cl2氧化性强于Br2
B、
证明Cl2氧化性强于Br2
B、 分离乙醇和水
C、
分离乙醇和水
C、 除去水中泥沙
D、
除去水中泥沙
D、 配制100mL0.100mol/LNaCl溶液
配制100mL0.100mol/LNaCl溶液
二、非选择题
-
32.(1)、I.某同学将铁铝合金样品溶解后取样25.00mL,分离并测定Fe3+的浓度,实验方案设计如下:

已知:乙醚[(C2H5)2O]是一种易挥发、易燃、有麻醉性的有机化合物,沸点为34.5℃,微溶于水。在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚;当盐酸浓度降低时,该化合物解离。
完成下列填空:
操作A的名称是。经操作A后,请设计实验方案判断Fe3+是否有残留。
(2)、滴定前,加入适量溶液B进行酸化,则B可能是。a.H2SO3-H3PO4 b.H2SO4-H3PO4
c.HNO3-H3PO4 d.HI-H3PO4
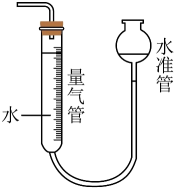
(3)、滴定达到终点时,消耗0.1000 mol·L-1 K2Cr2O7溶液6.00 mL(生成物中Cr元素为+3价)。根据该实验数据,试样X中c(Fe3+)为。(4)、上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可采取的措施是____。A、稀释被测试样 B、减少被测试样取量 C、增加平行测定次数 D、降低滴定剂浓度(5)、II.利用下图装置和试剂可以测定铁铝合金样品中的铝含量。
请回答:
下列有关该实验的说法中正确的是____。
A、由于恒压分液漏斗的存在,该装置不能进行气密性检查 B、读数前需将量气管C上下移动使B、C中的液面相平 C、反应完成后生成的氢气都要转移至装置B中 D、需要控制NaOH的量以防止产生气体过多超过量气装置的量程(6)、若将恒压分液漏斗(A)去掉导管a,改成普通分液漏斗,则测得铁铝合金中的铝含量 , (填“偏大”、“偏小”或“不变”),请说明理由。33. 硒(Se)是一种新型半导体材料;银是一种物理化学性质优良的贵重金属,需求逐年上升。实验室模拟工业对富硒废料(含、)进行综合处理的一种工艺流程如下: (1)、焙烧时应把废料于中(填仪器名称),为提高焙烧效率可采取的措施(写一条即可)。(2)、应选用(填“浓”或“稀”)溶液,原因是。(3)、操作2的名称是。(4)、还原过程中产生了对环境友好的气体,写出该反应的离子方程式:。(5)、如图装置可以制备一水合肼 , 其阳极的电极反应式为。
(1)、焙烧时应把废料于中(填仪器名称),为提高焙烧效率可采取的措施(写一条即可)。(2)、应选用(填“浓”或“稀”)溶液,原因是。(3)、操作2的名称是。(4)、还原过程中产生了对环境友好的气体,写出该反应的离子方程式:。(5)、如图装置可以制备一水合肼 , 其阳极的电极反应式为。 (6)、有机溶剂为煤油与硫醚的混合物。对操作1中有机溶剂组成、浸出液酸度对萃取率的影响做如下探究,结果如图1、图2所示,则得出的结论为。(浸出液)
(6)、有机溶剂为煤油与硫醚的混合物。对操作1中有机溶剂组成、浸出液酸度对萃取率的影响做如下探究,结果如图1、图2所示,则得出的结论为。(浸出液) 34. 某科研小组采用如下方案拆解废钴酸锂电池并从拆解的正极片中回收锂和钴,主要的实验流程如下:
34. 某科研小组采用如下方案拆解废钴酸锂电池并从拆解的正极片中回收锂和钴,主要的实验流程如下:
已知:①正极片中主要含LiCoO2(难溶于水)以及少量乙炔炭黑及铝箔等;负极为石墨,充电时Li+嵌入石墨电极。
②P2O4为磷酸二异辛酯,密度为0.973g.cm-3。
③3HBrO+CO(NH2)2=3HBr+N2↑+2H2O+CO2↑。
(1)、“放电处理”时,有关说法正确的是__________(填标号)。A、有利于锂的回收,提高锂的回收率 B、处理的主要目的是回收残余的电能 C、处理过程中产生的气体只有O2 D、可防止在电池拆解过程中,发生短路引起火灾、爆炸事故等安全问题(2)、“还原浸取”时,发生反应的离子方程式为(S2O32-被氧化为SO42-)。(3)、“除铁、铝”时,应调整溶液的pH范围为(下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。 (4)、“萃取”与“反萃取”时,静置后(如图所示),获得有机相的操作方法是;“反萃取”试剂X适宜是(填“H2SO4”或“NaOH”)溶液。
(4)、“萃取”与“反萃取”时,静置后(如图所示),获得有机相的操作方法是;“反萃取”试剂X适宜是(填“H2SO4”或“NaOH”)溶液。 (5)、设计以流程中产品Li2CO3为原料,制取LiBr·H2O的实验方案:向烧杯中加入适量冷水, , 干燥得LiBr·H2O[实验中必须使用的试剂:饱和溴水、尿素及活性炭]。35. 2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理电池废料以节约资源、保护环境。钴酸锂电池正极材料主要含有LiCoO2、导电剂乙炔黑、铝箔及镀镍金属钢壳等,处理该废旧电池的一种工艺如下图所示:
(5)、设计以流程中产品Li2CO3为原料,制取LiBr·H2O的实验方案:向烧杯中加入适量冷水, , 干燥得LiBr·H2O[实验中必须使用的试剂:饱和溴水、尿素及活性炭]。35. 2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理电池废料以节约资源、保护环境。钴酸锂电池正极材料主要含有LiCoO2、导电剂乙炔黑、铝箔及镀镍金属钢壳等,处理该废旧电池的一种工艺如下图所示:
回答下列问题:
(1)、Li原子结构示意图为 , LiCoO2中Co的化合价是。(2)、用NaOH溶液处理正极材料的离子方程式为。(3)、“酸浸”过程中LiCoO2发生反应的离子方程式为。保持其他因素不变的情况下,“酸浸”时Co、Li元素的浸出率随温度的变化如右图所示,当温度高于80℃时Co元素浸出率下降的原因有:
①Co2+水解加剧;②。
(4)、调节pH的目的是使Ni2+和(填离子符号)全部沉淀。(5)、“萃取”环节,钴、锂萃取率与平衡时溶液pH的关系如下图所示,为了实现钴、锂分离效果较好,pH一般选择(填整数)左右。 (6)、“萃取”和“反萃取”可简单表示为 ,则反萃取过程中加入的试剂X是(填名称)。(7)、取CoC2O4固体4.41g在空气中加热至300℃,得到钴的氧化物2.41g和一种无毒无污染的气体,则该反应的化学方程式为。
(6)、“萃取”和“反萃取”可简单表示为 ,则反萃取过程中加入的试剂X是(填名称)。(7)、取CoC2O4固体4.41g在空气中加热至300℃,得到钴的氧化物2.41g和一种无毒无污染的气体,则该反应的化学方程式为。