高考二轮复习知识点:蒸馏与分馏
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 下列实验中,不能达到实验目的的是( )
由海水制取蒸馏水
萃取碘水中的碘
分离粗盐中的不溶物
由制取无水固体

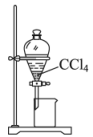


A
B
C
D
A、A B、B C、C D、D2. 蒸馏操作中需要用到的仪器是( )A、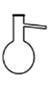 B、
B、 C、
C、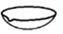 D、
D、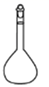 3. 下列实验操作不当的是A、用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率 B、用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂 C、用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+ D、常压蒸馏时,加入液体的体积不超过圆底烧瓶容积的三分之二4. 下列最适合分离己烷和辛烷的混合物的技术是( )A、过滤 B、纸层析法 C、萃取 D、蒸馏5. 下列实验操作或装置正确的是
3. 下列实验操作不当的是A、用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率 B、用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂 C、用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+ D、常压蒸馏时,加入液体的体积不超过圆底烧瓶容积的三分之二4. 下列最适合分离己烷和辛烷的混合物的技术是( )A、过滤 B、纸层析法 C、萃取 D、蒸馏5. 下列实验操作或装置正确的是 A、用甲装置分离苯和溴苯的混合液 B、用乙装置进行氢氧化钠滴定盐酸的实验,测定盐酸的浓度 C、用丙装置制备无水氯化镁 D、用丁装置进行中和热的测定6. 岭南文化源远流长。下列说法错误的是A、客家围屋建造过程中用作黏稠剂的糯米和鸡蛋清都属于混合物 B、云浮云石在粗雕、细刻过程中发生了物理变化 C、制作粤绣所用的孔雀毛和马尾的主要成分都是纤维素 D、“南粤佳酿”长乐烧在生产过程中需要用到蒸馏操作7. 下列叙述错误的是A、探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高 B、取浓度均为的草酸钠和溶液,草酸钠溶液较大,表明草酸是弱酸 C、蒸馏完毕后,应先停止加热,待装置冷却后,停止通冷却水,再拆卸蒸馏装置 D、向酸性溶液中加入粉末,紫色褪去,证明中含(II)8. 下列装置或操作能达到实验目的是( )
A、用甲装置分离苯和溴苯的混合液 B、用乙装置进行氢氧化钠滴定盐酸的实验,测定盐酸的浓度 C、用丙装置制备无水氯化镁 D、用丁装置进行中和热的测定6. 岭南文化源远流长。下列说法错误的是A、客家围屋建造过程中用作黏稠剂的糯米和鸡蛋清都属于混合物 B、云浮云石在粗雕、细刻过程中发生了物理变化 C、制作粤绣所用的孔雀毛和马尾的主要成分都是纤维素 D、“南粤佳酿”长乐烧在生产过程中需要用到蒸馏操作7. 下列叙述错误的是A、探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高 B、取浓度均为的草酸钠和溶液,草酸钠溶液较大,表明草酸是弱酸 C、蒸馏完毕后,应先停止加热,待装置冷却后,停止通冷却水,再拆卸蒸馏装置 D、向酸性溶液中加入粉末,紫色褪去,证明中含(II)8. 下列装置或操作能达到实验目的是( )



A.除去乙醇中的乙酸
B.形成原电池
C.制取乙酸乙酯
D.石油的蒸馏
A、A B、B C、C D、D9. 用下列装置完成相关实验,不合理的是( ) A、用a配制100mL1.00mol·L-1NaCl溶液 B、用b制备少量乙酸乙酯 C、用c蒸馏海水得到淡水 D、用d分离Na2CO3溶液与CH3COOC2H510. 现有三组混合溶液:①乙酸乙酯和乙酸钠溶液;②丁醇和乙醇;③溴化钠和单质溴的水溶液。分离以上各混合液的正确方法依次是( )A、分液、萃取、蒸馏 B、萃取、蒸馏、分液 C、分液、蒸馏、萃取 D、蒸馏、萃取、分液11. 硝基苯在有机合成工业中有广泛应用,实验室利用苯和浓硝酸合成硝基苯并分离提纯的过程如下:反应→静置→分液→纯碱洗→水洗→干燥→蒸馏。下列说法错误的是( )A、反应时采用水浴加热 B、分液使用到的玻璃仪器有分液漏斗和烧杯 C、纯碱洗的主要目的是除去未反应的酸 D、蒸馏时硝基苯先从混合物中气化分离12. 绿原酸(C16H18O9)是一种有机弱酸,金银花的水浸取液经下列操作可获得绿原酸粗品。
A、用a配制100mL1.00mol·L-1NaCl溶液 B、用b制备少量乙酸乙酯 C、用c蒸馏海水得到淡水 D、用d分离Na2CO3溶液与CH3COOC2H510. 现有三组混合溶液:①乙酸乙酯和乙酸钠溶液;②丁醇和乙醇;③溴化钠和单质溴的水溶液。分离以上各混合液的正确方法依次是( )A、分液、萃取、蒸馏 B、萃取、蒸馏、分液 C、分液、蒸馏、萃取 D、蒸馏、萃取、分液11. 硝基苯在有机合成工业中有广泛应用,实验室利用苯和浓硝酸合成硝基苯并分离提纯的过程如下:反应→静置→分液→纯碱洗→水洗→干燥→蒸馏。下列说法错误的是( )A、反应时采用水浴加热 B、分液使用到的玻璃仪器有分液漏斗和烧杯 C、纯碱洗的主要目的是除去未反应的酸 D、蒸馏时硝基苯先从混合物中气化分离12. 绿原酸(C16H18O9)是一种有机弱酸,金银花的水浸取液经下列操作可获得绿原酸粗品。 下列说法错误的是( )A、加盐酸是为了提高绿原酸的萃取率 B、分液时应先打开分液漏斗顶塞,再打开旋塞,使水层从分液漏斗下口放出 C、减压蒸馏的目的是降低蒸馏温度,有利于绿原酸挥发 D、该流程中可循环利用的物质是乙酸乙酯13. 下列图示的实验或操作正确的是( )
下列说法错误的是( )A、加盐酸是为了提高绿原酸的萃取率 B、分液时应先打开分液漏斗顶塞,再打开旋塞,使水层从分液漏斗下口放出 C、减压蒸馏的目的是降低蒸馏温度,有利于绿原酸挥发 D、该流程中可循环利用的物质是乙酸乙酯13. 下列图示的实验或操作正确的是( )A
B
C
D




分离甲苯和水
浓硫酸的稀释
除去CO中的CO2
萃取振荡时放气
A、A B、B C、C D、D14. 除去下列各组物质中的少量杂质,所选用的试剂及操作方法均合理的是(括号内的物质为杂质,所选试剂均足量)( )选项
物质
试剂
操作方法
A
胶体
蒸馏水
过滤
B
溶液
萃取、分液
C
乙烷(乙烯)
酸性 溶液、浓硫酸
洗气、干燥
D
固体
—
蒸馏
A、A B、B C、C D、D15. 实验是化学研究的基础,下列关于各实验装置图(部分夹持装置省略)的叙述错误的是( ) A、利用装置①可除去粗溴苯(溴苯沸点为156.2℃)中混有的苯(沸点为80.1℃) B、利用装置②及相关实验现象可推知酸性: C、利用装置③,由b口进气可收集 、 D、利用装置④可制备二氧化硫气体16. 利用如图装置(夹持装置略)进行实验,不能达到实验目的的是( )A、
A、利用装置①可除去粗溴苯(溴苯沸点为156.2℃)中混有的苯(沸点为80.1℃) B、利用装置②及相关实验现象可推知酸性: C、利用装置③,由b口进气可收集 、 D、利用装置④可制备二氧化硫气体16. 利用如图装置(夹持装置略)进行实验,不能达到实验目的的是( )A、 实验室制氨气
B、
实验室制氨气
B、 海水蒸馏制淡水
C、
海水蒸馏制淡水
C、
D、 用乙醇萃取碘水中的I2
用乙醇萃取碘水中的I2 用硫酸铜溶液净化乙炔气体
17. 化学与生产、生活密切相关,下列说法错误的是( )A、医疗废弃物经处理可加工成儿童玩具,实现资源综合利用 B、海水淡化的方法有蒸馏法、电渗析法、离子交换法等 C、《肘后备急方》中“青蒿一握,以水二升渍,绞取汁”描述了中药的溶解与过滤 D、商代制作的工艺精湛的司母戊鼎主要成分是铜、锡、铅18. 实验室分离Fe3+和Al3+的流程如图:
用硫酸铜溶液净化乙炔气体
17. 化学与生产、生活密切相关,下列说法错误的是( )A、医疗废弃物经处理可加工成儿童玩具,实现资源综合利用 B、海水淡化的方法有蒸馏法、电渗析法、离子交换法等 C、《肘后备急方》中“青蒿一握,以水二升渍,绞取汁”描述了中药的溶解与过滤 D、商代制作的工艺精湛的司母戊鼎主要成分是铜、锡、铅18. 实验室分离Fe3+和Al3+的流程如图:
已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]- , 该配离子在乙醚(El2O, 沸点34.6℃)中生成缔合物Et2O·H+·[FeCl4]-。下列说法错误的是( )
A、酸化后,铁元素在溶液中主要以[FeCl4]形式存在 B、萃取分液时,有机层从分液漏斗上口倒出 C、反萃取后,铁元素在溶液中主要以Fe3+形式存在 D、蒸馏时,用酒精灯直接加热蒸馏烧瓶以加快蒸馏速度19. 某些地区的自来水含有 Fe3+ , 实验室可以通过蒸馏自来水的方法获得少量纯净的水,需要用到的仪器是( )A、 B、
B、 C、
C、 D、
D、 20. 下列选用的仪器和药品能达到实验目的的是( )A、
20. 下列选用的仪器和药品能达到实验目的的是( )A、 检验浓硫酸与铜反应后的产物中是否含有 Cu2+
B、
检验浓硫酸与铜反应后的产物中是否含有 Cu2+
B、 蒸馏时的接收装置
C、
蒸馏时的接收装置
C、 制取 NaHCO3
D、
制取 NaHCO3
D、 准确量取一定体积K2Cr2O7 标准溶液
准确量取一定体积K2Cr2O7 标准溶液
二、非选择题
-
21. 2—噻吩乙醇()是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:

Ⅰ.制钠砂。向烧瓶中加入液体A和金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至 , 加入噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至 , 加入稍过量的环氧乙烷的四氢呋喃溶液,反应。
Ⅳ.水解。恢复室温,加入水,搅拌;加盐酸调至4~6,继续反应 , 分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水 , 静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品。
回答下列问题:
(1)、步骤Ⅰ中液体A可以选择。a.乙醇 b.水 c.甲苯 d.液氨
(2)、噻吩沸点低于吡咯( )的原因是。 (3)、步骤Ⅱ的化学方程式为。(4)、步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是。(5)、步骤Ⅳ中用盐酸调节的目的是。(6)、下列仪器在步骤Ⅴ中无需使用的是(填名称):无水的作用为。
)的原因是。 (3)、步骤Ⅱ的化学方程式为。(4)、步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是。(5)、步骤Ⅳ中用盐酸调节的目的是。(6)、下列仪器在步骤Ⅴ中无需使用的是(填名称):无水的作用为。 (7)、产品的产率为(用计算,精确至0.1%)。22. 实验室由安息香制备二苯乙二酮的反应式如下:
(7)、产品的产率为(用计算,精确至0.1%)。22. 实验室由安息香制备二苯乙二酮的反应式如下: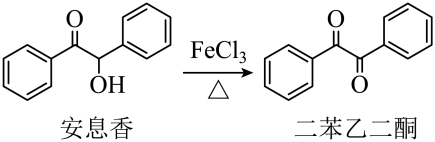
相关信息列表如下:
物质
性状
熔点/℃
沸点/℃
溶解性
安息香
白色固体
133
344
难溶于冷水
溶于热水、乙醇、乙酸
二苯乙二酮
淡黄色固体
95
347
不溶于水
溶于乙醇、苯、乙酸
冰乙酸
无色液体
17
118
与水、乙醇互溶
装置示意图如下图所示,实验步骤为:
①在圆底烧瓶中加入冰乙酸、水及 , 边搅拌边加热,至固体全部溶解。
②停止加热,待沸腾平息后加入安息香,加热回流。
③加入水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用的乙醇重结晶,干燥后得淡黄色结晶。
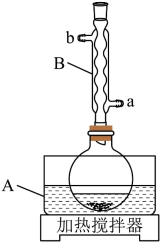
回答下列问题:
(1)、仪器A中应加入(填“水”或“油”)作为热传导介质。(2)、仪器B的名称是;冷却水应从(填“a”或“b”)口通入。(3)、实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是。(4)、在本实验中,为氧化剂且过量,其还原产物为;某同学尝试改进本实验:采用催化量的并通入空气制备二苯乙二酮。该方案是否可行?简述判断理由。(5)、本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是防止。(6)、若粗品中混有少量未氧化的安息香,可用少量洗涤的方法除去(填标号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯。a.热水 b.乙酸 c.冷水 d.乙醇
(7)、本实验的产率最接近于(填标号)。a. b. c. d.
23. 实验室利用和亚硫酰氯()制备无水的装置如图所示(加热及夹持装置略)。已知沸点为 , 遇水极易反应生成两种酸性气体。回答下列问题: (1)、实验开始先通。一段时间后,先加热装置(填“a”或“b”)。装置b内发生反应的化学方程式为。装置c、d共同起到的作用是。(2)、现有含少量杂质的 , 为测定n值进行如下实验:
(1)、实验开始先通。一段时间后,先加热装置(填“a”或“b”)。装置b内发生反应的化学方程式为。装置c、d共同起到的作用是。(2)、现有含少量杂质的 , 为测定n值进行如下实验:实验Ⅰ:称取样品,用足量稀硫酸溶解后,用标准溶液滴定达终点时消耗(滴定过程中转化为 , 不反应)。
实验Ⅱ:另取样品,利用上述装置与足量反应后,固体质量为。
则;下列情况会导致n测量值偏小的是(填标号)。
A.样品中含少量杂质
B.样品与反应时失水不充分
C.实验Ⅰ中,称重后样品发生了潮解
D.滴定达终点时发现滴定管尖嘴内有气泡生成
(3)、用上述装置、根据反应制备。已知与分子结构相似,与互溶,但极易水解。选择合适仪器并组装蒸馏装置对、混合物进行蒸榴提纯(加热及夹持装置略),安装顺序为①⑨⑧(填序号),先馏出的物质为。 24. 苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
24. 苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下: +KMnO4→
+KMnO4→ 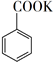 + MnO2
+ MnO2  +HCl→
+HCl→  +KCl
+KCl名称
相对分
子质量
熔点/℃
沸点/℃
密度/(g·mL−1)
溶解性
甲苯
92
−95
110.6
0.867
不溶于水,易溶于乙醇
苯甲酸
122
122.4(100℃左右开始升华)
248
——
微溶于冷水,易溶于乙醇、热水
实验步骤:①在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
②停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
③纯度测定:称取0. 122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25. 00 mL溶液,用0.01000 mol·L−1的KOH标准溶液滴定,三次滴定平均消耗21. 50 mL的KOH标准溶液。
回答下列问题:
(1)、根据上述实验药品的用量,三颈烧瓶的最适宜规格为______(填标号)。A、100 mL B、250 mL C、500 mL D、1000 mL(2)、在反应装置中应选用冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是。(3)、加入适量饱和亚硫酸氢钠溶液的目的是;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理。(4)、“用少量热水洗涤滤渣”一步中滤渣的主要成分是。(5)、干燥苯甲酸晶体时,若温度过高,可能出现的结果是。(6)、本实验制备的苯甲酸的纯度为;据此估算本实验中苯甲酸的产率最接近于(填标号)。A.70% B.60% C.50% D.40%
(7)、若要得到纯度更高的苯甲酸,可通过在水中的方法提纯。25. B.[实验化学]丙炔酸甲酯( CH≡C-COOCH3 )是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为

实验步骤如下:
步骤1:在反应瓶中,加入14 g丙炔酸、50 mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。
步骤2:蒸出过量的甲醇(装置见下图)。
步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。
 (1)、步骤1中,加入过量甲醇的目的是。(2)、步骤2中,上图所示的装置中仪器A的名称是;蒸馏烧瓶中加入碎瓷片的目的是。(3)、步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是;分离出有机相的操作名称为。(4)、步骤4中,蒸馏时不能用水浴加热的原因是。26. FeCl2是重要的媒染剂和污水处理剂。某校化学探究团队查阅有关资料,在实验室中用氯苯消氯法制备无水FeCl2 , 原理为:C6H5Cl+2FeCl3→2FeCl2+C6H4Cl2+HCl↑,装置如下图(夹持装置已略去)。
(1)、步骤1中,加入过量甲醇的目的是。(2)、步骤2中,上图所示的装置中仪器A的名称是;蒸馏烧瓶中加入碎瓷片的目的是。(3)、步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是;分离出有机相的操作名称为。(4)、步骤4中,蒸馏时不能用水浴加热的原因是。26. FeCl2是重要的媒染剂和污水处理剂。某校化学探究团队查阅有关资料,在实验室中用氯苯消氯法制备无水FeCl2 , 原理为:C6H5Cl+2FeCl3→2FeCl2+C6H4Cl2+HCl↑,装置如下图(夹持装置已略去)。
已知:
Ⅰ.FeCl2、FeCl3不溶于氯苯、二氯苯;
Ⅱ.C6H5Cl、C6H4Cl2二者互溶,不溶于水;沸点分别为132℃、173℃。
回答下列问题:。
(1)、仪器a的名称为 , 该仪器(填“能”或“不能”)用于石油的分馏。(2)、该团队用3.25g FeCl3与过量氯苯反应,实验结束后将三颈烧瓶中的物质倒出,过滤、洗涤、干燥后得到粗产品,回收滤液中氯苯的方法为(填操作名称)。(3)、经讨论后,分为甲、乙两组用不同方法测定FeCl3的转化率。①甲组:用0.40mol·L-1NaOH标准液滴定锥形瓶内的溶液,可选用的指示剂为;若终点时消耗18.50mL NaOH标准液,则FeCl3转化率为%。
②乙组:将粗产品制成250mL溶液,取出25.00mL,用0.0200mol·L-1标准KMnO4溶液滴定(已知:本实验条件下,Cl-不参与反应:KMnO4还原产物为Mn2+)。达到滴定终点时的现象为 , 经平行实验测得平均消耗标准液16.00mL,则甲组测定结果(填“高于”或“低于”)乙组测定结果。
③某检测机构对粗产品进行测定,经数据分析测得FeCl3的转化率为79.95%。与乙组和检测机构的测定结果对比,若无操作失误,甲组产生较大误差可能的原因为。
27. 苯乙酮( )广泛用于皂用香精和烟草香精中,可由苯和乙酸酐制备。
)广泛用于皂用香精和烟草香精中,可由苯和乙酸酐制备。 
已知:
名称
熔点/℃
沸点/℃
密度/(g·mL-1 )
溶解性
苯
5.5
80.1
0.88
不溶于水,易溶于有机溶剂
苯乙酮
19.6
203
1.03
微溶于水,易溶于有机溶剂
乙酸酐
-73
139
1.08
有吸湿性,易溶于有机溶剂
乙酸
16.6
118
1.05
易溶于水,易溶于有机溶剂
步骤I:向三颈烧瓶中加入39 g苯和44.5 g无水氯化铝,在搅拌下滴加25.5 g乙酸酐(C4H6O3),在70~80℃下加热45min,发生反应:
 +(CH3CO)2O
+(CH3CO)2O  +CH3COOH。
+CH3COOH。步骤II:冷却后将反应物倒入100g冰水中,有白色胶状沉淀生成,采用合适的方法处理,水层用苯萃取,合并苯层溶液,再依次用30 mL 5% NaOH溶液和30 mL水洗涤,分离出的苯层用无水硫酸镁干燥。
步骤III:常压蒸馏回收苯,再收集产品苯乙酮。
请回答下列问题:
(1)、AlCl3在反应中作 , 步骤I中的加热方式为。(2)、根据上述实验药品的用量,三颈烧瓶的最适宜规格为___________(填标号)。A、100 mL B、250 mL C、500 mL D、1000 mL(3)、图示实验装置虚线框内缺少一种仪器,该仪器名称为。(4)、步骤II中生成的白色胶状沉淀的化学式为 , 该物质易堵塞滤纸,处理白色胶状沉淀的方法为。(5)、步骤II中用NaOH溶液洗涤的目的是。(6)、步骤III中收集苯乙酮的温度应为。(7)、实验中收集到24.0 mL苯乙酮,则苯乙酮的产率为。28. 实验室用氧化锌作催化剂、以乙二醇和碳酸氢钠为复合解聚剂常压下快速、彻底解聚聚对苯二甲酸乙二醇酯,同时回收对苯二甲酸和乙二醇。反应原理如下:
实验步骤如下:
步骤1:在题图1所示装置的四颈烧瓶内依次加入洗净的矿泉水瓶碎片、氧化锌、碳酸氢钠和乙二醇,缓慢搅拌,油浴加热至180 ℃,反应0.5 h。

步骤2:降下油浴,冷却至160 ℃,将搅拌回流装置改为图2所示的搅拌蒸馏装置,水泵减压,油浴加热蒸馏。
步骤3:蒸馏完毕,向四颈烧瓶内加入沸水,搅拌。维持温度在60 ℃左右,抽滤。
步骤4:将滤液转移至烧杯中加热煮沸后,趁热边搅拌边加入盐酸酸化至pH为1~2。用砂芯漏斗抽滤,洗涤滤饼数次直至洗涤滤液pH=6,将滤饼摊开置于微波炉中微波干燥。
请回答下列问题:
(1)、步骤1中将矿泉水瓶剪成碎片的目的是。(2)、步骤2中减压蒸馏的目的是 , 蒸馏出的物质是。(3)、抽滤结束后停止抽滤正确的操作方法是。若滤液有色,可采取的措施是。(4)、该实验中,不采用水浴加热的原因是。29. 四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂。已知TiBr4常温下为橙黄色固体,熔点为38.3℃,沸点为233.5℃,具有潮解性且易发生水解。实验室利用反应TiO2+C+2Br2 TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题: (1)、检查装置气密性并加入药品后,加热前应进行的操作是 , 其目的是 , 此时活塞K1 , K2 , K3的状态为;一段时间后,打开电炉并加热反应管,此时活塞K1 , K2 , K3的状态为。(2)、试剂A为 , 装置单元X的作用是;反应过程中需用热源间歇性微热连接管,其目的是。(3)、反应结束后应继续通入一段时间CO2 , 主要目的是。(4)、将连接管切断并熔封,采用蒸馏法提纯。此时应将a端的仪器改装为、承接管和接收瓶,在防腐胶塞上加装的仪器是(填仪器名称)。30. 镍是制取各种高强度合金、耐热材料的重要金属之一。以粗氧化镍(主要含NiO、CoO、Fe2O3等)为原料制备纯镍的流程示意图如下:
(1)、检查装置气密性并加入药品后,加热前应进行的操作是 , 其目的是 , 此时活塞K1 , K2 , K3的状态为;一段时间后,打开电炉并加热反应管,此时活塞K1 , K2 , K3的状态为。(2)、试剂A为 , 装置单元X的作用是;反应过程中需用热源间歇性微热连接管,其目的是。(3)、反应结束后应继续通入一段时间CO2 , 主要目的是。(4)、将连接管切断并熔封,采用蒸馏法提纯。此时应将a端的仪器改装为、承接管和接收瓶,在防腐胶塞上加装的仪器是(填仪器名称)。30. 镍是制取各种高强度合金、耐热材料的重要金属之一。以粗氧化镍(主要含NiO、CoO、Fe2O3等)为原料制备纯镍的流程示意图如下:
回答下列问题:
(1)、已知:C(s)+O2(g)=CO2(g) △H1=+393.5kJ·mol-1CO(g)+)+ O2(g)=CO2(g) △H2=-283.0kJ·mol-1
反应a的化学方程式为 , 既有利于提高反应a的速率,又有利于提高原料CO2平衡转化率的措施是。
(2)、用离子方程式表示碱洗过程发生的反应。(3)、镍的羰化反应为:Ni(s)+4CO(g) Ni(CO)4(g) △H。①一定温度下,将一定量的粗镍和CO加入到1L的恒容密闭容器中反应,3s后测得Ni(CO)4的物质的量为0.6mol,则0~3s内平均反应速率v(CO)=mol·L-1·s-1。
②镍的羰化反应平衡常数表达式为K= , 当温度升高时,K减小,则该反应的△H0(填“>”或“<”或“=”)
(4)、羰化后的产物为Fe(CO)5、Co2(CO)8、Ni(CO)4 , 有关性质如下:
蒸馏提取Ni(CO)4应选择的适宜温度范围是。
(5)、采用230℃分解Ni(CO)4(g)制取金属镍,所获金属镍中常常含有碳,原因是(运用化学平衡移动原理解释)。31. 正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。发生的反应如下:
CH3CH2CH2CH2OH CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
沸点/℃
密度/(g·cm-3)
水中溶解性
正丁醇
117.2
0.810 9
微溶
正丁醛
75.7
0.801 7
微溶
实验步骤如下:将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,与5 mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量2.0 g。
回答下列问题:
(1)、实验中,Na2Cr2O7溶液和浓硫酸添加的顺序为。(2)、加入沸石的作用是。若加热后发现未加沸石,应采取的正确方法是。
(3)、上述装置图中,D仪器的名称是 , E仪器的名称是。(4)、分液漏斗使用前必须进行的操作是。(5)、将正丁醛粗产品置于分液漏斗中分水时,正丁醛在层(填“上”或“下”)。(6)、反应温度应保持在90~95 ℃,其原因是(7)、本实验中,正丁醛的产率为%(结果保留两位小数)。32. 过氧化尿素是一种新型漂白剂、消毒剂、漂白、消毒的效果优于H2O2和过氧乙酸。某工业用过氧化尿素的部分参数见下表:分子式
外观
热分解温度
熔点
水溶性(20℃)
CO(NH2)2·H2O2
白色晶体
45℃
75~85℃
500g·L-1
合成过氧化尿素的步骤及反应器的示意图如下:在250mL三颈烧瓶中加入一定量的30%的H2O2溶液,再加入30g尿素,在不断搅拌下升温至300℃,使尿素完全溶解,保温30min,冷却至-5℃进行结晶。抽滤得白色粉末状结晶。在50℃下干燥2h,得过氧化尿素产品。回答下列问题:
 (1)、控制反应温度的适宜方法是__________ (填序号)。A、酒精灯加热 B、酒精喷灯加热 C、电炉加热 D、水浴加热(2)、反应器中发生反应的化学方程式为。(3)、反应器中冷凝管中冷水从(填“a”或“b”)流进;反应器加热温度不能太高的原因是。(4)、搅拌器不能选择铁质或铝质材料的原因是。(5)、为测定产品中活性氧的含量(活性氧16%,相当于含H2O234%),称取干燥样品12.000g,溶解,在250mL 容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL6mol·L-1的硫酸,然后用0.2000mol·L-1KMnO4标准溶液滴定(KMnO4溶液与尿素不反应),平行实验三次,实验结果如下:
(1)、控制反应温度的适宜方法是__________ (填序号)。A、酒精灯加热 B、酒精喷灯加热 C、电炉加热 D、水浴加热(2)、反应器中发生反应的化学方程式为。(3)、反应器中冷凝管中冷水从(填“a”或“b”)流进;反应器加热温度不能太高的原因是。(4)、搅拌器不能选择铁质或铝质材料的原因是。(5)、为测定产品中活性氧的含量(活性氧16%,相当于含H2O234%),称取干燥样品12.000g,溶解,在250mL 容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL6mol·L-1的硫酸,然后用0.2000mol·L-1KMnO4标准溶液滴定(KMnO4溶液与尿素不反应),平行实验三次,实验结果如下:实验序号
1
2
3
KMnO4溶液体积/mL
滴定前读数
0.00
0.00
2.00
滴定后读数
19.98
21.70
22.02
①KMnO4溶液应盛放在滴定管中,滴定终点的现象是。
②产品中活性氧的质量分数为。
③若滴定前滴定管尖嘴处无气泡,滴定后有气泡,会使测得的活性氧含量(填“偏高”“偏低”或“不变”)。
33. TiCl4是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4 , 设计实验如下(夹持装置略去):
已知:
①PdCl2溶液捕获CO时,生成金属单质和两种酸性气体化合物。
②TiCl4的制备需无水无氧且加热。
③
化合物
熔点/℃
沸点/℃
密度/g•cm-3
水溶性
TiCl4
-25
136.4
1.5
易水解生成难溶于水的物质,能溶于有机溶剂
CCl4
-23
76.8
1.6
难溶于水,与TiCl4互溶
请回答下列问题:
(1)、装置D中除生成TiCl4外,同时生成一种气态不成盐氧化物,该反应的化学方程式为。(2)、按照气流由左到右的方向,上述装置合理的连接顺序为a→→→f→g→→→→→(填仪器接口字母)。(3)、根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;(按符合题意的顺序填入下列操作的序号)。①加热装置D中陶瓷管 ②打开分液漏斗活塞
③停止加热,充分冷却 ④关闭分液漏斗活塞
实验时,当观察到时,开始进行步骤①。
(4)、设计实验证明装置E中收集到的液体中含有TiCl4:。(5)、装置F中发生反应的化学方程式为。(6)、制得的TiCl4产品中常含有少量CCl4 , 从产品中分离出TiCl4的操作名称为。34. 工业上用苯和1,2—二氯乙烷制联苄的反应原理如下
实验室制取联苄的装置如图所示(加热和夹持仪器略去)
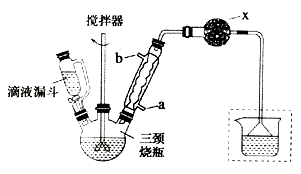
实验步骤:
①在三颈烧瓶中加入120.0mL苯和适量无水AlCl3 , 由滴液漏斗滴加10.0mL 1,2-二氯乙烷,控制反应温度在60~65℃,反应约60min。
②将反应后的混合物依次用2%Na2CO3溶液和水洗涤,在所得产物中加入少量无水MgSO4固体,静置、过滤,蒸馏收集一定温度下的馏分,得联苄18.2g。
相关物理常数和物理性质如下表:
名称
相对分子质量
密度/g·cm-3
熔点/℃
沸点/℃
溶解性
苯
78
0.88
5.5
80.1
难溶于水,易溶于乙醇
1,2-二氯乙烷
99
1.27
-35.3
83.5
难溶于水,可溶于苯
联苄
182
0.98
52
284
难溶于水,易溶于苯
(1)、和普通分液漏斗相比,使用滴液漏斗的优点是;球形冷凝管进水口是(选填“a”或“b”)(2)、仪器X的名称是;装置中虚线部分的作用是。(3)、洗涤操作中,用2%Na2CO3溶液洗涤的目的是;水洗的目的是。(4)、在进行蒸馏操作时,应收集℃的馏分。(5)、该实验中,联苄的产率约为%(小数点后保留两位)。35. FeCl2是一种常用的还原剂。实验室用无水氯化铁和氯苯来制备无水FeCl2。反应原理:2FeCl3+C6H5Cl 2FeCl2+C6H4Cl2+HCl熔点(℃)
沸点(℃)
溶解性(水)
溶解性
(乙醇)
溶解性
(乙醚)
其它
FeCl3、FeCl2
易吸水
易溶
不溶
不溶于C6H5Cl 、C6H4Cl2
C6H5Cl
45
132
不溶
易溶
易溶
C6H4Cl2
53
173
不溶
易溶
易溶
现设计如下方案:在A中放入16.25 g无水氯化铁和过量的氯苯,控制反应温度在128-139℃加热3 h.冷却、分离提纯得到粗产品;烧杯中所得盐酸(假设HCl完全被吸收)用AgNO3溶液滴定以测氯化铁转化率。
请回答下列问题:
 (1)、仪器B的名称(2)、仪器C中盛装的试剂可以是_______A、无水氯化钙 B、碱石灰 C、五氧化二磷 D、浓统酸(3)、反应后通入N2的目的是(4)、已知20 :时Ksp(AgCl,白色)=1.8×10-10 , Ksp(Ag2CrO4 , 砖红色)=3.4×10-11.
(1)、仪器B的名称(2)、仪器C中盛装的试剂可以是_______A、无水氯化钙 B、碱石灰 C、五氧化二磷 D、浓统酸(3)、反应后通入N2的目的是(4)、已知20 :时Ksp(AgCl,白色)=1.8×10-10 , Ksp(Ag2CrO4 , 砖红色)=3.4×10-11.将烧杯内溶液稀释至100 mL,每次取25.00 mL溶液进行滴定。选用K2CrO4做指示剂,用0.1000mol/L的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.20 mL,则滴定终点的现象是 , 氯化佚的转化率是
(5)、冷却实验装置,将三颈烧瓶内物质经过过滤、洗涤、干燥后,得到粗产品,洗涤所用最佳试剂是;回收滤液中C6H5Cl的操作方法是36. 碘对动植物的生命是极其重要的,海水里的碘化物和碘酸盐参与大多数海生物的新陈代谢。在高级哺乳动物中,碘以碘化氨基酸的形式集中在甲状腺内,缺乏碘会引起甲状腺肿大。I.现要从工业含碘废液中回收碘单质(废液中含有H2O、油脂、I2、I)。设计如图一所示的实验过程:
 (1)、为了将含碘废液中的I2完全转化为I—而进入水层,向含碘废液中加入了稍过量的A溶液,则A应该具有性。(2)、下列有关滴定的说法错误的是________(填标号)。A、标准Na2S2O3溶液应盛装在碱式滴定管中 B、滴定时眼睛只要注视滴定管中溶液体积的变化 C、滴定终点时,俯视读数,导致测定结果偏低 D、滴定到溶液由无色变蓝色时应该立即停止滴定(3)、将在三颈烧瓶中反应完全后的溶液经过操作②获得碘单质,操作②包含多步操作,操作名称分别为萃取、、 , 在操作②中必须用到下列所示的部分仪器或装置,这些仪器和装置是(填标号)。
(1)、为了将含碘废液中的I2完全转化为I—而进入水层,向含碘废液中加入了稍过量的A溶液,则A应该具有性。(2)、下列有关滴定的说法错误的是________(填标号)。A、标准Na2S2O3溶液应盛装在碱式滴定管中 B、滴定时眼睛只要注视滴定管中溶液体积的变化 C、滴定终点时,俯视读数,导致测定结果偏低 D、滴定到溶液由无色变蓝色时应该立即停止滴定(3)、将在三颈烧瓶中反应完全后的溶液经过操作②获得碘单质,操作②包含多步操作,操作名称分别为萃取、、 , 在操作②中必须用到下列所示的部分仪器或装置,这些仪器和装置是(填标号)。 (4)、用该测定方法测定的碘值需要用相关的实验校正,因为所测得的碘值总比实际碘值低,原因是。(5)、将操作①所得溶液放入图二所示的三颈烧瓶中,并用盐酸调至pH约为2,再缓慢通入适量Cl2 , 使其在30~40℃反应。写出其中发生反应的离子方程式;Cl2不能过量,因为过量的Cl2将I2氧化为IO3- , 写出该反应的离子方程式。(6)、该油脂的碘值为g(列式表示)。37.
(4)、用该测定方法测定的碘值需要用相关的实验校正,因为所测得的碘值总比实际碘值低,原因是。(5)、将操作①所得溶液放入图二所示的三颈烧瓶中,并用盐酸调至pH约为2,再缓慢通入适量Cl2 , 使其在30~40℃反应。写出其中发生反应的离子方程式;Cl2不能过量,因为过量的Cl2将I2氧化为IO3- , 写出该反应的离子方程式。(6)、该油脂的碘值为g(列式表示)。37.3,5−二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5—二甲氧基苯酚的部分物理性质见下表:
物质
沸点/℃
熔点/℃
密度(20℃) /g·cm—3
溶解性
甲醇
64. 7

0. 7915
易溶于水
乙醚
34. 5

0. 7138
微溶于水
3,5—二甲氧基苯酚

33~36

易溶于甲醇、乙醚,微溶于水
(1)、反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是。
②萃取时使用的主要仪器为。分离出该容器中的有机层的操作是。
(2)、分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3 溶液洗涤的目的是。(3)、洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是(填字母)。a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)、固液分离常采用减压过滤。减压过滤完成后应先拆去连接抽气泵和吸滤瓶的橡皮管再关闭抽气泵,其目的是。