高考二轮复习知识点:蒸发和结晶、重结晶2
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 下列说法正确的是( )A、减压过滤适用于过滤胶状氢氧化物类沉淀 B、实验室电器设备着火,可用二氧化碳灭火器灭火 C、制备硫酸亚铁铵晶体时,须将含 和 的溶液浓缩至干 D、将热的 饱和溶液置于冰水中快速冷却即可制得颗粒较大的晶体2. 下列实验操作能达到实验目的的是( )
 A、用经水湿润的pH试纸测量溶液的pH B、将4.0 g NaOH固体置于100 mL容量瓶中,加水至刻度,配制1.000 mol·L−1NaOH溶液 C、用装置甲蒸干AlCl3溶液制无水AlCl3固体 D、用装置乙除去实验室所制乙烯中的少量SO23. 下列操作或装置(略去部分夹持仪器)能达到预期目的的是( )
A、用经水湿润的pH试纸测量溶液的pH B、将4.0 g NaOH固体置于100 mL容量瓶中,加水至刻度,配制1.000 mol·L−1NaOH溶液 C、用装置甲蒸干AlCl3溶液制无水AlCl3固体 D、用装置乙除去实验室所制乙烯中的少量SO23. 下列操作或装置(略去部分夹持仪器)能达到预期目的的是( )



可用于收集Cl2或NH3
蒸发结晶得NaHCO3
除去HCl中少量SO2
验证非金属性:N>C>Si
A
B
C
D
A、A B、B C、C D、D4. 利用实验器材(规格和数量不限,省略夹持装置),能够完成相应实验的有几项( )实验器材
相应实验
①
量筒、温度计、烧杯、碎纸条、盖板
中和热的测定
②
烧杯、分液漏斗
用饱和 溶液除去乙酸乙酯中的乙酸和乙醇
③
量筒、玻璃捧、烧杯、 容量瓶
用浓盐酸配制 的稀盐酸溶液
④
蒸馏烧瓶、酒精灯、温度计、直形冷凝管、锥形瓶、牛角管、石棉网
分离甲醇和甘油的混合物
⑤
坩埚、酒精灯、玻璃棒、泥三角、三脚架
从食盐水中得到 晶体
A、2项 B、3项 C、4项 D、5项5. 实验室提供的玻璃仪器有烧杯、普通漏斗、酒精灯、蒸发皿、玻璃棒、试管、蒸馏烧瓶,非玻璃仪器任选,选用上述仪器能完成的实验是( )A、配制一定浓度和体积的NaOH溶液 B、石油分馏 C、重结晶法提纯苯甲酸 D、从海带灰中提取碘单质6. 实验室以碳化铝(含 少量C和 )和盐酸为原料在室温下反应制取甲烷并获得 ,下列图示装置不能达到相应实验目的的是( )已知: 。




A.制取
B.收集
C.滤去不溶物
D.制得
A、A B、B C、C D、D7. 用下列仪器或装置进行相应实验,能达到实验目的的是( )



A.蒸发结晶制备 晶体
B.分离苯和溴苯
C.实验室制取蒸馏水
D.配制100mL 溶液
A、A B、B C、C D、D8. 下列装置能达到实验目的的是( )A、熔化Na2CO3 B、保存液溴
B、保存液溴  C、分液,先放出水层,再倒出溴的苯溶液
C、分液,先放出水层,再倒出溴的苯溶液  D、进行中和热的测定
D、进行中和热的测定  9. 下列说法正确的是( )A、除去NaHCO3固体中的Na2CO3固体可用加热的方法 B、工业上采取电解熔融氧化镁的方法炼制金属镁 C、重结晶法提纯有机物选择溶剂要求:杂质在溶剂中溶解度受温度影响较大 D、溴乙烷与NaOH溶液共热后,加入AgNO3溶液,未出现淡黄色沉淀,不能说明溴乙烷没有水解10. 苯甲醛在浓 NaOH 溶液中反应生成苯甲酸钠和苯甲醇,反应后静置,液体分层。有关物质的物理性质如下:
9. 下列说法正确的是( )A、除去NaHCO3固体中的Na2CO3固体可用加热的方法 B、工业上采取电解熔融氧化镁的方法炼制金属镁 C、重结晶法提纯有机物选择溶剂要求:杂质在溶剂中溶解度受温度影响较大 D、溴乙烷与NaOH溶液共热后,加入AgNO3溶液,未出现淡黄色沉淀,不能说明溴乙烷没有水解10. 苯甲醛在浓 NaOH 溶液中反应生成苯甲酸钠和苯甲醇,反应后静置,液体分层。有关物质的物理性质如下:苯甲醛
苯甲酸
苯甲醇
沸点/℃
178.1
249.2
205.4
熔点/℃
-26
121.7
-15.3
溶解性(常温)
微溶于水,易溶于有机溶剂
下列说法错误的是( )
A、苯甲醛既发生了氧化反应,又发生了还原反应 B、用分液法分离出有机层,再用蒸馏法分离出苯甲醇 C、反应后的混合物直接加酸酸化,再用过滤法分离得到粗苯甲酸 D、制得的粗苯甲酸可以用重结晶法进一步提纯11. 利用乙醚、95%乙醇浸泡杜仲干叶,得到提取液,进步获得绿原酸粗产品的种工艺流程如下,下列说法不正确的是( ) A、常温下,绿原酸易溶于水 B、浸膏的主要成分是绿原酸 C、减压蒸馏的目的是降低蒸馏温度,以免绿原酸变质 D、绿原酸粗产品可以通过重结晶进一步提纯12. 利用下列实验装置及药品,能实现相应实验目的的是( )
A、常温下,绿原酸易溶于水 B、浸膏的主要成分是绿原酸 C、减压蒸馏的目的是降低蒸馏温度,以免绿原酸变质 D、绿原酸粗产品可以通过重结晶进一步提纯12. 利用下列实验装置及药品,能实现相应实验目的的是( ) A、用图1所示装置除去HCl中含有的少量Cl2 B、用图2所示装置制备胆矾 C、用图3所示装置可以完成“喷泉”实验 D、用图4所示装置制取纯净的NH313. 下列基本操作正确的是( )A、过滤
A、用图1所示装置除去HCl中含有的少量Cl2 B、用图2所示装置制备胆矾 C、用图3所示装置可以完成“喷泉”实验 D、用图4所示装置制取纯净的NH313. 下列基本操作正确的是( )A、过滤 B、稀释
B、稀释  C、尾气处理
C、尾气处理  D、蒸发结晶
D、蒸发结晶  14. 铅霜(醋酸铅)是一种中药,具有解毒敛疮、坠痰镇惊之功效,其制备方法为:将醋酸放入磁皿,投入氧化铅,微温使之溶化,以三层细布趁热滤去渣滓,放冷,即得醋酸铅结晶;如需精制,可将结晶溶于同等量的沸汤,滴醋酸少许,过七层细布,清液放冷,即得纯净铅霜。制备过程中没有涉及的操作方法是( )A、萃取 B、溶解 C、过滤 D、重结晶15. 中国传统文化对人类文明贡献巨大。下列两篇古代文献中都涉及到了KNO3。文献①:《开宝本草》记载:(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”,文献②《本草纲目》“火药乃焰硝(KNO3)、硫黄、山木炭所合,以为烽燧餇诸药者。”下列对其解释不合理的是( )A、文献①中提取KNO3利用了溶解、蒸发结晶的实验过程 B、用文献①中方法制取KNO3是因为KNO3的溶解度受温度影响不大 C、文献②中火药的使用体现了硝酸钾的氧化性 D、文献②中使用火药的产物会污染环境16. 下列有关实验的叙述正确的是( )
14. 铅霜(醋酸铅)是一种中药,具有解毒敛疮、坠痰镇惊之功效,其制备方法为:将醋酸放入磁皿,投入氧化铅,微温使之溶化,以三层细布趁热滤去渣滓,放冷,即得醋酸铅结晶;如需精制,可将结晶溶于同等量的沸汤,滴醋酸少许,过七层细布,清液放冷,即得纯净铅霜。制备过程中没有涉及的操作方法是( )A、萃取 B、溶解 C、过滤 D、重结晶15. 中国传统文化对人类文明贡献巨大。下列两篇古代文献中都涉及到了KNO3。文献①:《开宝本草》记载:(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”,文献②《本草纲目》“火药乃焰硝(KNO3)、硫黄、山木炭所合,以为烽燧餇诸药者。”下列对其解释不合理的是( )A、文献①中提取KNO3利用了溶解、蒸发结晶的实验过程 B、用文献①中方法制取KNO3是因为KNO3的溶解度受温度影响不大 C、文献②中火药的使用体现了硝酸钾的氧化性 D、文献②中使用火药的产物会污染环境16. 下列有关实验的叙述正确的是( ) A、用图1装置将氯化铁溶液直接蒸干得到氯化铁固体 B、利用图2装置可制备Fe(OH)2 C、图3微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 D、利用图4可收集氯化氢并进行尾气吸收17. 《本草述钩元》中的“石碱”条目下记载“采蒿蓼之属。开窖浸水。漉起。晒干烧灰。以原水淋汁。每百斤入粉面二三斤。久则凝淀如石。连汁货之四方。浣衣发面。”下列说法错误的是( )A、“石碱”的有效成分为碳酸盐 B、记载中包括石碱的制法与用途 C、制取过程中包括浸取、过滤、煅烧、蒸发结晶操作 D、“浣衣发面”都与石碱的碱性有关18. 中国文化源远流长,下列对描述内容所做的相关分析错误的是( )
A、用图1装置将氯化铁溶液直接蒸干得到氯化铁固体 B、利用图2装置可制备Fe(OH)2 C、图3微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 D、利用图4可收集氯化氢并进行尾气吸收17. 《本草述钩元》中的“石碱”条目下记载“采蒿蓼之属。开窖浸水。漉起。晒干烧灰。以原水淋汁。每百斤入粉面二三斤。久则凝淀如石。连汁货之四方。浣衣发面。”下列说法错误的是( )A、“石碱”的有效成分为碳酸盐 B、记载中包括石碱的制法与用途 C、制取过程中包括浸取、过滤、煅烧、蒸发结晶操作 D、“浣衣发面”都与石碱的碱性有关18. 中国文化源远流长,下列对描述内容所做的相关分析错误的是( )选项
描述
分析
A
“煤饼烧蛎成灰”
这种灰称为“蜃”,主要成分为Ca(OH)2
B
“以火烧之,紫青烟起,乃真硝石(KNO3)”
“紫青烟”是因为发生了焰色反应
C
司南之杓(勺),投之于地,其柢(勺柄)指南”
司南中“杓”的材质为Fe3O4
D
“信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾”
其中涉及到的操作有结晶
A、A B、B C、C D、D19. 下列分离方法中,和物质的溶解度无关的是( )A、升华 B、萃取 C、纸层析法 D、蒸发结晶20. 我国古代的化学工艺已经有相当大的成就,以下对古代文献中有关记载的化学解释错误的是( )选项
古代文献
记载
化学解释
A
《开宝本草》
“(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”
制取KNO3可“煎炼而成”是利用KNO3的溶解度受温度影响不大
B
《格物粗谈》
“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”
文中的“气”是指乙烯
C
《本草纲目》
“烧酒非古法也,白元时始创其法。用浓酒和糟入甑,蒸令气上,用器承取滴露。”
文中涉及的操作方法是蒸馏
D
《徐光启手迹》
“五金入强水皆化、惟黄金不化强水中”
“强水”主要成分是硝酸
A、A B、B C、C D、D21. 下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的是( ) A、用装置甲制取氯气 B、用装置乙除去氯气中混有的少量氯化氢 C、用装置丙分离二氧化锰和氯化锰溶液 D、用装置丁蒸干氯化锰溶液制MnCl2•4H2O
A、用装置甲制取氯气 B、用装置乙除去氯气中混有的少量氯化氢 C、用装置丙分离二氧化锰和氯化锰溶液 D、用装置丁蒸干氯化锰溶液制MnCl2•4H2O二、多选题
-
22. 中华文化对人类文明和进步有着巨大贡献,对下列描述所作的解释或说明正确的是( )
选项
描述
解释或说明
A
有硇水者,剪银塊投之,则旋而为水
能溶解银的“硇水”可能为硝酸
B
暮春之初,北海之民即煮海为盐
“煮海为盐”涉及蒸发结晶
C
曾青得铁则化为铜
曾青的蓝色来自
D
丹砂烧之成水银
金属均可用热分解法冶炼
A、A B、B C、C D、D23. 根据下列实验操作和现象所得出的结论正确的是( )选项
实验操作和现象
结论
A
向盛有某盐溶液的试管中滴入氢氧化钠溶液后,加热,试管口处湿润的红色石蕊试纸变蓝
该盐中含
B
向溴水中通入某无色气体,溴水褪色
该气体可能是CH2=CH2
C
一定量的铜与硝酸充分反应后,有铜剩余,再加入少量稀硫酸,铜继续溶解,并有气泡放出
Cu与稀硫酸发生了反应
D
向淀粉溶液中加少量稀硫酸,加热4~5min。冷却后向其中加入新制Cu(OH)2悬浊液,加热至沸腾,无砖红色沉淀
淀粉没有发生水解
A、A B、B C、C D、D三、非选择题
-
24. 乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:

水杨酸
醋酸酐
乙酰水杨酸
熔点/℃
157~159
-72~-74
135~138
相对密度/(g·cm﹣3)
1.44
1.10
1.35
相对分子质量
138
102
180
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右,充分反应。稍冷后进行如下操作.
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)、该合成反应中应采用__________加热。(填标号)A、热水浴 B、酒精灯 C、煤气灯 D、电炉(2)、下列玻璃仪器中,①中需使用的有(填标号),不需使用的(填名称)。 (3)、①中需使用冷水,目的是。(4)、②中饱和碳酸氢钠的作用是 , 以便过滤除去难溶杂质。(5)、④采用的纯化方法为。(6)、本实验的产率是%。25. 硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
(3)、①中需使用冷水,目的是。(4)、②中饱和碳酸氢钠的作用是 , 以便过滤除去难溶杂质。(5)、④采用的纯化方法为。(6)、本实验的产率是%。25. 硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
回答下列问题:
(1)、步骤①的目的是去除废铁屑表面的油污,方法是。(2)、步骤②需要加热的目的是 , 温度保持80~95 ℃,采用的合适加热方式是。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为(填标号)。 (3)、步骤③中选用足量的H2O2 , 理由是。分批加入H2O2 , 同时为了 , 溶液要保持pH小于0.5。(4)、步骤⑤的具体实验操作有 , 经干燥得到硫酸铁铵晶体样品。(5)、采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为。26. 硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质溶于水,不溶于乙醇、乙醚,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。(1)、I.CuSO4溶液的制备
(3)、步骤③中选用足量的H2O2 , 理由是。分批加入H2O2 , 同时为了 , 溶液要保持pH小于0.5。(4)、步骤⑤的具体实验操作有 , 经干燥得到硫酸铁铵晶体样品。(5)、采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为。26. 硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质溶于水,不溶于乙醇、乙醚,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。(1)、I.CuSO4溶液的制备①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
A仪器的名称为。
(2)、某同学在实验中有1.5g的铜粉剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因。(3)、II.晶体的制备将上述制备的CuSO4溶液按如图所示进行操作

已知浅蓝色沉淀的成分为Cu2(OH)2SO4 , 试写出生成此沉淀的离子反应方程式。
(4)、析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是。(5)、III.氨含量的测定精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mLClmol/L的盐酸标准溶液完全吸收。取下接收瓶,用C2mol/L NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。

玻璃管2的作用 , 样品中氨的质量分数的表达式。
(6)、下列实验操作可能使氨含量测定结果偏低的原因是____________________。A、滴定时未用NaOH标准溶液润洗滴定管 B、读数时,滴定前平视,滴定后俯视 C、滴定过程中选用酚酞作指示剂 D、取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁27. 重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO 等)制备K2Cr2O7的流程如图所示。
已知:I.在酸性条件下,H2O2能将Cr2O 还原为Cr3+;
Ⅱ.相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子
开始沉淀的pH
沉淀完全的pH
Cr3+
4.9
6.8
Fe3+
1.5
2.8
请回答下列问题:
(1)、滤渣①的主要成分 。(2)、加入H2O2的作用是(用离子方程式解释)。(3)、加热的目的是。(4)、“酸化”过程中发生反应的离子方程式为;若该反应的平衡常数K=4×1014L3·mol-3 , 已知:“酸化”后溶液中c(Cr2O )=1.6×10-3mol·L-1 , 则溶液中c(CrO )=。(5)、“结晶”后得到K2Cr2O7(M=294g·mol-1)产品0.6000g,将其溶解后用稀H2SO4酸化,再用浓度为0.01000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定,滴定反应为:Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O,滴定终点消耗标准溶液的体积为900mL,则产品的纯度为。(计算结果保留四位有效数字)(6)、在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚(C6H5OH)废水的有效处理,其工作原理如图所示。
①负极的电极反应式为;
②一段时间后,中间室中NaCl溶液的浓度(填“增大”、“减小”或“不变”)。
28. 以某含镍废料(主要成分为NiO,还含有少量FeO、Fe2O3、CoO、SiO2等)为原料制备NixOy和碳酸钻的工艺流程如下: (1)、“酸溶”时需将含镍废料粉碎,目的是;含有CoCO3的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为。(2)、“氧化”中添加NaClO3的作用是 , 为证明添加NaClO3已足量,可用 (写化学式)溶液进行检验。(3)、“调pH”过程中生成黄钠铁钒沉淀(NaFe3(SO4)2(OH)6),其离子方程式为。(4)、“沉钴”过程的离子方程式__。若“沉钴钻”开始时c(Co2+)=0.10 mol/L,则控制pH≤__时不会产生Co(OH)2沉淀。(已知Ksp[Co(OH)2]=4.0×10-15 , lg2=0.3)。(5)、从NiSO4溶液获得NiSO4·6H2O晶体的操作依次是:加热浓缩溶液至有晶膜出现, , 过滤,洗涤,干燥。“锻烧”时剩余固体质量与温度变化曲线如图,该曲线中B段所表示氧化物(NixOy)的化学式为。
(1)、“酸溶”时需将含镍废料粉碎,目的是;含有CoCO3的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为。(2)、“氧化”中添加NaClO3的作用是 , 为证明添加NaClO3已足量,可用 (写化学式)溶液进行检验。(3)、“调pH”过程中生成黄钠铁钒沉淀(NaFe3(SO4)2(OH)6),其离子方程式为。(4)、“沉钴”过程的离子方程式__。若“沉钴钻”开始时c(Co2+)=0.10 mol/L,则控制pH≤__时不会产生Co(OH)2沉淀。(已知Ksp[Co(OH)2]=4.0×10-15 , lg2=0.3)。(5)、从NiSO4溶液获得NiSO4·6H2O晶体的操作依次是:加热浓缩溶液至有晶膜出现, , 过滤,洗涤,干燥。“锻烧”时剩余固体质量与温度变化曲线如图,该曲线中B段所表示氧化物(NixOy)的化学式为。 29. 由含碘废水制取碘酸钾的一种工艺如下:
29. 由含碘废水制取碘酸钾的一种工艺如下: (1)、写出KIO3在日常生活中的一个重要应用。(2)、检验“含碘废水”中是否含有单质I2的常用试剂是(写试剂名称)。(3)、通入SO2的目的是将I2还原为I- , 该反应的离子方程式为。(4)、工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制”。(5)、“制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13 , Ksp[Fe(OH)2]=9.0×10-15。
(1)、写出KIO3在日常生活中的一个重要应用。(2)、检验“含碘废水”中是否含有单质I2的常用试剂是(写试剂名称)。(3)、通入SO2的目的是将I2还原为I- , 该反应的离子方程式为。(4)、工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制”。(5)、“制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13 , Ksp[Fe(OH)2]=9.0×10-15。为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I- , 起始加入K2CO3必须保持溶液的pH不大于。
(6)、“制KIO3溶液”反应的离子方程式为。(7)、KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为。 30. 钴是一种中等活泼金属,化合价为+2价和+3价,其中CoCl2易溶于水。某校同学设计实验制取(CH3COO)2Co(乙酸钴)并验证其分解产物。回答下列问题:(1)、甲同学用Co2O3与盐酸反应制备CoCl2•4H2O,其实验装置如下:
30. 钴是一种中等活泼金属,化合价为+2价和+3价,其中CoCl2易溶于水。某校同学设计实验制取(CH3COO)2Co(乙酸钴)并验证其分解产物。回答下列问题:(1)、甲同学用Co2O3与盐酸反应制备CoCl2•4H2O,其实验装置如下:
①烧瓶中发生反应的离子方程式为。
②由烧瓶中的溶液制取干燥的CoCl2•4H2O,还需经过的操作有蒸发浓缩、、洗涤、干燥等。
(2)、乙同学利用甲同学制得的CoCl2•4H2O在醋酸氛围中制得无水(CH3COO)2Co,并利用下列装置检验(CH3COO)2Co在氮气气氛中的分解产物。已知PdCl2溶液能被CO还原为Pd。
①装置E、F是用于检验CO和CO2的,其中盛放PdCl2溶液的是装置(填“E”或“F”)。
②装置G的作用是;E、F、G中的试剂均足量,观察到I中氧化铜变红,J中固体由白色变蓝色,K中石灰水变浑浊,则可得出的结论是。
③通氮气的作用是。
④实验结束时,先熄灭D和I处的酒精灯,一段时间后再关闭弹簧夹,其目的是。
⑤若乙酸钴最终分解生成固态氧化物X、CO、CO2、C2H6 , 且n(X):n(CO):n(CO2):n(C2H6)=1:4:2:3(空气中的成分不参与反应),则乙酸钴在空气气氛中分解的化学方程式为。
31. 以化工厂铬渣( 含有Na2SO4及少量Cr2O72-、Fe3+)为原料提取硫酸钠的工艺流程如下: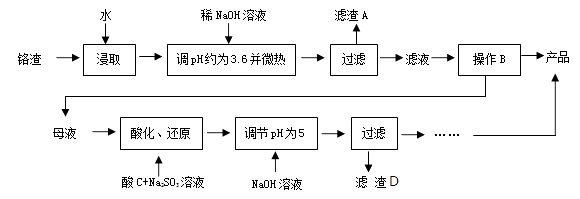
已知:Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol·L-1)时pH分别为3.6和5。
回答下列问题:
(1)、根据下图信息,操作B的最佳方法是。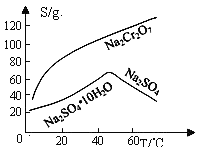 (2)、“母液”中主要含有的离子为。(3)、酸化后的Cr2O72-可被SO32-还原,该反应的离子方程式为。(4)、酸化、还原操作时,酸C 和Na2SO3溶液是(填“先后加入”或“混合后加入”),理由是。(5)、若pH=4.0时,溶液中Cr3+尚未开始沉淀,则溶液中允许Cr3+浓度的最大值为。(6)、根据2CrO42-+2H+ Cr2O72-+H2O 设计图示装置,以惰性电极电解Na2CrO4溶液制取Na2Cr2O7 , 图中右侧电极与电源的极相连,其电极反应式为。透过交换膜的离子为 , 该离子移动的方向为 (填“a→b”或“b→a”)。
(2)、“母液”中主要含有的离子为。(3)、酸化后的Cr2O72-可被SO32-还原,该反应的离子方程式为。(4)、酸化、还原操作时,酸C 和Na2SO3溶液是(填“先后加入”或“混合后加入”),理由是。(5)、若pH=4.0时,溶液中Cr3+尚未开始沉淀,则溶液中允许Cr3+浓度的最大值为。(6)、根据2CrO42-+2H+ Cr2O72-+H2O 设计图示装置,以惰性电极电解Na2CrO4溶液制取Na2Cr2O7 , 图中右侧电极与电源的极相连,其电极反应式为。透过交换膜的离子为 , 该离子移动的方向为 (填“a→b”或“b→a”)。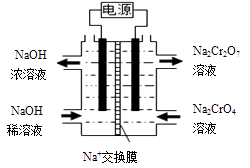 32. 硫酸亚铁作为补血剂,可促进动物的生长发育,增强抗病能力。以钛白副产绿矾(成分为、Fe2O3、FeO、PbO、CuO)为原料制备绿矾()并测定其纯度。(1)、Ⅰ.制备绿矾的工艺流程如下:
32. 硫酸亚铁作为补血剂,可促进动物的生长发育,增强抗病能力。以钛白副产绿矾(成分为、Fe2O3、FeO、PbO、CuO)为原料制备绿矾()并测定其纯度。(1)、Ⅰ.制备绿矾的工艺流程如下:
写出两条可提高“酸浸”效率的措施:。
(2)、检验“酸浸”后的溶液中是否含Fe3+的试剂是。(3)、“还原”时溶液中含铁物质发生反应的化学方程式为。(4)、“一系列操作”包括、洗涤、干燥。干燥时温度不宜过高,其原因是。(5)、Ⅱ.纯度的测定:实验步骤:
①称取5.0g绿矾,溶解于水中,配成250mL溶液;
②量取25.00mL待测液于锥形瓶中;
③用0.01mol·L-1的酸性KMnO4标准液滴定至终点,再重复滴定两次,消耗酸性KMnO4标准液的平均体积为35.00mL。
酸性KMnO4标准液盛放在(填“A”或“B”)中。
 (6)、滴定时反应的离子方程式为。(7)、的纯度为。33. 溴化锂(LiBr)是一种高效空气湿度调节剂;碘化钠(NaI)可用于医用祛痰剂等。它们可利用单质直接化合、氢氧化物和氢卤酸中和等反应合成。(1)、工业上以碳酸锂为原料制备晶体的流程如下:
(6)、滴定时反应的离子方程式为。(7)、的纯度为。33. 溴化锂(LiBr)是一种高效空气湿度调节剂;碘化钠(NaI)可用于医用祛痰剂等。它们可利用单质直接化合、氢氧化物和氢卤酸中和等反应合成。(1)、工业上以碳酸锂为原料制备晶体的流程如下:
①合成LiBr时生成了两种参与大气循环的气体,反应的化学方程式为。
②加还原剂硫脲除去可能含有的 , 共有molσ键。
③溴化锂的溶解度随温度的变化曲线如图所示。则从脱色、过滤所得溶液中提取晶体的操作有:在HBr氛围下蒸发浓缩、 , , 洗涤后烘干。
 (2)、某学生兴趣小组在实验室用碘单质制备较纯的NaI晶体,部分装置如图所示。
(2)、某学生兴趣小组在实验室用碘单质制备较纯的NaI晶体,部分装置如图所示。
药品:溶液(含8.2gNaOH)、25.4g碘、水合肼(还原剂,产物为N2)、1.0g活性炭和蒸馏水等。
实验步骤:向三口烧瓶中加入30mLNaOH溶液,边搅拌边加入25.4g单质碘。连接好装置并通入冷凝水,过滤后将滤液蒸发浓缩、结晶、过滤、干燥得产品24.3g。
回答问题:①碘溶于NaOH溶液生成NaI和的离子方程式为。
②设计合理方案,补充完整上述实验步骤:。
34. 废旧芯片中常含有大量的单质Si和少量的Au、Ag、Cu等金属。某化学课外兴趣小组设计了如下图所示方法回收废旧芯片中的Au、Ag并制取硝酸铜晶体。回答下列问题:
已知:①王水是浓硝酸与浓盐酸以体积比1:3形成的混合溶液;
②Au只溶于王水;
③的电离方程式:。
(1)、操作Ⅰ所用到的玻璃仪器有玻璃棒和 , 金属B是。(2)、酸溶芯片的过程可用稀硝酸或浓硝酸,实际的工业生产最好选择硝酸(填“稀”或“浓”),其主要的理由是。(3)、王水溶解Au时会产生一种无色气体,该气体在空气中迅速变为红棕色,则王水溶解Au的离子反应方程式为。(4)、若用过量的Mg将1mol完全还原,则参加反应的Mg的质量是g。(5)、操作Ⅱ包括了蒸发浓缩、、过滤、洗涤、琼干,洗涤中选择的洗涤剂最好是(填正确答案标号),原因是。A.蒸馏水 B. C.70%酒精 D.饱和溶液
35. 以铝土矿(主要成分为Al2O3 , 含SiO2和Fe2O3等杂质)为原料制备耐高温陶瓷材料AlN和FeCl3·6H2O晶体的工艺流程如图所示: (1)、提高“酸溶”一步反应速率的方法有 (任意写出一种即可),滤渣I的主要成分是(填化学式)。(2)、向滤液I中加入过量NaOH溶液;发生的离子反应有H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓和。(3)、在滤渣II中加入盐酸,经过蒸发浓缩、、、低温干燥, 获得FeCl3·6H2O晶体。(4)、已知X是一种有毒气体,写出高温制备AlN的化学方程式:。当制备AlN的反应中产生3.36 L(标准状况)气体X时,制得AlNg。
(1)、提高“酸溶”一步反应速率的方法有 (任意写出一种即可),滤渣I的主要成分是(填化学式)。(2)、向滤液I中加入过量NaOH溶液;发生的离子反应有H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓和。(3)、在滤渣II中加入盐酸,经过蒸发浓缩、、、低温干燥, 获得FeCl3·6H2O晶体。(4)、已知X是一种有毒气体,写出高温制备AlN的化学方程式:。当制备AlN的反应中产生3.36 L(标准状况)气体X时,制得AlNg。