高考二轮复习知识点:过滤
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 下列实验装置(夹持装置略)及操作正确的是( )
 A、装置甲气体干燥 B、装置乙固液分离 C、装置丙Cl2制备 D、装置丁pH测试2. 下列实验中,不能达到实验目的的是( )
A、装置甲气体干燥 B、装置乙固液分离 C、装置丙Cl2制备 D、装置丁pH测试2. 下列实验中,不能达到实验目的的是( )由海水制取蒸馏水
萃取碘水中的碘
分离粗盐中的不溶物
由制取无水固体



A
B
C
D
A、A B、B C、C D、D3. 《医学入门》中记载我国传统中医提纯铜绿的方法:“水洗净,细研水飞,去石澄清,慢火熬干,”其中未涉及的操作是( )A、洗涤 B、粉碎 C、萃取 D、蒸发4. 下列实验操作规范的是( )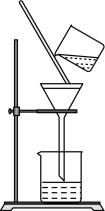
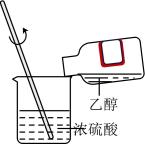
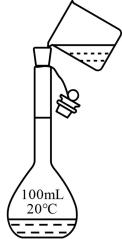
A.过滤
B.排空气法收集
C.混合浓硫酸和乙醇
D.溶液的转移
A、A B、B C、C D、D5. 模拟从海水中提取镁的实验装置、操作及目的如图所示,能达到实验目的的是选项
A
B
C
D
装置




操作及目的
煅烧贝壳至900℃,得到生石灰
浓缩海水,加生石灰反应后过滤,得到
蒸发溶液,得到无水
电解溶液,制备金属Mg
A、A B、B C、C D、D6. 黑木耳中富含铁元素,欲测定黑木耳中铁元素含量,按如下流程进行实验,对应操作正确的是
A
B
C
D




称量
灼烧
酸溶
过滤
A、A B、B C、C D、D7. 实验室从I2的CCl4溶液中分离出I2的主要步骤:用浓NaOH(aq)反萃取、分液、酸化、过滤等。下列说法正确的是( )A、反萃取时的离子方程式:I2+2OH-=I-+IO3-+H2O B、反萃取时,倒转振荡过程中要适时旋开活塞放气 C、分液时,先放出CCl4 , 再从下口放出水溶液 D、过滤时,可用玻璃棒搅拌以加快I2的分离8. 《本草纲目》中的“石硷”(古文中“硷”同“碱”条目下写道:“采蒿蓼之属,开窖浸水,漉起,晒干烧灰,以原水淋汁……久则疑淀如石,连汁货之四方,浣衣发面,甚获利也”。上述过程没有涉及的实验操作的是( )A、溶解 B、过滤 C、蒸馏 D、结晶9. 氧化铈(CeO2)是应用广泛的稀土氧化物。一种用氟碳铈矿(CeFCO3 , 含BaO、SiO2等杂质)为原料制备CeO2 , 的工艺如图。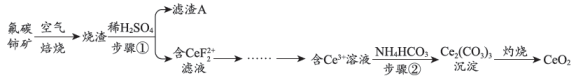
下列说法错误的是( )
A、滤渣A的主要成分为BaSO4和SiO2 B、步骤①、②中均有过滤操作 C、该过程中,铈元素的化合价变化了两次 D、步骤②反应的离子方程式为2Ce3++6HCO=Ce(CO3)3↓+3CO2↑+3H2O10. 从海带中提取碘的一种实验流程如图所示,下列说法错误的是( ) A、灼烧海带可在坩埚中进行 B、操作①为加水浸泡、过滤、洗涤残渣 C、反应②中发生的主要反应为 D、试剂③可以选用无水乙醇11. 《本草纲目》中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”记载。有关说法错误的是( )A、薪柴之灰可做钾肥 B、取碱浇衣存在水解反应 C、碱浣衣与肥皂浣衣原理不同 D、上述过程涉及溶解、过滤、蒸馏操作12. 中华优秀传统文化涉及了很多化学知识,下列说法正确的是( )A、“弄风柳絮疑城雪,满地榆钱买得春”中的“柳絮”和棉花的主要成分均为蛋白质 B、“煮豆持作羹,漉之以为汁”中的“漉”,涉及的实验基本操作是过滤 C、《新修草本》有关“青矾”的描述为“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”,据此推测“青矾”的主要成分为Fe2(SO4)3·7H2O D、《本草纲目拾遗》中对“强水”的记载:“性最猛烈,能蚀五金。”“强水”为强电解质13. 制作豆腐的流程中,属于过滤操作的是( )
A、灼烧海带可在坩埚中进行 B、操作①为加水浸泡、过滤、洗涤残渣 C、反应②中发生的主要反应为 D、试剂③可以选用无水乙醇11. 《本草纲目》中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”记载。有关说法错误的是( )A、薪柴之灰可做钾肥 B、取碱浇衣存在水解反应 C、碱浣衣与肥皂浣衣原理不同 D、上述过程涉及溶解、过滤、蒸馏操作12. 中华优秀传统文化涉及了很多化学知识,下列说法正确的是( )A、“弄风柳絮疑城雪,满地榆钱买得春”中的“柳絮”和棉花的主要成分均为蛋白质 B、“煮豆持作羹,漉之以为汁”中的“漉”,涉及的实验基本操作是过滤 C、《新修草本》有关“青矾”的描述为“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”,据此推测“青矾”的主要成分为Fe2(SO4)3·7H2O D、《本草纲目拾遗》中对“强水”的记载:“性最猛烈,能蚀五金。”“强水”为强电解质13. 制作豆腐的流程中,属于过滤操作的是( )A.泡豆
B.磨浆
C.滤渣
D.煮浆点兑



 A、A B、B C、C D、D14. 以铝土矿粉(主要含Al2O3、Fe2O3、SiO2 , 少量FeS2和金属硫酸盐);为原料生产Al2O3和Fe3O4的部分流程如下:
A、A B、B C、C D、D14. 以铝土矿粉(主要含Al2O3、Fe2O3、SiO2 , 少量FeS2和金属硫酸盐);为原料生产Al2O3和Fe3O4的部分流程如下:
下列说法正确的是( )
A、“焙烧I”时,加入少量CaO可提高矿粉中硫的去除率 B、用NaOH溶液吸收过量SO2的离子方程式为: 2OH- +SO2=SO +H2O C、滤液中通入足量CO2 , 过滤后可得到Al2O3 D、无氧条件下进行“焙烧II”时,理论上消耗的n(FeS2):n(Fe2O3)=1:1615. 某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2·3H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2。设计的路线如图:已知:;SOCl2熔点-105℃、沸点76℃,遇水剧烈水解生成两种酸性气体。
下列说法不正确的是( )
A、第②步调pH适合的物质是CuO或Cu(OH)2或Cu2(OH)2CO3 B、第③步操作包括蒸发结晶、过滤等步骤 C、为得到较大颗粒的Cu(NO3)2·3H2O晶体,可采用减慢冷却结晶速度或冷却后静置较长时间的方法 D、第④步中发生的总反应的化学方程式Cu(NO3)2·3H2O+3SOCl2=Cu(NO3)2+3SO2↑+6HCl↑16. 下列图示操作错误的是( )A、定容 B、过滤
B、过滤 C、蒸发
C、蒸发 D、分液
D、分液 17. 下列实验装置进行的相应实验,达不到实验目的的是( )
17. 下列实验装置进行的相应实验,达不到实验目的的是( ) A、用图1所示装置获取苯甲酸晶体 B、用图2所示装置去除粗盐中的泥沙 C、用图3所示装置加热蒸发KCl饱和溶液制备KCl晶体 D、用图4所示装置用于裂化汽油提纯溴水中的Br218. 下列除杂试剂和分离方法都正确的是( )
A、用图1所示装置获取苯甲酸晶体 B、用图2所示装置去除粗盐中的泥沙 C、用图3所示装置加热蒸发KCl饱和溶液制备KCl晶体 D、用图4所示装置用于裂化汽油提纯溴水中的Br218. 下列除杂试剂和分离方法都正确的是( )选项
物质(括号内为杂质)
除杂试剂
分离方法
A
粉
加热
B
饱和溶液
洗气
C
盐酸
过滤
D
饱和食盐水
洗气
A、A B、B C、C D、D19. 下列实验方案正确的是( )A
B
C
D




分离四氯化碳与水
除去食盐水中的泥沙
制备乙酸乙酯
分离苯和硝基苯
A、A B、B C、C D、D20. 下列实验分离操作能达到目的的是( ) A、甲:分离碘单质和氯化铵的混合固体 B、乙:分离硫酸钡固体和氯化钠溶液的混合物 C、丙:分离乙醇和水的混合溶液 D、丁:分离硝基苯和苯的混合溶液21. 下列分离原理和操作均正确且能达到分离目的的是( )
A、甲:分离碘单质和氯化铵的混合固体 B、乙:分离硫酸钡固体和氯化钠溶液的混合物 C、丙:分离乙醇和水的混合溶液 D、丁:分离硝基苯和苯的混合溶液21. 下列分离原理和操作均正确且能达到分离目的的是( )选项
A
B
C
D
装置




目的
分离NaCl和I2的固体混合物
分离Fe(OH)3胶体中的FeCl3
除去CO2中混有的SO2
用乙醇萃取碘水中的碘并分离
A、A B、B C、C D、D22. 钛酸酯偶联剂(C57H106O7Ti)可用于碳酸钙等进行有机物改性,使其可与聚乙烯、聚丙烯等融合,从而改善塑料性能。合成方法如图,下列说法错误的是( ) A、流程中“气体X”为氨气,“操作1”为过滤 B、“反应釜1”中的反应均为非氧化还原反应 C、反应釜2中,钛酸四异丙酯与油酸发生取代反应,物质的量之比为1:3 D、反应釜2在常温混合搅拌阶段需要冷凝回流溶液,由此判断该反应为吸热反应
A、流程中“气体X”为氨气,“操作1”为过滤 B、“反应釜1”中的反应均为非氧化还原反应 C、反应釜2中,钛酸四异丙酯与油酸发生取代反应,物质的量之比为1:3 D、反应釜2在常温混合搅拌阶段需要冷凝回流溶液,由此判断该反应为吸热反应二、非选择题
-
23. 钴配合物溶于热水,在冷水中微溶,可通过如下反应制备:。
具体步骤如下:
Ⅰ.称取 , 用水溶解。
Ⅱ.分批加入后,将溶液温度降至以下,加入活性炭、浓氨水,搅拌下逐滴加入的双氧水。
Ⅲ.加热至反应。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
(1)、步骤Ⅰ中使用的部分仪器如下。
仪器a的名称是。加快NH4Cl溶解的操作有。
(2)、步骤Ⅱ中,将温度降至10℃以下以避免、;可选用降低溶液温度。(3)、指出下列过滤操作中不规范之处:。 (4)、步骤Ⅳ中,趁热过滤,除掉的不溶物主要为。(5)、步骤Ⅴ中加入浓盐酸的目的是。24. 醋酸亚铬[( CH3 COO)₂Cr·2H₂O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂,一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:
(4)、步骤Ⅳ中,趁热过滤,除掉的不溶物主要为。(5)、步骤Ⅴ中加入浓盐酸的目的是。24. 醋酸亚铬[( CH3 COO)₂Cr·2H₂O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂,一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题: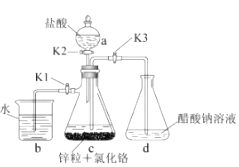 (1)、实验中所用蒸馏水均需经煮沸后迅速冷却,目的是 , 仪器a的名称是。(2)、将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开
(1)、实验中所用蒸馏水均需经煮沸后迅速冷却,目的是 , 仪器a的名称是。(2)、将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1 , K2 , 关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为。
②同时c中有气体产生,该气体的作用是。
(3)、打开K3 , 关闭K1和K2。c中亮蓝色溶液流入d,其原因是;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是、、洗涤、干燥。(4)、指出装置d可能存在的缺点。25. 镀镍生产过程中产生的酸性硫酸镍废液(含有Fe2+、Zn2+、Mg2+、Ca2+等杂质离子),通过精制提纯可制备高纯硫酸镍,部分流程如图:
资料1:25℃时,生成氢氧化物沉淀的pH
Fe(OH)2
Fe(OH)3
Zn(OH)2
Mg(OH)2
Ca(OH)2
Ni(OH)2
开始沉淀时
6.3
1.5
6.2
9.1
11.8
6.9
完全沉淀时
8.3
2.8
8.2
11.1
13.8
8.9
注:金属离子的起始浓度为0.1mol/L.
资料2:25℃时,Ksp(CaF2)=4×10-11 , Ksp(MgF2)=9×10-9 , ZnF2易溶于水。
资料3:P204(二乙基己基磷酸)萃取金属离子的反应为:x
 +Mx+
+Mx+  M+xH+(1)、操作1、2的名称是 , 操作3的名称是。(2)、操作1中加入Cl2的主要目的是。(3)、NiF2溶液参与反应的离子方程式是。杂质离子沉淀完全时,溶液中c(F-)=mol/L(c(杂质离子)≤10-5mol/L即可视为沉淀完全)。(4)、滤液b中含有的微粒主要有。(5)、在硫酸盐溶液中,P204对某些金属离子的萃取率与pH关系如图所示,在一定范围内,随着pH升高,萃取率升高的原因是。
M+xH+(1)、操作1、2的名称是 , 操作3的名称是。(2)、操作1中加入Cl2的主要目的是。(3)、NiF2溶液参与反应的离子方程式是。杂质离子沉淀完全时,溶液中c(F-)=mol/L(c(杂质离子)≤10-5mol/L即可视为沉淀完全)。(4)、滤液b中含有的微粒主要有。(5)、在硫酸盐溶液中,P204对某些金属离子的萃取率与pH关系如图所示,在一定范围内,随着pH升高,萃取率升高的原因是。 (6)、在母液中加入其它物质,可制备操作1中所需Ni(OH)2浆液,写出制备的离子方程式。26. Li2S(硫化锂)是一种潜在的锂电池的电解质材料。某小组选择下列装置(装置B使用两次)利用氢气还原硫酸锂制备硫化锂,原理是Li2SO4 +4H2Li2S +4H2O。已知:Li2S易潮解,在加热条件下易被空气中的O2氧化。实验室用粗锌(含少量铜、FeS)和稀硫酸反应制备H2。
(6)、在母液中加入其它物质,可制备操作1中所需Ni(OH)2浆液,写出制备的离子方程式。26. Li2S(硫化锂)是一种潜在的锂电池的电解质材料。某小组选择下列装置(装置B使用两次)利用氢气还原硫酸锂制备硫化锂,原理是Li2SO4 +4H2Li2S +4H2O。已知:Li2S易潮解,在加热条件下易被空气中的O2氧化。实验室用粗锌(含少量铜、FeS)和稀硫酸反应制备H2。
请回答下列问题:
(1)、按气流从左至右,装置的连接顺序是A→ (填字母)。(2)、其他条件相同,粗锌与稀硫酸反应比纯锌 (填“快"或“慢”)。实验中观察到装置D中产生黑色沉淀,其离子方程式为。(3)、利用装置A制氢气的主要优点是 , 还可用该装置制备的下列气体是 (填字母)。A.SO2:70%硫酸、亚硫酸钠粉末 B.CO2:稀盐酸、大理石
C.NH3:浓氨水生石灰 D.Cl2:浓盐酸、二氧化锰
(4)、实验完毕后,采用图1、图2(夹持装置已略去)装置对装置A中混合物进行分离可得到副产物皓矾(ZnSO4·7H2O)晶体。先选择图1装置进行过滤,并将滤液进行蒸发浓缩、降温结晶,再选择图2装置过滤,得到粗皓矾晶体。
下列有关说法正确的是____(填字母)。
A、采用图1装置过滤的优点是避免析出ZnSO4·7H2O B、采用图1装置过滤主要是分离FeSO4·7H2O和ZnSO4溶液 C、粗皓矾晶体中可能含少量CuSO4·5H2O杂质 D、采用图2装置过滤的优点是过滤速度快(5)、欲探究Li2S产品的成分,现进行如下实验:实验
操作与现象
结论
Ⅰ
取少量Li2S样品,滴加足量的稀盐酸,将气体通入品红溶液中,溶液褪色
样品含Li2SO3
Ⅱ
在实验Ⅰ的溶液中滴加BaCl2溶液,产生白色沉淀
样品含
①由上述实验I可知,Li2S样品中含有杂质(填化学式),产生该杂质的原因可能是。
②测定产品纯度的方法:取w g Li2S样品加入V1 mLc1 mol·L-1稀硫酸(过量)中,充分反应后,煮沸溶液以除去残留的酸性气体;滴加酚酞溶液作指示剂,用c2mol·L-1标准NaOH溶液滴定过量的硫酸,消耗NaOH溶液V2 mL。若该Li2S样品中杂质不参加反应,用上述方法测得的Li2S样品的纯度为%(用含V1、V2、c1、c2、w的代数式表示)。
27. 碘在科研与生活中有重要作用。(1)、I.实验室按如下实验流程提取海带中的碘。海带→灼烧→过滤→氧化→萃取、分液→I2的CCl4溶液
上述实验流程中不需要用到的仪器是(从下列图中选择,写出名称)。
 (2)、“氧化”时加入3mol·L-1H2SO4和3%H2O2溶液,发生反应的离子方程式为。(3)、海带灰中含有的其他可溶性无机盐。是在(从以上流程中选填实验操作名称)中实现与碘分离。(4)、II.定量探究+2I-=2+I2的反应速率与反应物浓度的关系。
(2)、“氧化”时加入3mol·L-1H2SO4和3%H2O2溶液,发生反应的离子方程式为。(3)、海带灰中含有的其他可溶性无机盐。是在(从以上流程中选填实验操作名称)中实现与碘分离。(4)、II.定量探究+2I-=2+I2的反应速率与反应物浓度的关系。查阅资料:该反应速率与c(S2O82-)和c(I-)的关系v=kcm()cn(I-),k为常数。
实验任务:测定不同浓度下的反应速率确定所m、n的值。
实验方法:按下表体积用量V将各溶液混合,(NH4)2S2O8溶液最后加入,记录开始反应至溶液出现蓝色所用的时间t。实验过程中发生如下反应:+2I-=2+I2(慢)I2+2=2I-+(快)
实验记录表:
实验编号
A
B
C
D
E
0.2mol·L-1(NH4)2S2O8溶液/mL
10
5
2.5
10
10
0.2mol·L-1KI溶液/mL
10
10
10
5
2.5
0.05mol·L-1Na2S2O3溶液/mL
3
3
3
3
3
0.2mol·L-1KNO3溶液/mL
0
V1
V2
V3
V4
0.2mol·L-1(NH4)2SO4溶液/mL
0
V5
V6
V7
V8
0.2%淀粉溶液/mL
1
1
1
1
1
t/s
t1
t2
t3
t4
t5
加入KNO3、(NH4)2SO4溶液的目的是控制实验条件,其中V1 , V4 , V5。
(5)、当溶液中(填化学式)耗尽后溶液出现蓝色。根据实验A的数据,反应速率v(-)=mol·L-1·s-1(列出算式)。(6)、根据实验数据可确定m、n的值。n=1的判断依据是(用t的关系式来表示)。28. 从高铝粉煤灰(主要成分为、、、、等)中回收金属、并制备电池正极材料的工艺流程如下图所示:
已知:①与同主族,其化学性质相似。
②随着温度升高,在水溶液中的溶解度减小:
温度/
0
20
40
60
80
100
溶解度/
1.54
1.33
1.17
1.01
0.85
0.72
③本工艺流程中,不同金属离子形成氢氧化物沉淀的范围如表格所示:
金属离子
形成氢氧化物沉淀的范围
3.3~10.6
2.9~9.4
回答下列问题:
(1)、“滤渣1”的成分除了之外还含有。(2)、已知“酸浸”后铁元素以铁配离子()的形式存在,写出在该过程中的离子方程式。(3)、“调”步骤中的范围应为 , “滤液2”中镓元素的存在形式为。(4)、工业上通过电解法利用“物质”制备 , 反应的化学方程式为。(5)、“”中的元素化合价为 , 在“电池级”转化为“”的反应中,氧化剂与还原剂物质的量之比为。29. 2-(对甲基苯基)苯并咪唑( )是合成对甲基苯甲醛(PTAL)的中间体,其沸点为270℃。利用邻苯二胺(
)是合成对甲基苯甲醛(PTAL)的中间体,其沸点为270℃。利用邻苯二胺(  )和对甲基苯甲酸(
)和对甲基苯甲酸(  )合成2-(对甲基苯基)苯并咪唑的反应过程如下:
)合成2-(对甲基苯基)苯并咪唑的反应过程如下: 
向反应装置(如图)中加入0.1 mol邻苯二胺和0.15 mol对甲基苯甲酸后,再加入适量多聚磷酸(能与水互溶的质子酸),搅拌成糊状物,慢慢升温至100℃并搅拌1h,继续加热至190℃,回流2h,冷却。用10%的NaOH溶液调至微碱性,有大量固体出现,分离晶体,水洗,经重结晶提纯后,得白色针状晶体产品14.6 g.回答下列问题:
 (1)、仪器A的名称为 , 冷却水的流向为(填“a进b出”或“b进a出”)。(2)、制备过程中需在190℃下回流2h,可采取的加热方式为(填“水浴加热”或“油浴加热”)。(3)、“分离结晶”得到晶体与母液,其操作名称为 , 加入10%的NaOH溶液的作用为;分离完成后“水洗”的具体操作为。(4)、粗产品一般需要通过重结晶的方法来提纯,步骤为加热溶解→活性炭脱色→趁热过滤→冷却结晶→过滤→洗涤→干燥,其中需要趁热过滤的原因是;趁热过滤时所得滤渣中一定含有(填名称)。(5)、2-(对甲基苯基)苯并咪唑的产率为(保留三位有效数字)。30. CoCl2是一种性能优越的电池前驱材料,可用于电镀。含钴矿中Co元素主要以Co2O3、CoO形式存在,还含有Fe3O4、SiO2、CuO、ZnO、NiO、MgCO3等杂质,制取氯化钴晶体的一种工艺流程如下:
(1)、仪器A的名称为 , 冷却水的流向为(填“a进b出”或“b进a出”)。(2)、制备过程中需在190℃下回流2h,可采取的加热方式为(填“水浴加热”或“油浴加热”)。(3)、“分离结晶”得到晶体与母液,其操作名称为 , 加入10%的NaOH溶液的作用为;分离完成后“水洗”的具体操作为。(4)、粗产品一般需要通过重结晶的方法来提纯,步骤为加热溶解→活性炭脱色→趁热过滤→冷却结晶→过滤→洗涤→干燥,其中需要趁热过滤的原因是;趁热过滤时所得滤渣中一定含有(填名称)。(5)、2-(对甲基苯基)苯并咪唑的产率为(保留三位有效数字)。30. CoCl2是一种性能优越的电池前驱材料,可用于电镀。含钴矿中Co元素主要以Co2O3、CoO形式存在,还含有Fe3O4、SiO2、CuO、ZnO、NiO、MgCO3等杂质,制取氯化钴晶体的一种工艺流程如下:
滤液3经过多次萃取与反萃取制备CoCl2晶体。

已知:
①焦亚硫酸钠Na2S2O5 , 常做食品抗氧化剂。MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
Co3+
Fe3+
Cu2+
Co2+
Fe2+
Zn2+
Mg2+
开始沉淀pH
0.3
2.7
5.5
7.2
7.6
7.6
9.6
完全沉淀pH
1.1
3.2
6.6
9.2
9.6
9.2
11.1
请回答:
(1)、实验室中进行操作①时所需的玻璃仪器有。滤渣1的主要成分是。(2)、取时加入Na2S2O5发生的氧化还原反应的离子方程式为。(3)、滤液1中加入NaClO3的作用为。加入Na2CO3溶液发生反应的离子方程式为。(4)、滤液3中加入萃取剂I,然后用稀盐酸反萃取的目的是。(5)、制备晶体CoCl2·6H2O,需在减压环境下烘干的原因是。(6)、某学习小组同学为测定产品中CoCl2·6H2O晶体的纯度,将一定量的样品溶于水,再向其中加入足量AgNO3溶液,过滤洗涤,并将沉淀烘干后称量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是。(写一条即可)。31. 工业制取皮革加工中的鞣化剂硝酸铝,是用铝灰与烧碱、硝酸反应制得的。铝灰是铝、氧化铝和氧化铁的混合物。产品硝酸铝晶体为Al(NO3)3·nH2O。已知偏铝酸盐能与一般的酸反应,如:NaAlO2+HNO3+H2O→NaNO3+Al(OH)3↓
生产流程如图:

完成下列填空:
(1)、用氢氧化钠固体配制30%的氢氧化钠溶液,除烧杯、玻璃棒外还需(选填编号)。A.
 B.
B.  C.
C.  D.
D. 
说出流程中产生的滤渣的一种用途是。制作一个过滤器需要。流程中操作x的名称是。
(2)、反应Ⅱ加入的硝酸必须适量,原因是。反应Ⅲ加入的硝酸要稍过量,原因是。(3)、从反应Ⅲ所得的溶液制成产品的步骤依次为减压蒸发, , 过滤, , 低温烘干。(4)、为测定所得的产品的纯度,质检人员称取产品Wg,溶于水配成500mL溶液,从中取出25.00mL,加入过量已知浓度的氨水充分反应后,剩余的氨水用已知浓度的盐酸溶液进行测定。通过计算便可得出产品的纯度。①上述过程属于定量实验。其中除配制一定物质的量浓度的溶液外,还有一个是 , 该实验过程中要进行多次读数,读数的方法是读出与的刻度值。
②任意写出一个该测定过程中所涉及的化学反应的离子方程式:。
32. 某兴趣小组利用Cl-取代[Co(NH3)6]3+离子中的NH3方法,制备配合物X:[Co(NH3)5Cl]Cl2。实验过程如下:CoCl2﹒6H2O
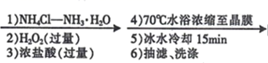 [Co(NH3)5Cl]Cl2晶体
[Co(NH3)5Cl]Cl2晶体 
已知:
a.配合物X 能溶于水,且溶解度随温度升高而增大。
b.[Co( NH3)5Cl]2+离子较稳定,但加碱再煮沸可促进其解离:[Co(NH3)5Cl]2+ Co3++5NH3+Cl。
c.H2O2参与反应时,明显放热。
请回答:
(1)、制备配合物X的总反应方程式为。(2)、“1) NH4Cl-NH3•H2O”时,如果不加NH4Cl固体,对制备过程的不利影响是。(3)、“2)H2O2”加H2O2 时应选择 _________(填序号)。A、冷水浴 B、温水浴( ≈60℃) C、沸水浴 D、酒精灯直接加热(4)、本实验条件下,下列物质均可将 Co(II)氧化为 Co(III)。其中可替代“2)H2O2”的是_____________(填序号)。A、O2 B、KMnO4 溶液 C、Cl2 D、HNO3(5)、实验小组用以下思路验证配合物 X 的组成:取一定量 X 加入过量浓 NaOH 溶液,煮沸,将生成的NH3 通入一定量的稀硫酸中,再用NaOH 标准溶液滴定剩余 H2SO4 。从以下涉及碱式滴定管的操作中,选择正确操作并排序(润洗只操作一次即可):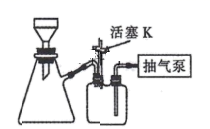
检漏→水洗→加标准液,润洗内壁→→→→→……
a.从上口倒出润洗液
b.保持滴定管夹水平,平视滴定管刻度读数
c.装标准溶液,调液面,静置半分钟
d.滴定
e.取下滴定管,竖直,平视滴定管刻度读数
f.从下口放出润洗液
(6)、下列关于实验过程的叙述,正确的是_____________(填序号)。A、“4)70℃”水浴加热,有利于获得颗粒较大的晶体 B、抽滤后,应该用热水洗涤晶体 C、可用 AgNO3和稀HNO3 检验配合物X 是否已经洗净 D、抽滤结束,可先打开活塞K,再关掉抽气泵33. 经多年勘测,2018年11月23日省自然资源厅发布消息称在皖江地区发现特大铜矿床,具有重大实际意义。以黄铜矿(主要成分为CuFeS2 , 含有少量PbS、Al2O3、SiO2)为原料制取胆矾的流程如下图:
已知:常温下Ksp[Fe(OH)3]=8.0×10-38 , Ksp[Al(OH)3]=3.0×10-33 , Ksp[Cu(OH)2]=3.0×10-20。
(1)、CuFeS2中硫元素的化合价为 , 硫元素在周期表中的位置是。写出上述流程中生成亚硫酸铵的离子方程式:。(2)、最适合的试剂A是(写化学式)溶液,固体2的成分为PbSO4和。当试剂A的浓度为6mol·L-1时 ,“浸出”实验中,铜的浸出率结果如图所示。所采用的最佳实验条件(温度、时间)为。 (3)、最适合的试剂B是(填序号),最适合的试剂C是(填序号),固体3的成分为。
(3)、最适合的试剂B是(填序号),最适合的试剂C是(填序号),固体3的成分为。a.Cl2 b.CuO c.酸性高锰酸钾溶液 d.NaOH e.H2O2 溶液 f.K2CO3
(4)、操作1如在实验室中进行,用到的玻璃仪器有烧杯、玻璃棒和 , 操作2的步骤为过滤、洗涤。(5)、根据已知信息,请计算:当Fe3+完全沉淀时,溶液中Al3+理论最大浓度为。(提示:当离子浓度≤1×10-5mol·L时,认为该离子沉淀完全)34. 利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4]生产铁红和补血剂乳酸亚铁。其生产步骤如下:
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42- , TiOSO4水解成TiO2·xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OHCOOH.请回答:
(1)、步骤①中分离硫酸重铁溶液和滤渣的操作是。(2)、加入铁屑的目一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2·xH2O滤渣,用平衡移动的原理解释得到滤渣的原因。(3)、硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为。(4)、用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因。(5)、步骤④的离子方程式是。(6)、步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及。(7)、乳酸亚佚晶体{[CH3CH(OH)COO]2Fe·3H2O}纯度的测量:若用KMnO4滴定法测定样品中Fe的量进而计算纯度时,发现结果总是大于100%,其原因可能是。经查阅文献后,改用Ce(SO4)2标准溶液滴定进行测定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760g样品,溶解后进行必要处理,用容量瓶配制成250mL溶液,每次取25.00mL,用0.1000mol/LCe(SO4)2标准溶液滴定至终点记录数据如下表。
滴定次数
0.1000mol/LCe(SO4)2标准溶液/Ml
滴定前读数
滴定后读数
1
0.10
19.85
2
0.12
21.32
3
1.05
20.70
4
0.16
19.88
则产品中乳酸亚铁晶体的纯度为(以质量分数表示)。
35. 某化学兴是小组对一种度旧合金(含有Cu、Fe、Si等元素)进行分离、回收利用,所设计工艺流程如下。
已知298℃时,Ksp[Fe(OH)3]=4.0×10-38 , Ksp[Cu(OH)2]=2.2×10-20 , Ksp[Mn(OH)2]=1.9×10-13 , 当离子浓度小于1×10-5认为离子沉淀完全。
回答下列问题:
(1)、操作I、lI、III为 , 固体A是(填化学式)。(2)、加入过量FeCl3溶液过程中与较不活泼的金属反应的化学方程式。(3)、调节pH至2.9~3.2的目的。(4)、①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为。②若将溶液b配制成250mL溶液,用滴定管取配制后的溶液25.00m1;再用a mol/L KMnO4溶液滴定,恰好反应时消耗KMnO4溶液VmL,则流程图中所得红棕色固体C的质量为g(用含a、v的代数式表示)
(5)、常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,最后沉淀的金属离子为(填金属阳离子)。(6)、用惰性电极电解(Cu2+、K+、Cl-溶液)一段时间后,阴、阳两极均产生标准状况下的气体6.72L,阴极析出固体3.2g,则原溶液Cl-的物质的量为。