高考二轮复习知识点:化学实验安全及事故处理
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 实验室安全至关重要,下列实验室事故处理方法错误的是A、眼睛溅进酸液,先用大量水冲洗,再用饱和碳酸钠溶液冲洗 B、皮肤溅上碱液,先用大量水冲洗,再用的硼酸溶液冲洗 C、电器起火,先切断电源,再用二氧化碳灭火器灭火 D、活泼金属燃烧起火,用灭火毯(石棉布)灭火2. 用中子轰击 X原子产生α粒子(即氮核 He)的核反应为: X+ n→ Y+ He。已知元素Y在化合物中呈+1价。下列说法正确的是( )A、H3XO3可用于中和溅在皮肤上的NaOH溶液 B、Y单质在空气中燃烧的产物是Y2O2 C、X和氢元素形成离子化合物 D、6Y和7Y互为同素异形体3. 用浓硫酸配制稀硫酸时,不必要的个人安全防护用品是( )A、实验服 B、橡胶手套 C、护目镜 D、磷酸氢钙4. 化学与生活密切相关。下列说法错误的是A、泡沫灭火器可用于一般的起火,也适用于电器起火 B、疫苗一般应冷藏存放,以避免蛋白质变性 C、家庭装修时用水性漆替代传统的油性漆,有利于健康及环境 D、电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法5. 关于安全问题的应对措施,下列说法错误的是A、氰化钠(NaCN)有剧毒,不慎泄漏,可喷洒双氧水处理 B、误食中毒,可以用5%的硫酸钠溶液洗胃解毒 C、皮肤受伤时,可以用75%的乙醇溶液消毒处理,利用的是乙醇的氧化性 D、苯酚对皮肤有腐蚀性,不慎沾到皮肤上,应立即用酒精冲洗,再用水冲洗6. 实验室中下列做法错误的是A、金属钠着火时使用泡沫灭火器灭火 B、高锰酸钾固体保存在棕色广口瓶中 C、配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加入水稀释 D、浓硫酸沾到皮肤上,立即用大量水冲洗,然后用3%~5%NaHCO3溶液冲洗7. 下列说法错误的是A、少量酸(或碱)滴到实验桌上,应立即用湿抹布擦净,然后用水冲洗抹布 B、易燃物钠、钾、白磷未用完,不能放回原试剂瓶 C、酸碱中和滴定实验中,滴至接近终点时,需改为半滴滴加 D、粗苯甲酸样品中的氯化钠杂质可通过重结晶除去8. 下列有关实验说法正确的是A、对于含重金属(如铅、汞或镉等)离子的废液,可用Na2S或NaOH进行沉淀处理 B、配制溶液时,烧杯中溶液直接倒入容量瓶,再用蒸馏水洗涤,洗涤液一并倒入 C、滴定用的锥形瓶装待测液前需要保持干燥,并用待测液润洗2~3次 D、向CuSO4溶液中滴加氨水至难溶物溶解得深蓝色溶液,再加入乙醇,无明显变化9. 下列说法错误的是( )A、纸层析法可用来分离物理性质和化学性质相似的物质 B、久置的NaOH标准溶液,用来滴定时要重新标定浓度 C、滴定管内粘有油污,可用溶液浸洗,洗用后的放回原瓶 D、烫伤先用冷水洗,若皮肤已破可用溶液消毒10. 下列有关实验的说法正确的是( )A、将乙醇和浓硫酸混合加热,产生的气体直接通入酸性高锰酸钾溶液中,溶液褪色,证明反应产生了乙烯 B、用少量金属钠与胆矾晶体隔绝空气加热,产生红色固体,可证明金属性Na>Cu C、用滴定法进行定量测定时,基准物应该具有性质稳定、相对分子质量较小等特点 D、不慎溴腐蚀致伤时,先用酒精或甘油洗涤,再用水冲洗11. 下列说法不正确的是( )A、受酸腐蚀致伤,先用大量水冲洗,再用稀氨水、肥皂水或饱和碳酸氢钠溶液洗,最后再用水洗 B、饱和FeSO4溶液中加入适量(NH4)2SO4晶体,经过滤、洗涤,即可得纯净的硫酸亚铁铵晶体 C、市售食醋总酸含量大约5%,浓度接近1mol·L-1 , 稀释10倍再进行滴定,可减小误差 D、实验室完成焰色反应时,若无铂丝,可用铁丝代替,但不可用铜丝或玻璃棒12. 下列说法正确的是A、食物中毒时,可以先饮入大量饱和硫酸铜溶液催吐,并立即送医 B、打磨后的铝片绕成螺旋状,待火柴快燃尽时伸入盛有氧气的集气瓶中发出耀眼的白光 C、用纸层析法分离铁离子和铜离子时,可将配好的展开剂沿着大试管内壁注入大试管底部 D、向滴有甲基橙的乙酸乙酯水溶液中加入少量硫酸溶液,上层溶液显橙色13. 下列说法正确的是( )A、配制一定物质的量浓度溶液时,第一次转移溶液后玻璃棒应放在洁净的表面皿上 B、氨气、溴中毒要立即到室外呼吸新鲜空气,并进行人工呼吸 C、阿司匹林粗产品中加入溶液,过滤,加酸后于冰水中得到较纯产品 D、碘的萃取实验中,苯分批加入萃取效果优于一次性加入14. 下列说法错误的是( )A、次氯酸钙具有较强的氧化性,可用作漂白剂 B、碳酸钠能与盐酸反应,可用作治疗胃酸过多的一种药剂 C、冰晶石 能使氧化铝的熔融温度降低,可用于电解氧化铝制取铝工艺 D、硫能与汞化合,实验室常将硫磺洒在汞的表面,以除去不慎洒落的汞15. 下列说法错误的是( )A、误吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒 B、焰色反应实验可用细铁丝代替铂丝 C、为保持滴定的精确,滴定过程中严禁滴定管的尖嘴接触锥形瓶内壁 D、将两块未擦去氧化膜的铝片分别投入到1mol·L-1CuSO4溶液和1mol·L-1CuCl2溶液中,一段时间后,在CuCl2溶液中铝片表面能观察到明显的反应现象16. 下列有关实验的说法,错误的是( )A、分离及检验海带中的碘元素时,需要向海带灰的浸取液中加入少量硫酸和过氧化氢溶液 B、可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油 C、实验时酸或碱溅到眼中,应立即用水反复冲洗,并不断眨眼,不能用手搓揉眼睛 D、将移液管中液体放出时,移液管不能与容器内壁接触,以免污染试剂17. 下列有关实验说法正确的是( )A、酒精灯加热烧瓶时不用垫石棉网 B、金属钠着火时,可用细沙覆盖灭火 C、可用蒸馏的方法分离乙醇(沸点78.3℃)和苯(沸点80.1℃) D、用容量瓶配制溶液,若加水超过刻度线,可用滴管吸出多余液体18. 新冠病毒的消毒剂有多种,下列说法错误的是( )A、75%酒精能使蛋白质变性,其消毒效果比无水酒精好 B、市售84消毒液(主要成分为NaClO)可敞口保存且使用时不需稀释 C、过氧乙酸(CH3COOOH)具有强氧化性,具有很强的杀菌能力 D、若不慎将苯酚沾到皮肤上,应立即用酒精洗涤,再用水冲洗19. 下列说法错误的是( )A、氯酸钾、高锰酸钾等强氧化剂或其混合物不能研磨 B、移液管或者滴定管可精确量取一定体积的溶液 C、元素分析仪可以确定物质中是否含有C、H、O、S等元素 D、纸层析法只能用于分离有色物质,否则无法看到色斑20. 下列有关实验说法,错误的是( )A、酸液不慎溅到手上,可先用大量水冲洗,再用稀氨水或肥皂水洗,最后用水冲洗 B、KCl 固体中的 NaCl 杂质,可用饱和 KCl 溶液充分浸泡过滤除去,取浸泡液,焰色反应仍显黄色,则说明 NaCl 还未除尽 C、“静置”也是一种必要的实验操作,比如:淀粉、硫酸加热水解实验后需静置后才能滴加碘水来检验水解程度,滴定管读数前、移液管移取液体、萃取分液时…等等 D、邻苯二甲酸氢钾是一种常用的基准物质,在标定 NaOH 溶液时,应用酚酞为指示剂21. 为探究铁和硫反应产物中铁的化合价,某同学设计了如下所示的实验过程:

已知:①铁和硫反应产物不溶于碱,能溶于硫酸
②硫可溶于热碱溶液,发生类似于 Cl2 和 NaOH 溶液的化学反应下列说法不正确的是( )
A、混合粉末应在 N2 氛围中进行加热,所用 H2SO4 溶液应先煮沸 B、取溶液 A,滴加 KSCN 溶液,未出现红色,可证明铁和硫反应只有+2 价铁生成 C、滤渣用稀 H2SO4 溶解时应在通风橱中进行 D、硫溶于热碱溶液可能发生的离子反应是3S+6OH- 2S2-+SO32-+3H2O22. 根据所给的信息和标志,判断下列说法错误的是( )A
B
C
D
《神农本草经》记载,麻黄能“止咳逆上气”
碳酸氢钠药片



古代中国人已用麻黄治疗咳嗽
该药是抗酸药,服用时喝些醋能提高药效
看到有该标志的丢弃物,应远离并报警
贴有该标志的物品是可回收物
A、A B、B C、C D、D23. 下列行为中,符合安全要求的是( )A、节日期间,在任意场所燃放烟花爆竹 B、实验时,将水倒入浓硫酸配置稀硫酸 C、煤矿矿井,必须通风,严禁烟火 D、用点燃的火柴在液化气钢瓶口检验是否漏气24. 化学知识在生产和生活中有着重要的应用。下列说法正确的是( )A、危化品仓库中的金属钠、钾着火时,可用水扑灭 B、自来水厂常用明矾作为天然水的消毒剂 C、纯碱在医疗上是治疗胃酸过多的一种药剂 D、氧化铝可用来制造耐高温的实验仪器25. 关于化学实验,下列说法正确的是( ) A、图1操作可除去碱式滴定管胶管中的气泡 B、图2装置课用作蒸馏时的接收装置 C、图3可证明元素的非金属性:Cl>C>Si D、图4装置可用于除去Cl2中的水蒸气26.
A、图1操作可除去碱式滴定管胶管中的气泡 B、图2装置课用作蒸馏时的接收装置 C、图3可证明元素的非金属性:Cl>C>Si D、图4装置可用于除去Cl2中的水蒸气26.下列装置及相应操作能达到实验目的的是( )
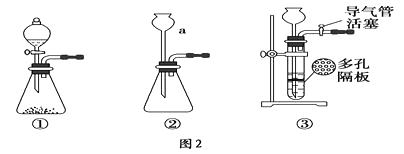
 A、装置①可用于“海带提碘”实验中将海带灼烧成灰 B、装置②可用于H2O2分解速率的测定 C、装置③可用于氨气的收集 D、装置④可用于实验室制取乙酸乙酯27. 《中华人民共和国安全生产法》指出安全生产工作应当以人为本,坚持安全发展、预防为主、综合治理的方针.下列做法不正确的是( )A、面粉生产车间应严禁烟火 B、NH3泄露时向空中喷洒水雾 C、含Cl2的尾气用碱溶液处理后再排放 D、金属钠失火时应立即用大量冷水扑灭
A、装置①可用于“海带提碘”实验中将海带灼烧成灰 B、装置②可用于H2O2分解速率的测定 C、装置③可用于氨气的收集 D、装置④可用于实验室制取乙酸乙酯27. 《中华人民共和国安全生产法》指出安全生产工作应当以人为本,坚持安全发展、预防为主、综合治理的方针.下列做法不正确的是( )A、面粉生产车间应严禁烟火 B、NH3泄露时向空中喷洒水雾 C、含Cl2的尾气用碱溶液处理后再排放 D、金属钠失火时应立即用大量冷水扑灭二、多选题
-
28. 下列叙述正确的是( )A、钾、钠、镁等活泼金属着火时,可用泡沫灭火器灭火 B、证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾﹣淀粉试纸检验,观察试纸颜色的变化 C、除去铝粉中混有的铜粉,可先用浓硝酸溶解,然后再过滤、洗涤、干燥 D、Ba2+浓度较高时危害健康,BaCO3不能作为造影剂用于X﹣射线检查肠胃道疾病
三、非选择题
-
29. B.[实验化学]
丙炔酸甲酯( CH≡C-COOCH3 )是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为

实验步骤如下:
步骤1:在反应瓶中,加入14 g丙炔酸、50 mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。
步骤2:蒸出过量的甲醇(装置见下图)。
步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。
 (1)、步骤1中,加入过量甲醇的目的是。(2)、步骤2中,上图所示的装置中仪器A的名称是;蒸馏烧瓶中加入碎瓷片的目的是。(3)、步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是;分离出有机相的操作名称为。(4)、步骤4中,蒸馏时不能用水浴加热的原因是。30.
(1)、步骤1中,加入过量甲醇的目的是。(2)、步骤2中,上图所示的装置中仪器A的名称是;蒸馏烧瓶中加入碎瓷片的目的是。(3)、步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是;分离出有机相的操作名称为。(4)、步骤4中,蒸馏时不能用水浴加热的原因是。30.(15分)凯氏定氨法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量.已知:NH3+H3BO3=NH3•H3BO3;NH3•H3BO3+HCl=NH4Cl+H3BO3 .
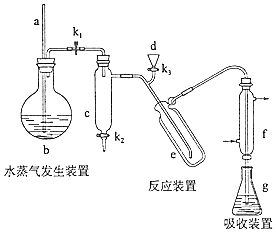
回答下列问题:
(1)、a的作用是 .(2)、b中放入少量碎瓷片的目的是 . f的名称是 .(3)、清洗仪器:g中加蒸馏水:打开K1 , 关闭K2、K3 , 加热b,蒸气充满管路:停止加热,关闭K1 , g中蒸馏水倒吸进入c,原因是;打开K2放掉水,重复操作2~3次.(4)、仪器清洗后,g中加入硼酸(H3BO3)和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭K1 , d中保留少量水,打开K1 , 加热b,使水蒸气进入e.①d中保留少量水的目的是 .
②e中主要反应的离子方程式为 , e采用中空双层玻璃瓶的作用是 .
(5)、取某甘氨酸(C2H3NO2)样品m 克进行测定,滴定g中吸收液时消耗浓度为cmol•L﹣1的盐酸V mL,则样品中氮的质量分数为%,样品的纯度≤%.31. 氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。
甲同学的实验方案如下:
(1)、仪器的组装连接:上述仪器装置接口的连接顺序为 , 加入药品前首先要进行的实验操作是(不必写出具体的操作方法);其中装置B的作用是。(2)、添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯(一种有机化合物)中浸洗数次,该操作的目的是除去锂表面的石蜡,然后快速把锂放入到石英管中。通入一段时间氢气后加热石英管,在加热D处的石英管之前,必须进行的实验操作是。(3)、加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险。分析该反应原理,完成LiH与水反应的化学方程式。(4)、准确称量制得的产品0.174g,在一定条件下与足量水反应后,共收集到气体470.4mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为。32. 氮元素的单质和常见的化合物在工、农业生产中用途广泛。(1)、Ⅰ.常用作食品袋中填充气的是 , 常用作制冷剂的化合物是 , 该物质在空气中与HCl相遇有白烟现象,产生该现象的化学反应方程式是。(2)、铵盐大多在农业上用作化肥。工业制备氨气的化学反应方程式为。(3)、Ⅱ.某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究。回答下列问题:
若用装置①制取并收集干燥的NH3 , 其反应的化学方程式为;若要测定生成的NH3的体积,则必须选择的装置是(填装置序号),装置中所盛试剂具有的性质是。
(4)、若用装置②制取并收集干燥的NH3 , 烧瓶内装的试剂是 , 分液漏斗中装的试剂是 , 收集装置应选择(填装置序号)。(5)、用如图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是。该实验的原理是 (6)、如果只提供如图2的装置,请说明引发喷泉的方法,。(7)、为防止污染环境,以下装置(盛放的液体均为水)可用于吸收多余氨气的是(填序号)。
(6)、如果只提供如图2的装置,请说明引发喷泉的方法,。(7)、为防止污染环境,以下装置(盛放的液体均为水)可用于吸收多余氨气的是(填序号)。 33. Fe3O4是重要的化学试剂,其化学式还可以表示为FeO·Fe2O3 , 铁粉在氧气中燃烧是制取它最为常见和快捷的方法。图1是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。
33. Fe3O4是重要的化学试剂,其化学式还可以表示为FeO·Fe2O3 , 铁粉在氧气中燃烧是制取它最为常见和快捷的方法。图1是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。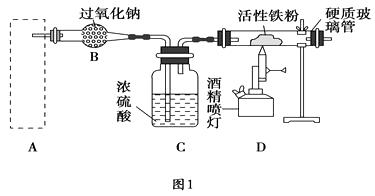
 (1)、图2中仪器a的名称是。(2)、根据题目要求,在图2中最好选择(填序号)作为A装置。(3)、对图2中装置②进行气密性检查的方法是。(4)、在B装置中发生的主要反应的化学方程式是。(5)、反应一段时间后,若将硬质玻璃管中的固体粉末用盐酸溶解,取少许溶液于试管中,加入淀粉碘化钾溶液,没有蓝色出现,推测固体粉末中除Fe3O4外,一定有(填名称)。(6)、写出Fe3O4溶于足量稀硫酸的离子方程式 , 要检验所得溶液中的Fe3+ , 常用试剂是(填名称)。
(1)、图2中仪器a的名称是。(2)、根据题目要求,在图2中最好选择(填序号)作为A装置。(3)、对图2中装置②进行气密性检查的方法是。(4)、在B装置中发生的主要反应的化学方程式是。(5)、反应一段时间后,若将硬质玻璃管中的固体粉末用盐酸溶解,取少许溶液于试管中,加入淀粉碘化钾溶液,没有蓝色出现,推测固体粉末中除Fe3O4外,一定有(填名称)。(6)、写出Fe3O4溶于足量稀硫酸的离子方程式 , 要检验所得溶液中的Fe3+ , 常用试剂是(填名称)。
34. 焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。已知:① 装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2=Na2S2O5;② Na2S2O5晶体在空气中被氧化生成Na2SO4。
 (1)、装置Ⅰ中产生气体的化学方程式为:。(2)、要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是。(3)、装置Ⅲ用于处理尾气,可选用右图中最合理装置(夹持仪器已略去)为(填序号)。
(1)、装置Ⅰ中产生气体的化学方程式为:。(2)、要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是。(3)、装置Ⅲ用于处理尾气,可选用右图中最合理装置(夹持仪器已略去)为(填序号)。 (4)、检测Na2S2O5晶体在空气中已被氧化的实验方案是:。(5)、为了研究Cl2与SO2的在干燥条件下发生反应及进行的程度。用右下图所示装置收集满干燥的Cl2 , 再通入干燥的SO2 , 集气瓶中立即出现无色液体SO2Cl2; 充分反应后,将液体和剩余气体分离。用除尽空气的NaOH溶液吸收分离出的气体,用足量稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀,该白色沉淀是 , 由此可知反应后剩余的气体为Cl2和 , 综合实验信息,干燥的SO2与Cl2反应的化学方程式为。
(4)、检测Na2S2O5晶体在空气中已被氧化的实验方案是:。(5)、为了研究Cl2与SO2的在干燥条件下发生反应及进行的程度。用右下图所示装置收集满干燥的Cl2 , 再通入干燥的SO2 , 集气瓶中立即出现无色液体SO2Cl2; 充分反应后,将液体和剩余气体分离。用除尽空气的NaOH溶液吸收分离出的气体,用足量稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀,该白色沉淀是 , 由此可知反应后剩余的气体为Cl2和 , 综合实验信息,干燥的SO2与Cl2反应的化学方程式为。 35. 某化学兴趣小组设计如下实验方案。将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如下图所示:
35. 某化学兴趣小组设计如下实验方案。将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如下图所示:
请回答下列问题:
(1)、装置B的作用是。(2)、设计装置C的目的是验证SO2的性,装置C中发生反应的离子方程式是。装置D中NaOH全部转化为NaHSO3的标志是。(3)、向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:I.HSO3-与ClO-恰好反应
Ⅱ.NaClO不足
Ⅲ.NaClO过量

甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
(4)、请设计简单实验证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小:。
-